Тринитротолуен
- За другу употребу, погледајте чланак ТНТ.
- „Трилит” преусмерава овде. За друге употребе, погледајте Трилит (грађевина)
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
2-метил-1,3,5-тринитробензен
| |||
| Други називи
2,4,6-Тринитротолуен,
ТНТ, Трилит, Толит, Тринол, Тротил, Тритоло, Тритолол, Тритон, Тротол, Тринитротолуол, 2,4,6-Тринитрометилбензен | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Абревијација | TNT | ||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.900 | ||
| EC број | 204-289-6 | ||
| KEGG[1] | |||
| UNII | |||
| UN број | 0209 – Dry or wetted with < 30% water 0388, 0389 – Mixtures with trinitrobenzene, hexanitrostilbene | ||
| |||
| |||
| Својства | |||
| C7H5N3O6 | |||
| Моларна маса | 227,13 g/mol | ||
| Агрегатно стање | бледожут. | ||
| Густина | 1,654 g/cm3 | ||
| Тачка топљења | 80.35 °C | ||
| Тачка кључања | 295 °C | ||
| 0.13 g/L (20 °C) | |||
| Растворљивост у етар, ацетон, бензен, пиридин | растворан је | ||
| Експлозивност | |||
| Осетљивост на шок | Неосетљив | ||
| Осетљивост на трење | Неосетљив до 353 N | ||
| РЕ фактор | 1.00 | ||
| Опасности | |||
ЕУ класификација (DSD)
|
Експлозив (E) Токсичан (T) Опасан по животну средину (N) | ||
| R-ознаке | R2, R23/24/25, R33, R51/53 | ||
| S-ознаке | (S1/2), S35, S45, S61 | ||
| NFPA 704 | |||
| Сродна једињења | |||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Тринитротолуен познатији као ТНТ, тачније 2,4,6-тринитротолуен, и по његовом преферираном ИУПАЦ-у назив 2-метил-1,3,5-тринитробензен, је хемијска супстанца са формулом C6H2(NO2)3CH3.[4][5] ТНТ се повремено користи као реагенс у хемијској синтези, али је најпознатији као експлозивни материјал са погодним особинама за руковање. Експлозивни принос ТНТ-а сматра се стандардном упоредном конвенцијом бомби и удара астероида. У хемији, ТНТ се користи за стварање соли за пренос наелектрисања.
Ово једињење је први припремио 1863. године немачки научник Јулијус Вилбранд (нем. Julius Bernhard Friedrich Adolph Wilbrand), покушавајући да добије средство за бојење, а двадесет година касније откривено је да се ради о веома јаком експлозиву.[6]
Историја
[уреди | уреди извор]ТНТ је први пут припремио немачки хемичар Јулиус Вилбранд 1863.[7] и првобитно је коришћен као жута боја. Његов потенцијал као експлозива није препознат три деценије, углавном зато што је било претешко га детонирати јер је био мање осетљив од алтернатива. Његове експлозивне карактеристике први је открио 1891. други немачки хемичар, Карл Хосерман.[8] ТНТ се може безбедно сипати у течном стању у чауре, и толико је неосетљив да је 1910. изузет из Закона о експлозивима Уједињеног Краљевства из 1875. и није се сматрао експлозивом за потребе производње и складиштења.[9]
Немачке оружане снаге су га усвојиле као пуњење за артиљеријске гранате 1902. Гранате за пробијање оклопа пуњене ТНТ-ом би експлодирале након што би продрле у оклоп британских капиталних бродова, док су британске гранате пуњене лидитом имале тенденцију да експлодирају при удару о оклоп, тако трошећи велики део своје енергије ван брода.[9] Британци су почели да замењују Лидит са ТНТ-ом 1907.[10]
Морнарица Сједињених Америчких Држава наставила је да пуни оклопне гранате експлозивом Д након што су неке друге нације прешле на ТНТ, али је почела да пуни поморске мине, бомбе, дубинске бомбе и бојеве главе торпеда експлозивним пуњењем сировог ТНТ-а класе Б боје смеђег шећера, и захтева експлозивно појачано пуњење од гранулисаног кристализованог ТНТ-а за детонацију. Експлозивне гранате биле су пуњене ТНТ-ом разреда А, који је постао пожељнији за друге употребе пошто је индустријски хемијски капацитет постао доступан за уклањање ксилена и сличних угљоводоника из сировине толуена и других нуспроизвода изомера нитротолуена из реакција нитрирања.[11]
-
Комади ТНТ-а за експлозиве
-
Тринитротолуен који се топи на 81 °C (178 °F)
-
Артиљеријске гранате М795 са уграђеним упаљачима, означене да означавају пуњење ТНТ-а
-
Група минобацачких граната М120 Рак. Тамнозелене чауре са леве стране су уцртане да указују на пуњење ТНТ-а
-
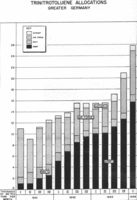
Анализа производње ТНТ-а по огранцима немачких оружаних снага између 1941. и првог квартала 1944. године, приказана у хиљадама тона месечно
-
Детонација ТНТ експлозивног пуњења од 500 тона као део операције Морнарски шешир 1965. Пролазни талас експлозије оставио је белу водену површину иза себе и бели кондензациони облак је видљив изнад главе.
Производња
[уреди | уреди извор]У индустрији, ТНТ се производи у процесу од три корака. Прво, толуен се нитрира мешавином сумпорне и азотне киселине да би се добио мононитротолуен (МНТ). МНТ се одваја и затим ренитира у динитротолуен (ДНТ). У последњем кораку, ДНТ се нитрира у тринитротолуен (ТНТ) коришћењем анхидроване мешавине азотне киселине и олеума. Азотна киселина се троши у процесу производње, али разблажена сумпорна киселина се може поново концентрисати и поново користити. Након нитрирања, ТНТ се стабилизује процесом који се назива сулфитација, где се сирови ТНТ третира воденим раствором натријум сулфита раствор за уклањање мање стабилних изомера ТНТ-а и других нежељених производа реакције. Вода за испирање од сулфитације позната је као црвена вода и представља значајан загађивач и отпадни производ производње ТНТ-а.[12]
Контрола азотних оксида у азотној киселини хране је веома важна јер слободни азот-диоксид може довести до оксидације метил групе толуена. Ова реакција је веома егзотермна и носи са собом ризик од несталне реакције која води до експлозије.
У лабораторији, 2,4,6-тринитротолуен се производи поступком у два корака. Мешавина за нитрирање концентроване азотне и сумпорне киселине се користи за нитрирање толуена у смешу изомера моно - и ди-нитротолуена, уз пажљиво хлађење да би се одржала температура. Нитровани толуени су затим одвојени, испрани разблаженим натријум бикарбонатом да би се уклонили оксиди азота, а затим пажљиво нитровани мешавином димеће азотне и сумпорне киселине.
Апликације
[уреди | уреди извор]ТНТ је један од најчешће коришћених експлозива за војне, индустријске и рударске примене. ТНТ је коришћен заједно са хидрауличким фрактурисањем (популарно познатим као фрацкинг), процесом који се користи за добијање нафте и гаса из шкриљца. Техника укључује измештање и детонацију нитроглицерина у хидраулички изазваним ломовима праћеним ударима из бушотине коришћењем пелетизованог ТНТ-а.[13]
ТНТ је цењен делом због своје неосетљивости на ударце и трење, са смањеним ризиком од случајне детонације у поређењу са осетљивијим експлозивима као што је нитроглицерин. ТНТ се топи на 80 °C (176 °F), далеко испод температуре на којој ће спонтано детонирати, омогућавајући му да се сипа или безбедно комбинује са другим експлозивима. ТНТ нити апсорбује нити се раствара у води, што му омогућава да се ефикасно користи у влажним срединама. Да би детонирао, ТНТ мора бити покренут таласом притиска из стартног експлозива, који се зове појачивач експлозива.[14]
Иако су блокови ТНТ-а доступни у различитим величинама (нпр. 250 г, 500 г, 1000 г), чешће се сусрећу у синергистичким експлозивним мешавинама које садрже променљиви проценат ТНТ-а и других састојака. Примери експлозивних мешавина које садрже ТНТ укључују:
- Аматекс (амонијум нитрат и Хексоген)[15]
- Amatol (амонијум нитрат[16])
- Амонал (амонијум нитрат и алуминијумски прах плус понекад и угаљ).
- Баратол (баријум нитрат и восак)
- Композиција Б (Хексоген) и парафински восак[17])
- Композиција H6
- Циклотол (Хексоген)[18]
- Еднатол
- Хексанит (hexanitrodiphenylamine[19][20])
- Минол
- Октол
- Пентолит
- Пикратол
- Тетритол
- Торпекс
- Тритонал
Особине
[уреди | уреди извор]Жуте је боје и позната је као експлозив. Користи се и као јединица за мерење јачине експлозија (нуклеарних, конвенционалних,...).
ТНТ је најраспрострањенији и најважнији војни експлозив због својих особина; јер је бризантни екcплозив, лако се лије, пресује и чува, стабилан је и може дуго да се складишти. Примењује се у скоро свим типовима артиљеријске муниције. Самостално у тренутним гранатама и помешан са хексогеном у односу 60:40% у противоклопним кумулативним гранатама.
Основне карактеристике експлозива
[уреди | уреди извор]Ево неке од основних карактеристика ТНТ експлозива:
| Експлозивна својства ТНТ-а[21] | |
|---|---|
| Година проналаска | 1863 |
| Енергија детонације | 3,9 MJ/kg |
| Траузелов тест | 300 cm³/10 g |
| Максимални притисак детонације | 22,3 GPa |
| Брзина детонације (Vdet) | 6,9 km/s |
| Густина која одговара Vdet | 1,57 g/cm³ |
| Температура детонације[22] | 470 °C |
| Осетљивост на удар | мало |
| Запремина гасовитих производа | 700 dm³/kg |
| Температура током детонације | ~3.100 °C (5.610 °F) |
| Енергија експлозије | 4.100–4.220 кЈ / kg, тј. 980–1010 kcal/kg (без секундарне оксидације чађи) |
| Специфична топлота сагоревања | 4.184 МЈ/kg |
| Детонациони притисак Pcj: | 190-220 kbar према прорачунској или експерименталној методи, обично на доњој граници опсега. |
Хемијска реакција
[уреди | уреди извор]Због брзог распада и егзотермијске реакције (хемијска реакција у којој се производи енергија), реакција је експлозивна, што је последица брзог пораста ваздушног притиска.
- 2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C
Експлозивни карактер
[уреди | уреди извор]Након детонације, ТНТ подлеже разградњи која је еквивалентна реакцији:
- 2 C7H5N3O6 → 3 N2+ 5H2O_+ 7 CO + 7 C
а нарочито:
- 2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C
или
- 2 C7H5N3O6 → 3 N2+H2+ 4H2C2 _ _+ 6CO2
- C7H5N3O6 → 3 HCN + H2O + 3 CO + CO2
- C7H5N3O6 → HCN + (CN)2 + 2 H2O + 4 CO
- 2 C7H5N3O6 → 6 NO + 5 H2C2 + 2 CO + 2 CO2
- 2 C7H5N3O6 → 6 HCNO + 2 H2C2 + 2 CO + 2 CO2
плус неке од реакција
- H
2 + CO → H
2O + C
и
- 2 CO → CO
2 + C.
Реакција је егзотермна, али има високу енергију активације у гасној фази (~62 kcal/mol). Кондензоване фазе (чврсте или течне) показују значајно нижу енергију активације од отприлике 35 kcal/mol због јединствених бимолекуларних путева разлагања при повишеним густинама.[23] Због производње угљеника, експлозије ТНТ-а имају чађав изглед. Пошто ТНТ има вишак угљеника, експлозивне смеше са једињењима богатим кисеоником могу дати више енергије по к..lилограму него сам ТНТ. Током 20. века аматол, мешавина ТНТ-а са амонијум нитратом, био је широко коришћен војни експлозив.
ТНТ се може детонирати иницијатором велике брзине.[24] Дуги низ година, ТНТ је био референтна тачка за фигуру неосетљивости. ТНТ је имао оцену тачно 100 на скали „Ф до И“. Референца је од тада промењена у осетљивији експлозив који се зове Хексолит, који има Ф до И оцену 80.
Пиротехничка својства и употреба
[уреди | уреди извор]Као експлозив, показује изузетно добра својства – веома је стабилан и није много осетљив на спољашње утицаје, а истовремено га карактерише веома висока експлозивност и снажна експлозија. Због тога је идеална супстанца за припрему индустријских и војних експлозива. Често се меша са другим експлозивним супстанцама у различитим размерама и може се наћи под трговачким називима Пермонит, Пермонекс, Карпатит, Аматол која се користи у војсци и многи други су такође познати.
Пошто су његова експлозивна својства веома добро истражена, еквивалентна количина ТНТ-а у килотонима (кт) или мегатонима (Мт) је дата да би се изразила снага нуклеарне или термонуклеарне експлозије. Ово је, наравно, погрешно, јер количине ТНТ-а веће од 100 тона могу да изазову значајно секундарно паљење чађи настале након експлозије, што значи да 100 тона ТНТ-а има еквивалентну енергију ослобођену као 130 тона пуњења.
Као што је већ поменуто, типична карактеристика експлозије ТНТ-а је формирање облака чађи након експлозије због релативно ниског и негативног баланса кисеоника. Захваљујући томе, чак и мале количине се понашају као слаб термобарични експлозив, на пример, 200 g ТНТ-а може имати стварну излазну енергију од 225 g током детонације (тј. у поређењу са теоретском вредношћу од 8,2 МЈ, око 9 МЈ енергије ТНТ-а се брзо изненађујуће генерише у малим количинама ударни талас који се може упоредити са Семтекс-ом, иако би се наивно очекивало 20% предности Семтекс-а (међутим, ово зависи од студије и неки показују импулсе ударног таласа који су у складу са нултом брзом оксидацијом чађи).
1 kg ТНТ-а има 50% смртности од ударног таласа на удаљености од око 1,4 м (удаљеност између пуњења и горње половине тела, без обзира на оријентацију особе). 4,5 kg има стопу смртности од око 99% на удаљености од 2,5 м. Међутим, чак и када се користи 10 kg, убојна зона није већа од око 4-5 м. Модерне гранате од 155 мм садрже мање од 11 kg ТНТ-а, минобацачке гранате од 60 мм имају око 200 g, а проширене ручне бомбе око 100 g. У конвенционалним бомбама, 30-70% енергије се користи за фрагментацију, а не за стварање таласа притиска. Због тога талас притиска генерално није погодан ефикасан механизам за одлагање живе силе, па је стога главна сврха ТНТ-а да убрза фрагменте.
Енергетски садржај
[уреди | уреди извор]
Топлота детонације коју користи НИСТ да дефинише тону еквивалента ТНТ-а је 1000 cal/g или 1000 kcal/kg, 4,184 MJ/kg или 4,184 GJ/ton.[25] Густина енергије ТНТ се користи као референтна тачка за многе друге експлозиве, укључујући нуклеарно оружје, чији се енергетски садржај мери у еквивалентним килотонима (~4,184 тераџула или 4,184 ТЈ или 1,162 ГВх) или мегатонима (~4,184 пета џула или 4.184 ПЈ или 1.162 ТВх) ТНТ-а. Међутим, топлота сагоревања износи 14,5 мега џула по килограму или 14,5 MJ/kg или 4,027 kWh/kg, што захтева да део угљеника у ТНТ-у реагује са атмосферским кисеоником, што се не дешава у почетном догађају.[26]
Поређења ради, барут садржи 3 мегаџула по килограму, динамит 7,5 мегаџула по килограму, а бензин 47,2 мегаџула по килограму (иако је за бензин потребан оксиданс, тако да оптимизована мешавина бензина и О 2 садржи 10,4 мегаџула по килограму).
Детекција
[уреди | уреди извор]За откривање TNT могу се користити различите методе, укључујући оптичке и електрохемијске сензоре и псе који њушкају експлозив. 2013. године, истраживачи са Индијског института за технологију који су користили квантне кластере племенитих метала могли су да открију ТНТ на суб-зептомоларном (10−18 mol/m³) нивоу.[27]
Цена коштања ТНТ-а
[уреди | уреди извор]Sa 6 dolara po funti, ТНТ među najjeftinijim je vojnim eksplozivima (varira od 5-100 dolara).
Zbog male snage po masi, nije pogodan za bojeve glave raketa, ali je pogodan za nagazne mine i druge objekte bez ograničenja mase.
Безбедност и токсичност
[уреди | уреди извор]ТНТ је отрован, а контакт са кожом може изазвати иритацију коже, узрокујући да кожа добије јарко жуто-наранџасту боју. Током Првог светског рата, жене које су се бавиле овом хемикалијом откриле су да им је кожа постала јарко жута, што је довело до тога да су добиле надимак „канаринке“.[28]
Људи изложени ТНТ-у током дужег периода имају тенденцију да доживе анемију и абнормалне функције јетре. Ефекти крви и јетре, повећање слезине и други штетни ефекти на имуни систем такође су пронађени код животиња које су уносиле или удисале тринитротолуен. Постоје докази да ТНТ негативно утиче на плодност мушкараца.[29] ТНТ је наведен као могући канцероген за људе, са канцерогеним ефектима који су демонстрирани у експериментима са животињама на пацовима, иако ефекти на људе до сада нису никакви (према ИРИС-у од 15. марта 2000).[30] Потрошња ТНТ-а производи црвену мокраћу кроз присуство производа разградње а не крви како се понекад верује.[31]
Неки војни полигони су контаминирани отпадним водама из програма за муницију, укључујући контаминацију површинских и подземних вода које могу бити обојене у розе боје због присуства ТНТ-а. Таква контаминација, названа „ружичаста вода“, може бити тешко и скупа за отклањање.
ТНТ је склон ексудацији динитротолуена и других изомера тринитротолуена када се пројектили који садрже ТНТ чувају на вишим температурама у топлијим климама. Ексудација нечистоћа доводи до стварања пора и пукотина (што заузврат узрокује повећану осетљивост на ударце). Неисправност осигурача такође може бити резултат миграције течности у механизам осигурача.[32] Калцијум силикат се меша са ТНТ-ом да би се ублажила склоност ка ексудацији.[33]
Ружичаста и црвена вода
[уреди | уреди извор]Ружичаста вода и црвена вода су две различите врсте отпадних вода које се односе на тринитротолуен.[34] Ружичаста вода се производи процесима прања опреме након пуњења муницијом или операција демилитаризације, и као таква је генерално засићена максималном количином ТНТ-а који ће се растворити у води (око 150 делова на милион (ппм).) Међутим, има неодређени састав који зависи од тачног процеса; посебно, може такође да садржи циклотриметилентринитрамин (РДКС) ако биљка користи мешавине ТНТ/РДКС или ХМКС ако се користи ТНТ/ХМКС. Црвена вода (такође познат као "Селлите ватер") се производи током процеса који се користи за пречишћавање сировог ТНТ-а. Има сложен састав који садржи више десетина ароматичних једињења, али главне компоненте су неорганске соли (натријум-сулфат, натријум-сулфит, натријум-нитрит и натријум-нитрат) и сулфонирани нитроаромати.
Ружичаста вода је заправо безбојна у време генерисања, док црвена вода може бити безбојна или веома бледо црвена. Боја настаје фотолитичким реакцијама под утицајем сунчеве светлости. Упркос називима, црвена и ружичаста вода нису нужно различите нијансе; боја зависи углавном од трајања сунчеве експозиције. Ако је довољно дуго изложена, "ружичаста" вода ће постати тамно смеђа.
Због токсичности ТНТ-а, испуштање ружичасте воде у животну средину је деценијама забрањено у САД и многим другим земљама, али контаминација тла може постојати у веома старим биљкама. Међутим, контаминација РДКС-ом и тетрилом се обично сматра проблематичнијом, пошто ТНТ има веома ниску покретљивост тла. Црвена вода је знатно токсичнија и као таква се одувек сматрала опасним отпадом. Традиционално се одлаже испаравањем до краја (пошто токсичне компоненте нису испарљиве), након чега следи спаљивање. Много истраживања је спроведено да би се развили бољи процеси одлагања.
Еколошки утицај
[уреди | уреди извор]Због своје погодности за изградњу и рушење, ТНТ је постао најраспрострањенији експлозив и стога је његова токсичност највише окарактерисана и пријављена. Остатак ТНТ-а од производње, складиштења и употребе може да загади воду, земљиште, атмосферу и биосферу.[35]
Концентрација ТНТ-а у контаминираном земљишту може достићи 50 g/kg земљишта, при чему се највеће концентрације могу наћи на површини или близу ње. У септембру 2001. године, Агенција за заштиту животне средине Сједињених Држава (УСЕПА) прогласила је ТНТ загађивачем чије је уклањање приоритет.[36] УСЕПА сматра да нивои ТНТ-а у земљишту не би требало да прелазе 17,2 грама по килограму земље и 0,01 милиграма по литру воде.[37]
Растворљивост у води
[уреди | уреди извор]Растварање је мера брзине којом се чврсти ТНТ у контакту са водом раствара. Релативно ниска растворљивост ТНТ-а у води доводи до тога да се чврсте честице непрекидно испуштају у околину током дужих временских периода.[38] Студије су показале да се ТНТ спорије раствара у сланој води него у слаткој води. Међутим, када се салинитет промени, ТНТ се раствара истом брзином.[39] Пошто је ТНТ умерено растворљив у води, може да мигрира кроз подземно земљиште и да изазове контаминацију подземних вода.[40]
Адсорпција тла
[уреди | уреди извор]Адсорпција је мера дистрибуције између растворљивих и седиментних адсорбованих загађивача након постизања равнотеже. Познато је да се ТНТ и његови продукти трансформације адсорбују на површинско земљиште и седименте, где пролазе кроз реактивну трансформацију или остају ускладиштени.[41] Кретање или органских загађивача кроз земљиште је функција њихове способности да се повезују са мобилном фазом (вода) и стационарном фазом (земљиште). Материјали који се снажно повезују са земљиштем крећу се полако кроз тло. Константа асоцијације за ТНТ са земљом је 2,7 до 11 L/kg земљишта.[42] То значи да ТНТ има тенденцију од једне до десетoроструке да приања на честице тла него када се унесе у тло.[38] Водоничка веза ијонска размена су два предложена механизма адсорпције између нитро функционалних група и колоида земљишта.
Број функционалних група на ТНТ-у утиче на способност адсорбовања у земљиште. Показало се да се вредности коефицијента адсорпције повећавају са повећањем броја амино група. Тако је адсорпција продукта распадања ТНТ-а 2,4-диамино-6-нитротолуена (2,4-ДАНТ) била већа од оне за 4-амино-2,6-динитротолуен (4-АДНТ), која је била већа од оне за ТНТ.[38] Нижи коефицијенти адсорпције за 2,6-ДНТ у поређењу са 2,4-ДНТ могу се приписати стеричној сметњи NO2 групе у орто положају.
Истраживања су показала да у слатководним срединама, са високим садржајем Ca2+, адсорпција ТНТ-а и његових производа трансформације у земљишту и седиментима може бити нижа него што је примећено у сланој средини, у којој доминирају K+ и Na+. Стога, када се разматра адсорпција ТНТ-а, врста земљишта или седимента и јонски састав и снага подземне воде су важни фактори.[43]
Одређене су асоцијацијске константе за ТНТ и његове продукте разградње са глинама. Минерали глине имају значајан утицај на адсорпцију енергетских једињења. Својства земљишта, као што су садржај органског угљеника и капацитет измене катјона, имају значајан утицај на коефицијенте адсорпције.
Додатне студије су показале да је мобилност производа разградње ТНТ-а вероватно нижа „од ТНТ-а у подземним срединама где специфична адсорпција на минерале глине доминира процесом сорпције“.[43] Дакле, покретљивост ТНТ-а и његових производа трансформације зависе од карактеристика сорбента.[43] Мобилност ТНТ-а у подземним водама и земљишту је екстраполирана из „модела изотерме сорпције и десорпције утврђених са хуминским киселинама, у седиментима водоносника и земљишту“.[43] На основу ових модела, предвиђа се да ТНТ има ниску ретенцију и да се лако преноси у околину.[36]
У поређењу са другим експлозивима, ТНТ има већу асоцијацијску константу са земљом, што значи да се више пријања са земљом него са водом. Насупрот томе, други експлозиви, као што су РДКС и ХМКС са ниским асоцијацијским константама (у распону од 0,06 до 7,3 L/kg, односно 0 до 1,6 L/kg) могу се брже кретати у води.[38]
Хемијски распад
[уреди | уреди извор]ТНТ је реактиван молекул и посебно је склон да реагује са смањеним компонентама седимената или фотодеградацији у присуству сунчеве светлости. ТНТ је термодинамички и кинетички способан да реагује са великим бројем компоненти многих еколошких система. Ово укључује потпуно абиотичке реактанте, као што су водоник-сулфид, Fe2+, или микробне заједнице, и оксидне и аноксичне и фотохемијске деградације.
Показало се да тла са високим садржајем глине или мале величине честица и високим садржајем укупног органског угљеника подстичу трансформацију ТНТ-а. Могуће трансформације ТНТ-а укључују редукцију једног, два или три нитро-остатка у амине и купловање производа амино трансформације да би се формирали димери. Формирање два продукта моноамино трансформације, 2-АДНТ и 4-АДНТ, је енергетски фаворизовано, па се стога примећује у контаминираном земљишту и подземним водама. Диамино производи су енергетски мање повољни, а још мање вероватни су триамино производи.
Трансформација ТНТ-а је значајно појачана у анаеробним условима, као иу високо редукционим условима. Трансформације ТНТ-а у земљишту могу се десити и биолошки и абиотички.[43]
Фотолиза је главни процес који утиче на трансформацију енергетских једињења. Промена молекула у фотолизи настаје директном апсорпцијом светлосне енергије или преносом енергије из фотосензибилизованог једињења. Фототрансформација ТНТ-а „резултује формирањем нитробензена, бензалдехида, азодикарбоксилних киселина и нитрофенола, као резултат оксидације метил група, редукције нитро група и формирања димера“.[38]
Докази о фотолизи ТНТ-а су виђени због промене боје отпадних вода које садрже ТНТ у розе када су изложене сунчевој светлости. Фотолиза је бржа у речној води него у дестилованој води. На крају крајева, фотолиза утиче на судбину ТНТ-а првенствено у воденој средини, али такође може утицати на судбину ТНТ-а у земљишту када је површина тла изложена сунчевој светлости.[43]
Биоразградња
[уреди | уреди извор]Лигнинолитичка физиолошка фаза и систем манган пероксидазе гљива могу изазвати врло ограничену количину минерализације ТНТ-а у течној култури, али не и у земљишту. Организам способан за ремедијацију великих количина ТНТ-а у земљишту тек треба да буде откривен.[44] И дивље и трансгене биљке могу фиторемедијирати експлозиве из земље и воде.[45]
Види још
[уреди | уреди извор]- Барут
- Динамит
- Еколошка судбина ТНТ-а
- ИМКС-101
- Списак експлозива коришћених током Другог светског рата
- Флегматизован експлозив
- RE faкtor
- Табела брзина детонације експлозива
- ТНТ еквивалент
- Вебстеров тест
Извори
[уреди | уреди извор]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Urbanski, Tadeusz (1964). Chemistry and Technology of Explosives. 1. Pergamon Press. стр. 389—91. ISBN 978-0-08-010238-2.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ Royal Society of Chemistry: Chemistry in its element: compounds - TNT Архивирано на сајту Wayback Machine (29. август 2014), приступ 10.7.2013 (језик: енглески)
- ^ Wilbrand, J. (1863). „Notiz über Trinitrotoluol”. Annalen der Chemie und Pharmacie. 128 (2): 178—179. doi:10.1002/jlac.18631280206.
- ^ Peter O. K. Krehl (2008). History of Shock Waves, Explosions and Impact: A Chronological and Biographical Reference. Springer Science & Business Media. стр. 404. ISBN 978-3-540-30421-0.
- ^ а б Brown GI (1998). The Big Bang: a History of Explosives
 . Sutton Publishing. стр. 151–153. ISBN 978-0-7509-1878-7.
. Sutton Publishing. стр. 151–153. ISBN 978-0-7509-1878-7.
- ^ Norman Skentelbery (1975). Arrows to Atom Bombs: A History of the Ordnance Board (2nd изд.). Ordnance Board. стр. 99.
- ^ Fairfield AP (1921). Naval Ordnance. Lord Baltimore Press. стр. 49—52.
- ^ Urbanski T (1964). Chemistry and Technology of Explosives. 1. Pergamon Press. стр. 389—91. ISBN 978-0-08-010238-2.
- ^ Miller, J. S.; Johansen, R. T. (1976). „Fracturing Oil Shale with Explosives for In Situ Recovery.” (PDF). Shale Oil, Tar Sand and Related Fuel Sources: 151. Bibcode:1976sots.rept...98M. Архивирано из оригинала (PDF) 2. 10. 2018. г. Приступљено 27. 3. 2015.
- ^ „TNT”. www.ch.ic.ac.uk. Приступљено 2022-02-28.
- ^ Campbell J (1985). Naval weapons of World War Two. London: Conway Maritime Press. стр. 100. ISBN 978-0-85177-329-2.
- ^ U.S. Explosive Ordnance, Bureau of Ordnance. Washington, D.C.: U.S. Department of the Navy. 1947. стр. 580.
- ^ Military Specification MIL-C-401
- ^ Cooper PW (1996). Explosives Engineering. Wiley-VCH. ISBN 978-0-471-18636-6.
- ^ [secondary source] webpages:submarine torpedo explosive Архивирано 2013-01-02 на сајту Archive.today Retrieved 2011-12-02
- ^ scribd.com website showing copy of a North American Intelligence document see:page 167 Архивирано 2013-05-10 на сајту Wayback Machine Retrieved 2011-12-02
- ^ а б Шаблон:Cytuj
- ^ Temperatura, w której po 5 s następuje detonacja[21].
- ^ Furman, David; Kosloff, Ronnie; Dubnikova, Faina; Zybin, Sergey V.; Goddard, William A.; Rom, Naomi; Hirshberg, Barak; Zeiri, Yehuda (6. 3. 2014). „Decomposition of Condensed Phase Energetic Materials: Interplay between Uni- and Bimolecular Mechanisms”. Journal of the American Chemical Society. American Chemical Society (ACS). 136 (11): 4192—4200. ISSN 0002-7863. PMID 24495109. doi:10.1021/ja410020f.
- ^ Merck Index, 13th Edition, 9801
- ^ „NIST Guide to SI Units - Appendix B8. Factors for Units”. 3. 2. 2006. Архивирано из оригинала 2006-02-03. г.
- ^ Babrauskas, Vytenis (2003). Ignition Handbook. Issaquah, WA: Fire Science Publishers/Society of Fire Protection Engineers. стр. 453. ISBN 978-0-9728111-3-2.
- ^ Grad, Paul (април 2013). „Quantum clusters serve as ultra-sensitive detectors”. Chemical Engineering.
- ^ „The Canary Girls: The workers the war turned yellow”. BBC News (на језику: енглески). 2017-05-20. Приступљено 2021-02-07.
- ^ Toxicological Profile for 2,4,6-Trinitrotoluene. atsdr.cdc.gov
- ^ „2,4,6-Trinitrotoluene”. www.nlm.nih.gov.
- ^ „2,4,6-Trinitrotoluene” (PDF). Agency for Toxic Substances and Disease Registry. Приступљено 2010-05-17.
- ^ Akhavan J (2004). The Chemistry of Explosives. Royal Society of Chemistry. стр. 11—. ISBN 978-0-85404-640-9.
- ^ „Explosive & Propellant Additives”. islandgroup.com. Архивирано из оригинала 2016-03-04. г. Приступљено 2014-06-07.
- ^ Yinon, Jehuda (1990). Toxicity and metabolism of explosives. CRC Press. стр. 176. ISBN 0-8493-5128-6.
- ^ Ascend Waste and Environment (7. 6. 2015). The health and environmental impacts of hazardous wastes: Impact Profiles (PDF). awe.gov.au (Извештај). Приступљено 22. 4. 2022.
- ^ а б Esteve-Núñez A, Caballero A, Ramos JL (2001). „Biological degradation of 2,4,6-trinitrotoluene”. Microbiol. Mol. Biol. Rev. 65 (3): 335—52, table of contents. PMC 99030
 . PMID 11527999. doi:10.1128/MMBR.65.3.335-352.2001.
. PMID 11527999. doi:10.1128/MMBR.65.3.335-352.2001.
- ^ Ayoub K, van Hullebusch ED, Cassir M, Bermond A (2010). „Application of advanced oxidation processes for TNT removal: A review”. J. Hazard. Mater. 178 (1–3): 10—28. PMID 20347218. doi:10.1016/j.jhazmat.2010.02.042.
- ^ а б в г д Pichte J (2012). „Distribution and Fate of Military Explosives and Propellants in Soil: A Review”. Applied and Environmental Soil Science. 2012: 1—33. doi:10.1155/2012/617236
 .
.
- ^ Brannon JM, Price CB, Yost SL, Hayes C, Porter B (2005). „Comparison of environmental fate and transport process descriptors of explosives in saline and freshwater systems”. Mar. Pollut. Bull. 50 (3): 247—51. Bibcode:2005MarPB..50..247B. PMID 15757688. doi:10.1016/j.marpolbul.2004.10.008.
- ^ Halasz A, Groom C, Zhou E, Paquet L, Beaulieu C, Deschamps S, Corriveau A, Thiboutot S, Ampleman G, Dubois C, Hawari J (2002). „Detection of explosives and their degradation products in soil environments”. J Chromatogr A. 963 (1–2): 411—8. PMID 12187997. doi:10.1016/S0021-9673(02)00553-8.
- ^ Douglas TA, Johnson L, Walsh M, Collins C (2009). „A time series investigation of the stability of nitramine and nitroaromatic explosives in surface water samples at ambient temperature”. Chemosphere. 76 (1): 1—8. Bibcode:2009Chmsp..76....1D. PMID 19329139. doi:10.1016/j.chemosphere.2009.02.050.
- ^ Haderlein SB, Weissmahr KW, Schwarzenbach RP (јануар 1996). „Specific Adsorption of Nitroaromatic Explosives and Pesticides to Clay Minerals”. Environmental Science & Technology. 30 (2): 612—622. Bibcode:1996EnST...30..612H. doi:10.1021/es9503701.
- ^ а б в г д ђ Pennington JC, Brannon JM (фебруар 2002). „Environmental fate of explosives”. Thermochimica Acta. 384 (1–2): 163—172. doi:10.1016/S0040-6031(01)00801-2.
- ^ Hawari J, Beaudet S, Halasz A, Thiboutot S, Ampleman G (2000). „Microbial degradation of explosives: biotransformation versus mineralization”. Appl. Microbiol. Biotechnol. 54 (5): 605—18. PMID 11131384. S2CID 22362850. doi:10.1007/s002530000445.
- ^ Panz K, Miksch K (2012). „Phytoremediation of explosives (TNT, RDX, HMX) by wild-type and transgenic plants”. J. Environ. Manage. 113: 85—92. PMID 22996005. doi:10.1016/j.jenvman.2012.08.016.
Литература
[уреди | уреди извор]- Urbanski, Tadeusz (1964). Chemistry and Technology of Explosives. 1. Pergamon Press. стр. 389—91. ISBN 978-0-08-010238-2.
- Richard Escales: Nitrosprengstoffe. Survival Press 1915, Reprint 2003, ISBN 3-8330-0114-3.
- Hans-Jürgen Quadbeck-Seeger u. a.: Chemie Rekorde. Menschen, Märkte, Moleküle. 2. Auflage. Wiley-VCH, Weinheim 1999, ISBN 3-527-29870-3.
- M. E. Walsh, T. F. Jenkins, P. S. Schnitker, J. W. Elwell, M. H. Stutz: Evaluation of SW846 Method 8330 for characterization of sites contaminated with residues of high explosives. CRREL Report 93-5, U.S. Army Cold Regions Research and Engineering Laboratory, Hanover, NH.
Спољашње везе
[уреди | уреди извор]- Dynamite and TNT at The Periodic Table of Videos (University of Nottingham)
- "TNT" on YouTube showing the shockwave and typical black smoke cloud from detonation of 160 kilograms of pure TNT
- CDC – NIOSH Pocket Guide to Chemical Hazards