Хидроксид
| |
| Називи | |
|---|---|
| Системски IUPAC назив
Хидроксид | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| UNII | |
| |
| |
| Својства | |
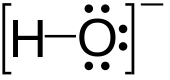
| OH− | |
| Моларна маса | 17,01 g·mol−1 |
| Конјугована киселина | Вода |
| Конјугована база | Оксидни анјон |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Хидроксиди су једињења типа M(OH)x која дисоцијацијом дају хидроксидне јоне.[3] Хидроксиди могу да буду базни или амфотерни.[4] Хидроксид је исто тако диатомски анјон са хемијском формулом OH−. Хидроксид се састоји од атома кисеоника и водоника које држи заједно ковалентна веза, и носи негативан електрични набој. Овај јон је важан, али обично незнатно заступљени састојак воде. Он функционише као база, лиганд, нуклеофил и катализатор. Хидроксидни јон формира соли, од којих неке дисоцирају у воденом раствору, ослобађајући солватиране хидроксидне јоне. Натријум хидроксид је хемијска супстанца која се производи у количинама од више милиона тона годишње. Хидроксид везан за снажно електропозитивни центар може и сам да се јонизује, ослобађајући водонични катјон (H+), чинећи матично једињење киселином.
Кореспондирајуће електрично неутрално једињење HO• је хидроксилни радикал. Кореспондирајућа ковалентно везана група –OH атома је хидроксилна група. Хидроксидни јони и хидрокси група су нуклеофили и могу деловати као катализатори у органској хемији.
Многе неорганске материје које у свом називу носе реч „хидроксид” нису јонска једињења хидроксидног јона, већ ковалентна једињења која садрже хидрокси групе.
Хидроксидни јон
[уреди | уреди извор]Хидроксидни јон је природни део воде, због реакције самојонизације у којој његов комплемент, хидронијум, прима водоник:[5]
- H3O+ + OH− ⇌ 2H2O
Константа равнотеже за ову реакцију, дефинисана као
- Kw = [H+][OH−][note 1] има вредност од 10−14 на 25 °C, тако да је концентрација хидроксидних јона у чистој води близо 10−7 mol∙dm−3, да би се задовољило ограничење једнаког набоја. pH вредност раствора је једнака са децималним кологаритмом концентрације водоничних катјона;[note 2] pH вредност чисте воде је 7 на собној температури. Концентрација хидроксидних јона се може изразити као функција pOH, која је (14 − pH),[note 3] тако да је pOH чисте воде такође једнак 7. Додатак базе у воду редукује концентрацију водоничних јона и стога се повећава концентрација хидроксидних јона (повећава се pH, и смањује pOH) чак и ако сама база не садржи хидроксид. На пример, раствори амонијака имају pH вредност већу од 7 услед реакције NH3 + H+ ⇌ NH+
4, којом се смањује концентрација водоничних катјона, што доводи до повећања концентрације хидроксидних јона. pOH се може одржавати на скоро константној вредности помоћу разних пуферских раствора.

У воденом раствору[7] хидроксидни јон је база у Бренстед–Лауријевом смислу јер може да прими протон[note 4] од Бренстед–Лауријеве киселине и да формира молекул воде. Он исто тако може да делује као Луисова база донирајући електронски пар Луисовој киселини. У воденом раствору су водоникови и хидроксилни јони снажно растворени, са водоничним везама између атома кисеоника и водоника. Бихидроксидни јон H
3O−
2 је окарактерисано у чврстом стању. Ово једињење је центросиметрично и има веома кратку водоничну везу (114,5 pm) која је сличне дужине као у бифлуоридном јону HF−
2 (114 pm).[6] У воденом раствору хидроксидни јон формира снажне водоничне везе са молекулама воде. Последица тога је да концентровани раствор натријум хидроксида има високу вискозност услед стварања проширене мреже водоничних веза као у растворима флуороводоника.
У раствору, изложеном ваздуху, хидроксидни јон брзо реагује са атмосферским угљен-диоксидом, који делује као киселина, те се иницијално формира бикарбонатни јон.
- OH− + CO2 ⇌ HCO−
3
Константа равнотеже за ову реакцију може да буде наведена било као реакција са раствореним угљен диоксидом или као реакција са гасовитим угљен диоксидом (погледајте угљену киселину за вредности и детаље). На неутралној и киселим pH вредностима, реакција је спора, али је катализује ензим карбонатна дехидратаза, који ефективно ствара хидроксидне јоне у свом активном месту.
Раствори који садрже хидроксидне јоне нападају стакло. У овом случају силикати у стаклу делују као киселине. Базни хидроксиди, били чврсти или растворени, чувају се у херметички затвореним пластичним посудама.
Хидроксидни јон може да функционише као типичан лиганд који донира електронски пар, формирајући такве комплексе као што је тетрахидроксоалуминат/тетрахидроксидоалуминат [Al(OH)4]−. Такође се често налази у комплексима мешовитих лиганда типа [MLx(OH)y]z+, где је L лиганд. Хидроксидни јон често служи као премошћавајући лиганд, донирајући један пар електрона сваком од атома који се премошћавају. Као што илуструје јон [Pb2(OH)]3+, метални хидроксиди се често пишу у поједностављеном формату. Хидроксид чак може да делује и као донатор 3 пара електрона, као у тетрамеру [PtMe3(OH)]4.[8]
Када су везани за метални центар са снажним повлачењем електрона, хидроксидни лиганди имају тенденцију да се јонизују у оксидне лиганде. На пример, бихроматни јон [HCrO4]− се дисоцира у складу са
- [O3CrO–H]− ⇌ [CrO4]2− + H+ са pKa од око 5,9.[9]
Вибрациони спектри
[уреди | уреди извор]Инфрацрвени спектри једињења која садрже –OH функционалну групу имају јак апсорпциони опсег у региону центрираном око 3500 cm−1.[10] Висока фреквенција молекулских вибрација последица је мале масе атома водоника у поређењу са масом атома кисеоника, што релативно лако открива хидроксилне групе помоћу инфрацрвене спектроскопије. Трака услед OH групе је обично оштра. Међутим, ширина опсега се повећава када OH група учествује у везивању водоника. Молекул воде има HOH савијајући мод на око 1600 cm−1, тако да се одсуство овог опсега може користи за разликовање ОХ групе од молекула воде.
Када је OH група везана за метални јон у координационом комплексу, може се уочити режим савијања M−OH. На пример, у [Sn(OH)6]2− опсег се јавља на 1065 cm−1. Мод савијања за премошћавајући хидроксид има тенденцију појављивања на нижој фреквенцији, као у [(бипиридин)Cu(OH)2Cu(бипиридин)]2+ (955 cm−1).[11] M−OH вибрације истезања се јављају испод 600 cm−1. На пример, тетраедарски јон [Zn(OH)4]2− има опсеге на 470 cm−1 (Раман-активан, поларизован) и 420 cm−1 (инфрацрвени). Исти јон има (HO)–Zn–(OH) вибрацију савијања на 300 cm−1.[12]
Примене
[уреди | уреди извор]Раствори натријум хидроксида, такође познати као лужина и каустична сода, користе се у производњи пулпе и папира, текстила, питке воде, сапуна и детерџената и као средство за чишћење одвода. Светска производња у 2004. години је била приближно 60 милиона тона.[13] Главни начин производње је хлоралкални поступак.
Раствори који садрже хидроксидни јон настају када се со слабе киселине раствара у води. Натријум карбонат се користи као алкалија, на пример, захваљујући реакцији хидролизе
- CO2−
3 + H2O ⇌ HCO−
3 + OH− (pKa2= 10,33 на 25 °C и нулта јонска јачина)
Иако је базна јачина раствора натријум карбоната нижа од концентрованог раствора натријум хидроксида, његова предност је што је чврста супстанца. Натријум карбонат се такође производи у огромним размерама (42 милиона тона у 2005. години) Солвејевим поступком.[14] Пример употребе натријум карбоната као алкалије је када сода за прање (друго име за натријум карбонат) делује на нерастворљиве естере, попут триглицерида, широко познате као масти, да их хидролизује и учини растворљивим.
Боксит, базни хидроксид алуминијума, главна је руда од које се производи метал.[15] Слично томе, гетит (α-FeO(OH)) и лепидокрокит (γ-FeO(OH)), базни хидроксиди гвожђа, су међу главним рудама које се користе за производњу металног гвожђа.[16] Постоји и низ других употреба.
Преглед хидроксида
[уреди | уреди извор]- Хидроксиди метала 1. групе хемијских елемената: LiOH, NaOH, KOH, RbOH, CsOH. Ови хидроксиди су веома јаке базе који одлично растварају у води. Ова једињења су хемијски веома реактивна. Дисосују на јон метала и анјон OH-
- Хидроксиди метала 2. групе хемијских елемената без берилијума: Mg(OH)2, Ca(OH)2, Sr(OH)2 и Ba(OH)2. Ова једињења су доста јаке базе, али се не растварају баш најбоље у води.
- Амфотерни хидроксиди: Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3. Ови хидроксиди се лоше растварају у води. У киселој средини дисосују на јон метала и на анјоне OH-. У базној средини на анјон XOnn- и на катјоне H+.
Карактер хидроксида зависи од везе. Уколико је јака јонска веза добијају се хидроксиди који у потпуности дисосују на јоне OH-. Уколико је веза више ковалентна хидроксид има амфотерне особине.
Напомене
[уреди | уреди извор]- ^ [H+] означава концентрацију водоникових катјона и [OH−] концентрацију хидроксидних јона
- ^ Строго гледано pH је кологаритам активности водоничног катјона
- ^ pOH означава негативну вредност логаритма основе 10 од [OH−], алтернативно логаритам од 1/[OH−]
- ^ У овом контексту, протон је термин који се користи за солватирани водонични катјон
Извори
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. (2001). „Autoionization in liquid water” (PDF). Science. 291 (5511): 2121—2124. Bibcode:2001Sci...291.2121G. CiteSeerX 10.1.1.6.4964
 . PMID 11251111. doi:10.1126/science.1056991. Архивирано из оригинала (PDF) 25. 06. 2007. г. Приступљено 26. 10. 2019.
. PMID 11251111. doi:10.1126/science.1056991. Архивирано из оригинала (PDF) 25. 06. 2007. г. Приступљено 26. 10. 2019.
- ^ а б Kamal Abu-Dari; Kenneth N. Raymond; Derek P. Freyberg (1979). „The bihydroxide (H
3O−
2) anion. A very short, symmetric hydrogen bond”. J. Am. Chem. Soc. 101 (13): 3688—3689. doi:10.1021/ja00507a059. - ^ Marx, D.; Chandra, A; Tuckerman, M.E. (2010). „Aqueous Basic Solutions: Hydroxide Solvation, Structural Diffusion, and Comparison to the Hydrated Proton”. Chem. Rev. 110 (4): 2174—2216. PMID 20170203. doi:10.1021/cr900233f.
- ^ Greenwood, стр. 1168
- ^ IUPAC SC-Database Архивирано на сајту Wayback Machine (19. јун 2017) A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ Nakamoto, K. (1997). Infrared and Raman spectra of Inorganic and Coordination compounds. Part A (5th изд.). Wiley. ISBN 978-0-471-16394-7.
- ^ Nakamoto, Part B, p. 57
- ^ Adams, D.M. (1967). Metal–Ligand and Related Vibrations. London: Edward Arnold. Chapter 5.
- ^ Cetin Kurt (2005). „Sodium Hydroxide”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_345.pub2.
- ^ Kostick, Dennis (2006). "Soda Ash", chapter in 2005 Minerals Yearbook, United States Geological Survey.
- ^ Emsley, John (2001). „Aluminium”. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, UK: Oxford University Press. стр. 24. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2001). „Aluminium”. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, UK: Oxford University Press. стр. 209. ISBN 978-0-19-850340-8.
Литература
[уреди | уреди извор]- Holleman, A.F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic press. ISBN 978-0-12-352651-9.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Shriver, D.F; Atkins, P.W (1999). Inorganic Chemistry (3rd изд.). Oxford: Oxford University Press. ISBN 978-0-19-850330-9.
- Wells, A.F (1962). Structural Inorganic Chemistry (3rd. изд.). Oxford: Clarendon Press. ISBN 978-0-19-855125-6.
