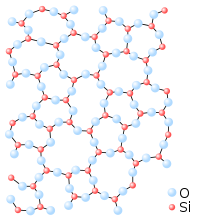
Чврсто агрегатно стање


Чврсто агрегатно стање представља једно од четири агрегатна стања материје, а препознатљиво је по својствима опирања променама облика и запремине.[1][2] Највиши облик организације супстанце заступљен је у чврстом агрегатном стању. Многе супстанце у природи се налазе управо у оваквом облику организације. Уређеност структурних јединица (атоми, молекуле, иони) у чврстој супстанци је знатно већа него у течностима. Промјена положаја структурних јединица није могућа и оне мирују, ако се занемаре осцилације ових структурних јединица око равнотежног положаја. Због тога чврсте супстанце имају своју властиту запремину и властити облик. Чврсто агрегатно стање је карактеристично по својој крутости и отпорности на промене облика и запремине. За разлику од течности, чврсти објекат не може да тече и заузима облик суда, нити се шири да попуни целокупну доступну запремину као што је то случај са гасовима.
Грана физике која се бави проучавањем чврстих супстанци је физика чврстог стања, и она је главна грана физике кондензованог стања (која такође обухвата течности). Чврсте супстанце се проучавају и у склопу науке о материјалима, која се првенствено баве физичким и хемијским својствима чврсте материје. Хемија чврстог стања има посебан нагласак на синтези нових материјала, као и на њиховој идентификацији и хемијској композицији.
Врсте чврстог агрегатног стања
[уреди | уреди извор]Тела у чврстом стању могу бити кристална и аморфна. У кристалним телима атоми су правилно распоређени у простору и само осцилују око равнотежних положаја. У аморфним телима честице исто осцилују око равнотежних положаја, али је њихов просторни распоред неуређен.
- Кристали
Уколико су структурне јединице у чврстој супстанци правилно распоређене у било којем делу или правцу у супстанци, онда су те супстанце кристали.
- Аморфно стање
Уколико је размештај структурних јединица промењив и различит у различитим деловима супстанце, онда су то аморфне супстанце. Аморфно стање је слично течном агрегатном стању и изгледа као нагла залеђеност структурних јединица у течном стању и сва неуређеност, карактеристична за течности, остала је фиксирана. Због тога се аморфно стање може и зове потхлађена течност. Подизањем температуре, неуређеност се постепено повећава, приближава течном стању и то се манифестује као омекшавање. Због тога аморфне супстанце немају фиксну температуру топљења, него температурни интервал омекшавања. Стакло је најуобичајенији облик аморфног стања.
Микроскопски опис
[уреди | уреди извор]
Атоми, молекули или јони који сачињавају чврсту материју могу да буду организовани на уређен понављајући начин, или ирегуларно. Материјали чији конституенти су аранжирани у регуларне патерне су познати као кристали. У неким случајевима, регуларно уређење може да буде константно на великој скали, на пример дијаманти, при чему је сваки дијамант један кристал. Чврсти објекти који су довољно велики да се могу видети и обрађивати су ретко састављени од једног кристала, већ се уместо тога састоје од бројних мањих кристала, познатих као кристалити. Њихова величина може да варира од неколико нанометара до неколико метара. Такви материјали се називају поликристалним. Скоро сви обични метали, и многе керамике, су поликристални.
У другим материјалима, не постоји далекосежна уређеност позиција атома. Такве чврсте материје су познате као аморфне чврсте материје; примери су полистирен и стакло.
Да ли је чврста материја кристална или аморфна зависи од датог материјала, и услова под којима је формирана. Чврсте материје које су формиране спорим хлађењем су углавном кристалне, док чврсте материје које су брзо очврснуте имају велику вероватноћу попримања аморфне форме. Слично томе, избор специфичне кристалне структуре формиране у кристалној чврстој материји зависи од датог материјала и начина на који је чврсто стање формирано.
Док многи објекти у широкој употреби, као што су коцке леда и метални новац, имају идентичну хемијску структуру, многи други материјали се састоје од знатног броја различитих супстанци упакованих заједно. На пример, типична стена је агрегат неколико различитих минерала и минералоида, без специфичне хемијске композиције. Дрво је природни органски материјал који се првенствено састоји од целулозних влакана уграђених у матрицу органског лигнина. У науци о материјалима, композити са више од једног конституентног материјала могу да буду дизајнирани тако да имају жељена својства.
Класе чврсте материје
[уреди | уреди извор]Силе између атома у чврстој материји могу да имају више форми. На пример, кристал натријум хлорида (обичне соли) се састоји од јонског натријума и хлора, који су везани јонским везама. У дијаманту или силицијуму, атоми деле електроне и формирају ковалентне везе. У металима, електрони се деле путем металних веза. Неке чврсте материје, а посебно органска једињења, су везана ван дер Валсовим силама које произилазе из поларизације облака електронских наелектрисања молекула. Разлике међу типовима чврстих материјала произилазе из разлика у њиховом везивању.
Метали
[уреди | уреди извор]
Метали су типично јаки, густи, и добро проводе електрицитет и топлоту. Већина елемената у периодном систему, од оних лево од дијагонале повучене од бора до полонијума, су метали. Смеше два или више елемената у којим је главна компонента метал су познате као легуре.
Људи су користили метале у многе сврхе од прехисторијских времена. Јачина и поузданост метала су довели до њихове широке распрострањене улоге у грађевинарству зграда и других структура, као и у већини возила, многим уређајима и алатима, цевима, путним знацима и железничким шинама. Гвожђе и алуминијум су два најчешће коришћена структурна метала, и они су исто тако најзаступљенији метали у Земљиној кори. Гвожђе је у широкој употреби у облику легура, челика, који садржи до 2,1% угљеника, што га чини тврђим од чистог гвожђа.
Пошто су метали добри проводници електрицитета, они су корисни у електричним уређајима и за пренос електричне струје преко великих растојања са малим губитком енергије или дисипацијом. Стога су електричне мреже зависне од метални каблова за дистрибуцију електрицитета. Кућни електрични системи, на пример, садрже бакар због његових добрих проводних својстава и лаке обрадивости. Висока термална проводност већине метала их исто тако чини корисним за израду кухињског посуђа.
Изучавање металлних елемената и њихових легура сачињава знатну порцију поља хемије чврстог стања, физике, науке о материјалима и инжењерства.
Металне чврсте материје су везане делокализованим електронима високе густине, што је познато као „метално везивање“. У металу, атоми брзо губе своје спољашње (валентне) електроне, формирајући позитивне јоне. Слободни електрони су раширени у целокупном чврстом материјалу, који се одржава дејством електростатичких интеракција између јона и електронских облака.[3] Велики број слободних електрона даје металима њихове високе вредности електричне и термалне проводности. Слободни електрони такође спречавају трансмисију видљиве светлости, те су метали непрозирни и сјајни.
Напреднији модели металних својстава разматрају ефекат позитивних јонских језгара на делокализацију електрона. Већина метала има кристалне структуре, чији јони су обично аранжирани у облику периодичне решетке. Математички, потенцијал јонских језгара се може третирати разним моделима, најједноставнији од којих је модел скоро слободних електрона.
Минерали
[уреди | уреди извор]
Минерали су природне чврсте материје које су формиране путем разних геолошких процеса под високим притиском. Да би била класификована као минерал, супстанца мора да има кристалну структуру са униформним физичким својствима. У погледу састава минерали се налазе у опсегу од чистих елемената и једноставних соли до веома комплексних силиката са хиљадама познатих форми. У контрасту с тим, узорци стена су рандомни агрегати минерала и/или минералоида, и немају специфични хемијски састав. Велика већина стена Земљине коре се састоји од кварца (кристалног SiO2), фелдспата, лискуна, хлорита, каолинита, калцита, епидота, оливина, аугита, роговаче, магнетита, хематита, лимонита и неколико других минерала. Неки минерали, као што су кварц, лискун или фелдспат су распрострањени, док се други налазе само на неколико локација у свету. Далеко највећа група минерала су силикати (већина стена су ≥95% силикати), који се углавном састоје од силицијума и кисеоника, са додатком јона алуминијума, магнезијума, гвожђа, калцијума и других метала.
Керамика
[уреди | уреди извор]
Керамика се састоји од неорганских једињења, обично оксида хемијских елемената. Они су хемијски инертни, и често су отпорни на хемијску ерозију до које долази у киселој или каустичној средини. Керамике генерално могу да поднесу високе температуре у опсегу од 1.000—1.600 °C (1.830—2.910 °F). Изузеци су неоксидни неоргански материјали, као што су нитриди, бориди и карбиди.
Традиционалне сировине за израду керамике обухватају глинене минерале као што је каолинит, док се однедавно користи и алуминијум оксид (алумина). Модерни керамички матерајали, који се класификују као напредне керамике, садрже силицијум карбид и волфрам карбид. Ови материјали поседују знатну абразивну отпорност, и стога налазе примену у хабајућим плочама рударске опреме за млевење материјала.
Већина керамичких материјала, као што су алумина и сродна једињења, су формирани из финих прахова, из којих настају поликристалне микроструктуре фине гранулације, који су богати центрима расипања светлости чија величина је упоредива са таласном дужином видљиве светлости. Стога су они генерално непрозирни материјали, за разлику од транспарентних материјала. Недавно развијена наноскална технологија (нпр. сол-гел), међутим, омогућила је продукцију поликристалне транспарентне керамике, као што је транспарентна алумина и једињења алумине, за такве примене као што су ласери високе снаге. Напредне керамике се такође користе у медицини, електричним и електронским индустријама.
Керамичко инжењерство је наука и технологија прављења чврстих керамичких материјала, делова и уређаја. То се ради било дејством топлоте, или на нижим температурама, користећи реакције преципитације из хемијских раствора. Термин обухвата пречишћавање сировина, изучавање и продукцију хемијских једињења, њиховог формирања у компоненте, и изучавање њихове структуре, састава и својстава.
С механистичког гледишта, керамички материјали су крти, тврди, отпорни на компресију и слаби при смицању и напрезању. Крти материјали могу да испоље знатну затезну чврстоћу при подржавању статичког терета. Жилавост показује колико енергије материјал може да апсорбује пре механичког неуспеха, док жилавост лома (означена са KIc) описује способност материјала са наследним микроструктурним дефектима да се одупре лому у облику раста и пропагације расцепа. Ако материјал има велику вредност жилавости лома, базни принципи механике лома сугеришу да ће он вероватно доживети прелом при истезању. Крти прелом је карактеристичан за већину керамичких и стаклено-керамичких материјала који типично испољавају ниске (и инконзистентне) вредности KIc.
Пример употребе керамике екстремне тврдоће од Зирконијума је примена у производњи оштрица ножева, као и других индустријских алата за сечење. Керамике као што су алумина, бор карбид и силицијум карбид су коришћене у панцирним прслуцима за одбијање метака из пушки великог калибра. Силицијум нитридни делови се користе у керамичким лежајевима, где их њихова тврдоћа чини отпорним на хабање. Керамика је исто тако хемијски отпорна и може се користити у влажним окружењима, где би челични лежајеви били подложни оксидацији (или рђању).
Још један пример примене керамике је адијабатски керамички мотор са оперативном температуром од преко 3.300 °C (5.970 °F) који је развила Тојота током раних 1980-их. Керамички моторима нису потребни системи за хлађење, што омогућава знатну редукцију тежине и стога ефикаснију употребу горива. У конвенционалним металним моторима, знатан део енергије ослобођене из горива се губи у облику отпадне топлоте да би се спречило топљење металних делова. Такође се ради на развоју керамичких делова за гасно турбинске моторе. Турбинске машине од керамике могу да ефективније раде, што даје авиону вежи опсег лета и носивост за дату количину горива. Међутим, такве машине нису у производњи зато што је производња керамичких делова са довољном прецизношћу и трајношћу тешка и скупа. Методе обраде често производе широку дистрибуцију микроскопских мана које фреквентно имају детрименталну улогу у процесу синтерирања, што доводи до пролиферације пукотина, и ултимативно механичког квара.
Стаклена керамика
[уреди | уреди извор]
Стаклено-керамички материјали имају мноштво заједничких својстава са некристалним стаклима и кристалним керамикама. Они се формирају као стакло, и затим се парцијално кристализују топлотним третманом, производећи аморфне и кристалне фазе тако да су кристална зрна уграђена у некристалну интергрануларну фазу.
Стаклено-керамика се користи за прављење посуђа за кување (оригинално познатог под именом CorningWare) и плоча шпорета, који имају високу отпорност на термални шок и екстремно ниску пермеабилност за течности. Негативни коефицијенат термичке експанзије кристалне керамичке фазе може да буде балансиран позитивним коефицијентом стаклене фазе. На одређеној тачки (~70% кристалној) течна-керамика има нето коефицијенат термичке експанзије близак нули. Тај тип стаклене-керамике манифестује изузетна механичка својства и може да издржи поновљене и брзе температурне промене до 1000 °C.
Стаклена-керамика се може исто тако природно формирати кад гром удари у кристална (нпр. кварцна) зрна присутна на већини пешчаних плажа. У том случају, екстремна и брза топлота грома (~2500 °C) креира шупљу, разгранату попут корена, структуру која се назива фулгурит путем топљења.
Органске чврсте материје
[уреди | уреди извор]
Органска хемија изучава структуре, својства, састав, реакције, и синтетичку припрему хемијских једињења угљеника и водоника, која могу да садрже низ других елемената, као што су азот, кисеоник и халогени: флуор, хлор, бром и јод. Нека органска једињења такође могу да садрже елементе фосфор или сумпор. Примери органских чврстих материјала обухватају дрво, парафински восак, нафтален и широки опсег полимера и пластика.
Дрво
[уреди | уреди извор]Дрво је природни органски материјал који се првенствено састоји од целулозних влакана уграђених у лигнинску матрицу. У погледу механичких својстава, влакна су јака при напрезању, а лигнинска основа је отпорна на компресију. Стога је дрво било један од важних грађевинских материјала још од почетка људске изградње склоништа и коришћења бродова. Дрво које се користи за грађевински рад је познато као дрвена грађа. У грађевинарству, дрво није само структурни материјал, него се користи и за формирање шалунга за бетон.
На дрвету базирани материјали се такође екстензивно користе за паковање (нпр. картон) и папир, који се праве од рафиниране пулпе. Хемијски пулпни процеси користе комбинацију високе температуре и алкалних (крафт) или киселих (сулфит) хемикалија за разлагање хемијских веза лигнина.
Полимери
[уреди | уреди извор]
Једно важно својство угљеника у органској хемији је да може да формира извесна једињења, чији појединачни молекули имају способност везивања један за други, чиме се формирају ланци или мреже. Процес се назива полимеризацијом, а ланци или мреже полимерима, док су изворна једињења мономери. Постоје две главне групе полимера: они који су вештачки направљени се називају индустријским полимерима или синтетичким полимерима (пластикама) и они који се јављају у природи као биополимери.
Мономери могу да имају разне хемијске субституенте, или функционалне групе, што може да утиче на хемијска својства органских једињења, као што су растворљивост и хемијска реактивност, као и на физичка својства, као што су тврдоћа, густина, механичка или затезна јачина, отпорност на хабање, топлотна отпорност, транспаренција, боја, etc. У протеинима, те разлике дају полимеру способност да поприми биолошки активну конформацију.

Људи су користили природне органске полимере вековима у облику воскова и шелака, који се класификују као термопластични полимери. Биљни полимер под именом целулоза пружа затезну чврстоћу природним влакнима и канапима, а до раног 19. века природне гуме су ушле у широку употребу. Полимери су сировине (резини) које се користе за прављење пластике. Пластика је финални производ, креиран након што се један или више полимера или адитива дода резину током пресовања, и смеша се обликује у финалну форму. Полимери који су доступни и у широкој употреби обухватају на угљенику базиране: полиетилен, полипропилен, поливинил хлорид, полистирен, најлоне, полиестер, акрилне резине, полиуретан, и поликарбонате, и на силицијуму базиране силиконе. Пластике се генерално класификују као роба, специјализовани производи и инжењерске пластике.
Композитни материјали
[уреди | уреди извор]

Композитни материјали садрже две или више макроскопске фазе, једна од који је обично керамичка. На пример, континуирана матрица, и диспергована фаза керамичких честица или влакана.
Примене композитних материјала су у опсегу од структурних елемената као што је челиком ојачани бетон, до термичких изолационих плочица које играју кључну улогу у термалној заштити Спејс шатла. Један пример је ојачани угљеник-угљеник (енгл. Reinforced Carbon-Carbon - RCC), лагани сиви материјал који може да поднесе температуре повратка у атмосферу до 1.510 °C (2.750 °F) и да заштити нос и водеће ивице крила летилице. РЦЦ је ламинирани композитни материјал израђен од графитне рејонске тканине и импрегниран са фенолним резином. Након стврдњавања на високим температурама у аутоклаву, долази до пиролизе ламината и прелаза из резина у угљеник, импрегниран са фурфуралним алкохолом у вакуумској комори. Стврдњавање/пиролиза конвертује фурфурал алкохол у угљеник. Да би се пружила оксидациона отпорност ради вишеструке употребе, спољашњи слојеви РЦЦ-а се конвертују у силицијум-карбид.
Пример композитног материјала из домаћинства се може видети у „пластичним“ кућиштима телевизијских апарата, целуларних телефона итд. Та пластична кућишта се обично састоје од композита направљеног од термопластичне матрице са акрилонитрил бутадиен стиреном (АБС) при чему су калцијум карбонатна креда, талк, стаклена влакна или угљена влакна додата ради ојачања, масе, или електро-статичке дисперзије. Ти додаци се могу називати ојачавајућим влакнима, или дисперзантима, у зависности од сврхе.
Стога, материјал матрице окружује и појачава материјал ојачања одржавајући њихове релативне позиције. Ојачања утичу на механичка и физичка својства матрице. Синергизам производи особине материјала које индивидуални конституенти немају, док велики број различитих матрица и ојачавајућих материјала пружа извор дизајнеру да оствари оптималну комбинацију.
Полупроводници
[уреди | уреди извор]
Полупроводници су материјали чија електрична отпорности (и проводност) је између металних проводника и неметалних изолатора. Они се налазе у периодној табели идући дијагонално надоле и десно полазећи од бора. Они раздвајају електричне проводнике (или метале, на левој страни) и изолаторе (на десној страни).
Уређаји направљени од полупроводних материјала су у основи модерне електронике, укључујући радио, рачунаре, телефоне, итд. Полупроводнички уређаји обухватају транзисторе, соларне ћелије, диоде и интегрална кола. Соларни фотоволтни панели су велики полупроводнички уређаји који директно конвертују светло у електричну енергију.
У металним проводницима, струја се преноси протоком електрона, док се у полупроводницима струја преноси било електронима или позитивно наелектрисаним „рупама“ у електронској структури материјала. Полупроводнички материјали у широкој употреби су силицијум, германијум и галијум арсенид.
Наноматеријали
[уреди | уреди извор]
Многе традиционалне чврсте материје испољавају различита својства кад се доведу до нанометарске величине. На пример, наночестице обично жутог злата и сивог силицијума имају црвену боју; наночестице злата се топе на знатно нижим температурама (~300 °C при величини од 2,5 nm) од златних плоче (1064 °C);[4] и металне наножице су знатно јаче од кореспондирајуће веће масе метала.[5][6] Велика површина наночестица их чини екстремно привлачним за поједине примене у пољу енергетике. На пример, платина може да служи као катализатор за аутомобилско гориво, као и мембрана протонске размене (PEM) горивих ћелија. Керамички оксиди (или кермети) лантана, церијума, мангана и никла се изучавају за могућу примену у чврстим оксидним горивим ћелијама (SOFC). Литијум, литијум–титанатне и танталне наночестице се користе у литијумским јонским батеријама. Силицијумске наночестице могу да драматично повећају складишни капацитет литијумских јонских батерија током циклуса експанзије/контракције. Силицијумске наночестице функционишу без знатне деградације и потенцијално могу да нађу примену у у батеријама са знатно повећаним капацитетом. Силицијумске наночестице се такође користе у новим формама ћелија за добијање соларне енергије. Депозиција танких филмова силицијумских квантних тачки на поликристалне силицијумске супстрате фотоволтних (соларних) ћелија повећава напонски излаз за 60% путем флуоресценције улазног светла пре трансформације у електричну енергију. Овде исто тако, површина наночестица (и танких филмова) игра критичну улогу у максимизацији количине апсорбоване радијације.
Физичка својства
[уреди | уреди извор]Физичка својства елемената и једињења која пружају убедљиву евиденцију о хемијском саставу обухватају мирис, боју, запремину, густину (масу по јединици запремине), тачку топљења, тачку кључања, топлотни капацитет, физичку форму и облик на собној температури (чврста материја, течност или гас; кубни, тригонални кристали, итд.), тврдоћу, порозност, индекс рефракције и многа друга. Ова секција дискутује нека од физичких својстава материјала у чврстом стању.
Механичка својства
[уреди | уреди извор]Механичка својства материјала описују карактеристике као што је јачина или отпорност на деформацију. На пример, челични стубови се користе у грађевини због њихове велике јачине, што значи да се они не ломе нити се знатно савијају под теретом.
Механичка својства обухватају: еластичност и пластичност, затезну чврстоћу, компресивну јачину, отпорност на смицање, отпорност на ломљење, дуктилност (која је ниска код ломљивих материјала), и тврдоћу засецања. Механика чврстог стања је изучавање понашања чврстог материјала под спољашњим утицајима као што су спољашње силе и промене температуре.
Чврсти материјали не манифестују макроскопски проток, за разлику од флуида. Свако одступање од њиховог оригиналног облика се назива деформацијом. Пропорција деформација и оригиналне величине се назива напрезањем. Ако је примењени стрес довољно низак, скоро сви чврсти материјали се понашају на такав начин да је напрезање директно пропорционално стресу (Хуков закон). Коефицијент пропорције се назива модул еластичности или Јангов модул. Регион деформације је познат као линеарно еластични регион. Три модела могу да опишу начин на који чврсти материјали одговарају на примењени стрес:
- Еластичност – Кад се примењени стрес уклони, материјал се враћа у своје недеформисано стања.
- Вискоеластичност – Ови материјали се понашају еластично, али такође имају пригушивање. Кад се примењени стрес уклони, неопходно је уложити рад против ефекта пригушивања и долази до конвертовања рада у топлоту у материјалу. То доводи до хистерезисне петље у криви стреса–напрезања. Из овог следи да је механички рад временски зависан.
- Пластичност – Материјали који су еластични генерално задржавају то својство док је примењени стрес мањи од вредности попуштања. Кад стрес премаши вредност попуштања, материјал се понаша пластично и не враћа се у претходно стање. Долази до иреверзибилне пластичне деформације (или вискозног протока) након попуштања, што је перманентно.
Термална својства
[уреди | уреди извор]
Пошто чврсте материје имају термалну енергију, њихови атоми вибрирају око фиксних средњих позиција унутар уређене (или неуређене) решетке. Спектар вибрација решетке у кристалним и стакластим мрежама је у основи кинетичке теорије чврстог стања. То кретање се јавља на атомском нивоу, и стога се не може опазити или детектовати без високоспецијализоване опреме, као што је спектроскопска опрема.
Термална својства чврсте материје обухватају термалну проводност, која је својство материјала да проводи топлоту. Чврсте материје такође имају специфични топлотни капацитет, који је способност материјала да прима и задржава енергију у облику топлоте (или термалних вибрација решетке).
Електрична својства
[уреди | уреди извор]Електрична својства обухватају проводност, отпорност, импедансу и капацитанцу. Електрични проводници као што су метали и легуре стоје у контрасту са електричним изолаторима као што су стакла и керамике. Полупроводници су негде у средини. Док је проводност у металима узрокована електронима, електрони и позитивне шупљине доприносе струју код полупроводника. Алтернативно, јони преносе електричну струју у јонским проводницима.
Многи материјали такође манифестују суперпроводност на ниским температурама; они обухватају металне елементе као што су калај и алуминијум, разне металне легуре, неке јако допиране полупроводнике, и поједине керамике. Електрична отпорност већине електричних (металних) проводника генерално постепено опада са снижењем температуре, мада остаје коначна. И суперпроводницима међутим, отпорност нагло пада на нулу кад се материјал охлади испод своје критичне температуре. Електрична струја у суперпроводничкој петљи се може бесконачно одржати без извора енергије.
Диелектрик, или електрични изолатор, је супстанца која је високо отпорна на проток електричне струје. Диелектрик, као што је пластика, има тенденцију концентровања примењеног електричног поља унутар себе, што је својство које налази примену у кондензаторима. Кондензатор је електрични уређај који може да ускладишти енергију у електричном пољу између пара проводника на малом растојању ('плоча'). Када се примени напон на кондензатор, електрична наелектрисања једнаких магнитуда, али супротних поларности, се формирају у свакој плочи. Кондензатори се користе у електричним колима као уређаји за чување енергије, као и у електронским филтерима за диференцијацију између високофреквентних и нискофреквентних сигнала.
Оптичка својства
[уреди | уреди извор]Материјали могу да трансмитују (e.g. стакло) или рефлектују (нпр. метали) видљиву светлост.
Многи материјали преносе неке таласне дужине док блокирају друге. На пример, прозорско стакло је транспарентно за видљиву светлост, а у знатно мањој мери није пропустно за већину фреквенција ултраљубичасте светлости, која узрокује опекотине од сунца. То својство се користи за фреквентно-селективне оптичке филтере, који могу да мењају боју упадног светла.
За неке сврхе, оптичка и механичка својства материјала могу да буду од интереса. На пример, сензори у ракетама са инфрацрвеним навођењем (тражењем топлоте) морају да буду заштићени покривачем који је транспарентан за инфрацрвену радијацију. Садашњи материјал избора за ракете велике брзине вођене инфрацрвеном радијацијом је једнокристални сафир. Оптички пренос сафира не покрива целокупни средњи инфрацрвени опсег (3–5 µm), али почиње да опада на таласним дужинама већим од приближно 4,5 µm на собној температури. Док је јачина сафира боља од других доступних материјала за средишњи инфрацрвени опсег на собној температури, он слаби изнад 600 °C. Постоји дугорочни компромис између оптичке пропустности и механичке издржљивости. Очекује се да ће нови материјали као што је транспарентна керамика или оптички нанокомпозити имати побољшану перформансу.
Навођеним преносом светлосних таласа се бави поље оптичких влакана. Ова технологија се заснива на способности појединих типова стакла да симултано преносе са малим губитком интензитета опсег фреквенција (мултимодни оптички таласни водичи) са незнатном интерференцијом између њих. Оптички таласни водичи се користе као компоненте у интегралним оптичким колима или као трансмисиони медијум у оптичким комуникационим системима.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Peter Atkins; Julio de Paula (2001). Physical Chemistry (7th изд.). W. H. Freeman. ISBN 0716735393.
- ^ Donald A. McQuarrie; John D. Simon (1997). Physical Chemistry: A Molecular Approach (1st изд.). University Science Books. ISBN 0935702997.
- ^ Mortimer, Charles E. (1975). Chemistry: A Conceptual Approach (3rd изд.). New York:: D. Van Nostrad Company. ISBN 978-0-442-25545-9.
- ^ Buffat, Ph.; Borel, J.-P. (1976). „Size effect on the melting temperature of gold particles”. Physical Review A. 13 (6): 2287. Bibcode:1976PhRvA..13.2287B. doi:10.1103/PhysRevA.13.2287.
- ^ Kohl, Walter H. (1995). Handbook of materials and techniques for vacuum devices. Springer. стр. 164—167. ISBN 978-1-56396-387-2.
- ^ Shpak, Anatoly P; Kotrechko, Sergiy O; Mazilova, Tatjana I; Mikhailovskij, Igor M (2009). „Inherent tensile strength of molybdenum nanocrystals”. Science and Technology of Advanced Materials. 10 (4): 045004. Bibcode:2009STAdM..10d5004S. doi:10.1088/1468-6996/10/4/045004.
Литература
[уреди | уреди извор]- Kohl, Walter H. (1995). Handbook of materials and techniques for vacuum devices. Springer. стр. 164—167. ISBN 978-1-56396-387-2.
- Mortimer, Charles E. (1975). Chemistry: A Conceptual Approach (3rd изд.). New York:: D. Van Nostrad Company. ISBN 978-0-442-25545-9.