Питка вода

Питка вода, позната и као пијаћа вода или вода за пиће, вода је која је довољно сигурна за пиће или за припрему хране. Глобално, 2012. године, 89% људи је имало приступ води за пиће.[1] Око 4 милијарде има приступ води из чесме, док остале 2,3 милијарде има приступ изворима или јавним чесмама.[1] Око 1,8 милијарди људи још увијек користи несигурну воду која може бити контаминирана изметом.[1] Ово може резултирати упалним обољењима дигестивног тракта као што је колера или тифус.[1] Вода је неопходна за живот. Количина воде потребне за пиће је промјенљива.[2] Зависи од физичке активности, старости, здравствених проблемима, као и услова средине.[3][4] Вода чини око 60% укупне тежине мушкарца и око 50% тежине жене.[5] Новорођенчад имају 70—80% воде, док она старија имају око 45%.[6]
Вода је у природи јако распрострањена, покрива око три четвртине Земљине површине. Укупна запремина воде на Земљиној површини износи 1 360 000 000 km³, и то 98 процената у океанима и морима, 1.96 процената у ледницима и снегу и 0.04 процената у рекама, језерима, подземној и атмосферској води. Према томе, за човека је ова последња ставка (0.04 процената) најважнија, а њој одговара укупна количина слатке воде на Земљи 544 000 km³. Потпуно чиста вода не налази се у природи; најчистија је атмосферска вода (природно дестилована вода), мада и она садржи, поред честица прашине и следеће састојке: угљен-диоксид, амонијум-нитрат, водоник-пероксид, микроорганизме итд. pH вредност кишнице је око 5,7 (због угљене киселине), али може бити и мања (3,5-5), у зависности од оксида у ваздуху који су растворни у води (на пример SO2).
Пролазећи кроз разне слојеве Земљине коре, вода раствара многе супстанце; зато се у речној, бунарској и изворској води налази око 0.01 – 0.2 чврстих супстанци, највећим делом калцијумових и магнезијумових једињења. Морска вода садржи око 3.6 процената растворених супстанци, од чега на кухињску со отпада највећи део. Природне воде које садрже већу количину калцијумових и магнезијумових једињења, зову се тврде воде, за разлику од меких вода, које садрже малу количину поменутих једињења. Тврде воде су незгодне за употребу, у њима се тешко пере, нису погодне за кување намирница, не смеју да се употребе за парне котлове, јер се на њиховим зидовима ствара каменац, итд. Оне изворске воде које садрже у себи већу количину растворених неких чврстих и гасовитих супстанци, које не садржи обична вода, могу да се употребе за лечење разних обољења. Такве воде зову се минералне воде Према супстанцама које се у њима налазе растворене, деле се на слане (oд NaCl), горке (од магнезијумових соли), киселе (од угљен-оксида), гвожђевите (од растворених соли гвожђа) итд.
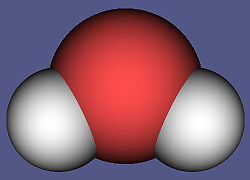
Вода за пиће мора да буде чиста, без бактерија, да има температуру од 12 – 15 °C и да је свежег укуса, који једним делом долази од раствореног угљен-диоксида и кисеоника, а делом од растворених чврстих супстанци. Пошто већа насеља и градови не могу да се обезбеде изворском водом, људи су приморани да употребљавају речну или језерску воду. Да би ова вода била употребљива за пиће, мора да се очисти механички и хемијски. Несумњиво најважнији од свих оксида, а можда и најважнија од свих једињења уопште јесте вода.[7] Молекул воде је угловни молекул са углом 104.5 степени између две OH везе. Због велике разлике у електронегативности између водоника и кисеоника, молекул воде је изразито диполног карактера што је приказано на слици 1. Тиме позитиван крај једног молекула привлачи негативан крај другог, што посредством водоничних веза доводи до асоцијације молекула и у течном и у чврстом агрегатном стању. Физичке особине воде.
Око 1 до 2 милијарде људи нема безбедну воду за пиће.[8] Вода може преносити векторе болести. Више људи умире од небезбедне воде него од рата, изјавио је својевремени У.Н. генерални секретар Бан Ки-мун 2010. године.[9] Земље трећег света су највише погођене недостатком воде, поплавама и квалитетом воде. До 80 процената болести у земљама у развоју је директна последица неадекватне воде и санитарних услова.[10] Према извештају UNICEF-а и Унеска, Финска има најбољи квалитет воде за пиће на свету.[11][12][13][14]
Чиста вода
[уреди | уреди извор]Чиста вода је на обичној температури провидна течност, без мириса и укуса, у танким слојевима безбојна, а у дебљим слојевим је плаве боје. Вода се под нормалним притиском мрзне на 0 , а кључа на 100 °C, претварајући се у пару. Ретко која друга супстанца постоји у сва три агрегатна стања, као вода, на температури уобичајеној за нормални експериментални рад. Потпуно чиста вода готово да не проводи електричну струју, али присуство мале количине угљене киселине или неке соли, омогућава да се повећа њена проводљивост. Вода се, по својим физичким особинама, знатно разликује од особина других супстанци.
Хемијске особине воде
[уреди | уреди извор]Вода спада у врло реактивне супстанце, реагује са најреактивнијим металима (калијум, натријум) на собној температури и гради одговарајуће базе. Са мање активним металима, на вишој температури, издваја се водоник из водоник из водене паре. Са неметалима флуором, хлором и бромом реагује на обичној температури, а на високој температури реагује са угљеником. Са металним оксидима вода гради базе, а са неметалним оксидима киселине.
Загађивање воде
[уреди | уреди извор]Вода је врло загађена разним материјалима које потичу из многобројних извора. Отпадне воде градова, канализације градова, изливају се у воде река, језера и мора. Вештачка ђубрива и разни пестициди, које киша спира са ораница, такође загађују воде; често се вода загађује нафтом и њеним дериватима. У новије време, све се више ради на спречавању изливања отпадних вода у реке, језера и мора, пре него што се изврши њихово пречишћавање помоћу специјалних уређаја.
Хемијски састав природних вода
[уреди | уреди извор]Микроорганизми троше кисеоник, који је растворен у води, разлажу органске супстанце у проста једињења и елементе: CO2, H2O2, N2, N2O, SO2, C, H, O, S, P, Cl, Cu, Mg, K, Na. Осим њих има и елемената који су присутни у траговима. То су тзв. Микроелементи, који су веома важни, јер њихов суфицит и дефицит може имати за последицу појаву многих обољења. Сви микроелементи се могу сврстати у три групе: Битни микроелементи, важни за људски организам: Fe, Mn, Zn, Cu, I Нетоксични елементи, али неважни за људски организам: Al, Si, Sr, Ni Токсични микроелементи, чији трагови су присутни у води немају биолошки значај, али њихово уношење у већим количинама, нема само штетно, већ и токсично дејство: Pb, F, Se, Br, Ag
Максимално дозвољене концентрације
[уреди | уреди извор]У нашој земљи законски су регулисане норме за максимално дозвољене концентрације загађивача у ваздуху. Међутим, још увек не постоје такви стандарди за контролу водене средине, али као критеријуми служе стандарди који се примењују у већини земаља.[15]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ а б в г „Water Fact sheet N°391”. јул 2014. Архивирано из оригинала 5. 6. 2015. г. Приступљено 24. 5. 2015.
- ^ Yamada, Yosuke; Zhang, Xueying; Henderson, Mary E. T.; Sagayama, Hiroyuki; Pontzer, Herman; Speakman, John R. (2022). „Variation in human water turnover associated with environmental and lifestyle factors”. Science (на језику: енглески). 378 (6622): 909—915. Bibcode:2022Sci...378..909I. PMC 9764345
 . PMID 36423296. doi:10.1126/science.abm8668.
. PMID 36423296. doi:10.1126/science.abm8668.
- ^ Grandjean, Ann C. (2004). „3”. Water Requirements, Impinging Factors, and Recommended Intakes (PDF). World Health Organization. стр. 25—34.
- ^ Exposure Factors Handbook: 2011 Edition (PDF). National Center for Environmental Assessment. септембар 2011. Архивирано из оригинала (PDF) 24. 9. 2015. г. Приступљено 24. 5. 2015.
- ^ Miller, Thomas A. (2006). Modern surgical care physiologic foundations and clinical applications (3rd изд.). New York: Informa Healthcare. стр. 34. ISBN 9781420016581.
- ^ Nancy caroline's emergency care in the streets. (07 изд.). [S.l.]: Jones And Bartlett Learning. 2012. стр. 340. ISBN 9781449645861.
- ^ „Архивирана копија”. свет медицине. Архивирано из оригинала 01. 04. 2018. г. Приступљено 31. 3. 2018.
- ^ „Drinking-water”. World Health Organization. март 2018. Приступљено 23. 3. 2018.
- ^ „Unsafe water kills more people than war, Ban says on World Day”. UN News. 22. 3. 2010. Приступљено 10. 5. 2018.
- ^ „Water in developing countries”. GAC. 12. 6. 2017. Приступљено 4. 10. 2021.
- ^ „WWDR1: Water for People – water for life” (PDF). UNESCO and Berghahn Books. 2003. Приступљено 21. 9. 2022.
- ^ „Water Is Enough Reason to Visit Finland, Here's Why”. Culture Trip. 4. 6. 2018. Приступљено 21. 9. 2022.
- ^ „Water in Finland purest in the world”. MEDI Connection. 22. 3. 2019. Приступљено 21. 9. 2022.
- ^ „The quality of water produced by Turku Region Water is rated the best in the world by Unesco”. City of Turku. 1. 12. 2021. Архивирано из оригинала 21. 09. 2022. г. Приступљено 21. 9. 2022.
- ^ „вода за пиће-утицај на здравље”. Архивирано из оригинала 26. 01. 2021. г. Приступљено 31. 03. 2018.
Литература
[уреди | уреди извор]- Др.Иван Филиповић,др.Стјепан Липановић,Опћа и анорганска кемија,
- Opća i anorganska kemija - I. i II. dio Ivan Filipović, Stjepan Lipanović
- Стања и процеси у животној средини,група аутора, факултет за физичку хемију Београд 1955. године
- Енциклопедија заштите на раду, медицине и хигијене рада,Институт заштите на раду "Едвард Кардељ" Ниш
- Др.Момчило Ст.Мокрањац, Токсиколошка хемија, Универзитет у Београду, 1972 године
- Sadoff, Claudia; Grey, David; Borgomeo, Edoardo (2020). „Water Security”. Oxford Research Encyclopedia of Environmental Science. ISBN 978-0-19-938941-4. doi:10.1093/acrefore/9780199389414.013.609.
- Grey, David; Sadoff, Claudia W. (2007-12-01). „Sink or Swim? Water security for growth and development”. Water Policy (на језику: енглески). 9 (6): 545—571. ISSN 1366-7017. doi:10.2166/wp.2007.021. hdl:11059/14247.
- Global water security : lessons learnt and long-term implications. Singapore: World Water Council. 2018. ISBN 978-981-10-7913-9. OCLC 1021856401.
- Varady, Robert G.; Albrecht, Tamee R.; Staddon, Chad; Gerlak, Andrea K.; Zuniga-Teran, Adriana A. (2021). „The Water Security Discourse and Its Main Actors”. Handbook of Water Resources Management: Discourses, Concepts and Examples. стр. 215—252. ISBN 978-3-030-60145-4. S2CID 236726731. doi:10.1007/978-3-030-60147-8_8.
- Bonnafous, Luc; Lall, Upmanu; Siegel, Jason (2017-04-19). „A water risk index for portfolio exposure to climatic extremes: conceptualization and an application to the mining industry”. Hydrology and Earth System Sciences (на језику: енглески). 21 (4): 2075—2106. Bibcode:2017HESS...21.2075B. doi:10.5194/hess-21-2075-2017
 .
. - „The Water Crisis and Industries at Risk”. Morgan Stanley (на језику: енглески). Приступљено 2020-04-06.
- Hoekstra, Arjen Y; Buurman, Joost; van Ginkel, Kees C H (2018). „Urban water security: A review”. Environmental Research Letters. 13 (5): 053002. doi:10.1088/1748-9326/aaba52
 .
. - Carr, Acacia (3. 12. 2018). „Water Risk: Single Largest Risk Threatening People, Planet and Profit | GreenMoney Journal” (на језику: енглески). Приступљено 2020-04-06.
- „Climate change is devastating the world's water supplies. Why aren't we talking about it?”. Climate & Capital Media (на језику: енглески). 2021-01-14. Приступљено 2021-01-15.
- „New Water Risk Filter Scenarios will help companies and investors turn risk into resilience”.
- Grasham, Catherine Fallon; Charles, Katrina Jane; Abdi, Tilahun Geneti (2022). „(Re-)orienting the Concept of Water Risk to Better Understand Inequities in Water Security”. Frontiers in Water. 3: 799515. doi:10.3389/frwa.2021.799515
 .
. - Vörösmarty, C. J.; McIntyre, P. B.; Gessner, M. O.; Dudgeon, D.; Prusevich, A.; Green, P.; Glidden, S.; Bunn, S. E.; Sullivan, C. A.; Liermann, C. Reidy; Davies, P. M. (септембар 2010). „Global threats to human water security and river biodiversity”. Nature (на језику: енглески). 467 (7315): 555—561. Bibcode:2010Natur.467..555V. PMID 20882010. S2CID 4422681. doi:10.1038/nature09440. hdl:10983/13924.
- Foster, S.; Villholth, Karen; Scanlon, B.; Xu, Y. (2021-07-01). „Water security and groundwater”. International Association of Hydrogeologists. hdl:10568/116815.
- Staddon, Chad; Scott, Christopher (2021). Putting water security to work : addressing global sustainable development challenges (1st изд.). London. ISBN 9780367650193.
- Caretta, M.A., A. Mukherji, M. Arfanuzzaman, R.A. Betts, A. Gelfan, Y. Hirabayashi, T.K. Lissner, J. Liu, E. Lopez Gunn, R. Morgan, S. Mwanga, and S. Supratid, 2022: Chapter 4: Water. In: Climate Change 2022: Impacts, Adaptation and Vulnerability. Contribution of Working Group II to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change [H.-O. Pörtner, D.C. Roberts, M. Tignor, E.S. Poloczanska, K. Mintenbeck, A. Alegría, M. Craig, S. Langsdorf, S. Löschke, V. Möller, A. Okem, B. Rama (eds.)]. Cambridge University Press, Cambridge, UK and New York, NY, USA, pp. 551–712,„Water”. Climate Change 2022 – Impacts, Adaptation and Vulnerability. 2023. стр. 551—712. ISBN 9781009325844. doi:10.1017/9781009325844.006..
Спољашње везе
[уреди | уреди извор]- U.S. Centers for Disease Control and Prevention (CDC) Healthy Water – Drinking Water One-stop resource for drinking water
- US Environmental Protection Agency – National drinking water program – General info, regulations & technical publications
- WHO – Water Sanitation and Health: drinking water quality
