Rak pluća
| Rak pluća | |
|---|---|
 | |
| Rendgenski snimak pluća prikazuje tumor na plućima (obeleženo strelicom) | |
| Klasifikacija i spoljašnji resursi | |
| Specijalnost | онкологија, пулмонологија |
| MKB-10 | C33-C34 |
| MKB-9-CM | 162 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405 radio/406 |
| Patient UK | [https://patient.info/doctor/lung-cancer-pro lung-cancer-pro Rak pluća] |
| MeSH | D002283 |
Rak pluća je bolest za koju je karakterističan nekontrolisan ćelijski rast u tkivima pluća. Ako se ne leči, može doći do proširenja tog izraštaja van pluća putem procesa metastaze u okolna tkiva i druge delove tela. Većina kancera koji se začnu u plućima, tzv. primarni plućni kanceri, su karcinomi koji su izvedeni iz epitelnih ćelija. Većina tipova plućnih kancera su plućni karcinomi malih-ćelija (engl. small-cell lung carcinoma, SCLC). Najčešći simptomi su kašljanje (uključujući iskašljavanje krvi), gubitak telesne težine i kratkoća daha.[1]
Najčešći uzrok raka pluća je dugotrajno izlaganje duvanskom dimu,[2] koji uzrokuje 80-90% slučajeva raka pluća.[1] Nepušači sačinjavaju 10-15% slučajeva raka pluća,[3] koji se kod njih uglavnom javlja kao posledica kombinacije genetičkih faktora,[4] gasa radona,[4] azbesta,[5] i zagađenog vazduha[4] uključujući sekundarni unos duvanskog dima.[6][7] Rak pluća se može videti na rendgenskom snimku pluća i putem kompjuteriziranе tomografijе (CT snimka). Dijagnoza se potvrđuje biopsijom,[8] koja se obično izvodi putem bronhoskopije ili CT-navođenja. Tretmani i dugoročni ishodi zavise od tipa kancera, stupnja (stepena raširenosti), i sveukupnog zdravstvenog stanja osobe.
Često primenjivani tretmani su operacioni zahvat, hemoterapija, i radioterapija. NSCLC se u nekim slučajevima operativno tretira, dok SCLC bolje odgovara na hemoterapiju i radioterapiju.[9] U proseku, 15% onih koji su (u SAD) dijagnozirani sa rakom pluća prežive pet godina nakon dijagnoze.[10] Širom sveta, rak pluća je najčešći uzrok smrti usled kancera kod ljudi i žena, i odgovoran je za 1,38 miliona smrtnih slučajeva godišnje, po podacima iz 2008.[11]
Znaci i simptomi
[уреди | уреди извор]Znaci i simptomi koji mogu nagovestiti rak pluća uključuju:[1]
- respiratorne simptome: kašalj, iskašljavanje krvi, šištanje ili zadihanost
- sistemski simptomi: gubitak težine, groznica, krivljenje noktiju, ili umor
- simptom prouzrokovan lokalnom kompresijom: bol u grudima, kostobolja, opstrukcija gornje šuplje vene, otežano gutanje
Ako rak raste u disajnom putu, može ometati protok vazduha, uzrokujući otežano disanje. Opstrukcija može dovesti do akumulacije sekreta iza blokade i predisponirati upalu pluća.[1]
U zavisnosti od vrste tumora, takozvani paraneoplastični fenomen može od samog početka privući pažnju na bolest.[12] Kod raka pluća, ovaj fenomen može uključivati Lambert–Itonov miastenični sindrom (mišićnu slabost prouzrokovanu autoantitelima), hiperkalcemiju, ili sindrom neadekvatne sekrecije antidiuretičkog hormona (SNSAH). Tumori u vrhu pluća, poznati kao Pankoastovi tumori, mogu prodreti u lokalni deo simpatičkog nervnog sistema, što dovodi do Hornerovog sindroma (spuštenog kapka i sužene zenice na toj strani), kao i do oštećenja brahijalnog pleksusa.[1]
Mnogi simptomi raka pluća (loš apetit, gubitak težine, groznica, umor) nisu specifični.[13] Kod mnogih ljudi, rak se već proširio izvan izvornog mesta do vremena kada počnu da imaju simptome i zatraže medicinsku pomoć. Česta mesta širenja uključuju mozak, kost, nadbubrežne žlezde, suprotno plućno krilo, jetru, perikard, i bubrege.[14] Oko 10% ljudi sa rakom pluća nemaju simptome prilikom dijagnostikovanja; takav rak se slučajno otkriva prilikom rutinske radiografije grudnog koša.[10]
Uzroci
[уреди | уреди извор]Rak se razvija putem genetskog oštećenja DNK. Ovo genetsko oštećenje utiče na normalno funkcionisanje ćelije, uključujući ćelijsku proliferaciju, programiranu ćelijsku smrt (apoptozu) i popravku DNK. Što se više oštećenja akumuliraju, rizik od raka se uvećava.[15]
Pušenje
[уреди | уреди извор]
Pušenje, naročito cigareta, je najvažniji faktor koji doprinosi raku pluća.[16] Dim cigareta sadrži preko 60 poznatih karcinogena,[17] uključujući radioizotope iz sekvence raspada radona, nitrozamina, i benzopirena. Pored toga, izgleda da nikotin smanjuje imunološki odgovor na rast raka u izloženom tkivu.[18] Širom razvijenog sveta, 90% smrti od raka pluća kod muškaraca u toku 2000. godine su pripisane pušenju (70% za žene).[19] Pušenje je odgovorno za 80–90% slučajeva raka pluća.[1]
Pasivno pušenje—udisanje dima pušenja druge osobe—je uzrok raka pluća kod nepušača. Pasivni pušač se može klasifikovati kao neko ko živi ili radi sa pušačem. Istraživanja iz SAD-a,[20][21] Evrope,[22] Ujedinjenog Kraljevstva,[23] i Australije[24] su dosledno pokazala značajno povećani rizik među onima koji su izloženi pasivnom pušenju.[25] Oni koji žive sa pušačem imaju 20–30% veći rizik dok oni koji rade u okruženju sa dimom „iz druge ruke“ imaju 16–19% povećani rizik.[26] Istraživanja bočnog dima nagoveštavaju da je opasniji od direktnog dima.[27] Pasivno pušenje prouzrokuje oko 3.400 smrti od raka pluća svake godine u SAD-u.[21]
Gas radon
[уреди | уреди извор]Radon je gas bez boje i bez mirisa koji nastaje raspadom radioaktivnog radijuma, što je nadalje proizvod raspada uranijuma, koji se nalazi u Zemljinoj kori. Radijacijski proizvodi raspada joniziraju genetski materijal, uzrokujući mutacije koje nekada postaju kancerogene. Radon je drugi najčešći uzročnik raka pluća u SAD, posle pušenja.[21] Rizik se povećava 8–16% na svakih 100 Bq/m³ povećanja u koncentraciji radona.[28] Nivo gasa radona varira u zavisnosti od lokaliteta i sastava osnove zemljišta i stena. Na primer, u oblastima kao što je Kornval u Ujedinjenom Kraljevstvu (koji ima granit kao supstrat), gas radon je najveći problem, i zgrade se moraju nasilno ventilirati ventilatorima da bi se smanjile koncentracije gasa radona. Agencija za zaštitu životne sredine Sjedinjenih Država (EPA) procenjuje da jedan u 15 domova u SAD ima nivo radona iznad preporučene smernice od 4 pikokirija po litru (pCi/l) (148 Bq/m³).[29]
Azbest
[уреди | уреди извор]Azbest može prouzrokovati različita oboljenja pluća, uključujući rak pluća. Pušenje duvana i azbest imaju sinergističko dejstvo na formiranje raka pluća.[5] Azbest može da prouzrokuje rak plućne maramice, koji se zove mezotelioma (koji se razlikuje od raka pluća).[30]
Zagađenje vazduha
[уреди | уреди извор]Spoljašnje zagađenje vazduha ima slabo dejstvo na povećavanje rizika od raka pluća.[4] Fine čestice (PM2.5) i sulfatni aerosoli, koji se mogu oslobađati saobraćajnim izduvnim gasovima, povezani su sa blago povećanim rizikom.[4][31] Za azot dioksid, postepeno povećanje od 10 delova na milijardu povećava rizik od raka pluća za 14%.[32] Procenjuje se da je spoljašnje zagađenje vazduha odgovorno za 1–2% raka pluća.[4]
Okvirni dokazi podržavaju uvećani rizik od raka pluća od unutrašnjeg zagađenja vazduha koje je povezano sa sagorevanjem drva, uglja, izmeta ili ostataka useva prilikom kuvanja ili grejanja.[33] Žene koje su izložene unutrašnjem dimu od uglja imaju dva puta veći rizik, a brojni sporedni proizvodi sagorevanja biomase su poznati kao mogući kancerogeni.[34] Ovaj rizik pogađa oko 2,4 milijarde ljudi širom sveta,[33] i veruje se da je odgovorno za 1,5% smrti od raka pluća.[34]
Genetika
[уреди | уреди извор]Procenjuje se da su za 8 do 14% raka pluća zaslužni nasledni faktori.[35] Kod srodnika obolelih od raka pluća, rizik se povećava 2,4 puta. Za ovo je verovatno zaslužan kombinacija gena.[36]
Drugi uzroci
[уреди | уреди извор]Brojne druge supstance, zanimanja i izloženost životnoj sredini povezani su sa rakom pluća.Međunarodna agencija za istraživanje raka (IARC) tvrdi da postoji ”dovoljno dokaza” koji bi potkrepili da je sledeće kancerogeno za pluća:[37]
- Neki metali (proizvodi aluminijuma, kadmijum i jedinjenja kadmijuma, jedinjenja hroma(VI), berilijum i jedinjenja berilijuma, gvožđe i legure čelika, jedinjenja nikla, arsen i neorganska jedinjenja arsena, podzemno kopanje rude hematita)
- Neki proizvodi sagorevanja (nepotpuno sagorevanje, ugalj (emisija gasova u domaćinstvu pri sagorevanju uglja), gasifikacija uglja, katran kamenog uglja, proizvodnja koksa, čađ, izduvni gasovi dizel motora)
- Jonizujuće zračenje (rendgensko zračenje, radon-222 i njegovi produkti raspadanja, gama zračenje, plutonijum)
- Neki toksični gasovi (metil etar (tehnički stepen), bis-(hlorometil) etar, sumpurni iperit, MOPP (mešavina vinkristin-prednison - azotni iperit - prokarbazin), gasovi koji nastaju prilikom farbanja)
- Proizvodnja gume i kristalina prašina peska
Patogeneza
[уреди | уреди извор]Kao i druge vrste raka, rak pluća počinje aktiviranjem onkogena ili deaktiviranjem gena supresora tumora.[38] Veruje se da onkogeni čine ljude podložnijim obolevanju od raka. Za proto-onkogene se veruje da se pretvaraju u onkogene prilikom izloženosti određenim kancerogenima.[39] Mutacije K-ras proto-onkogena su odgovorne za 10–30% adenokarcinoma pluća.[40][41] Receptor epidermalnog faktora rasta (EGFR) reguliše proliferaciju ćelija, apoptozu, angiogenezu i invaziju tumora.[40] Mutacije i amplifikacija EGFR-a su uobičajene kod nemikrocelularnog karcinoma pluća i pružaju osnovu za tretman pomoću EGFR-inhibitora. Her2/neu je pogođen manje učestalo.[40] Oštećenje hromozoma može dovesti do gubitka heterozigotnosti. Ovo može prouzrokovati inaktivaciju gena supresora tumora. Oštećenja hromozoma 3p, 5q, 13q i17p su posebno česta kod mikrocelularnog karcinoma pluća. Gen supresor tumora p53 koji se nalazi na hromozomu 17p, je pogođen u 60-75% slučajeva.[42] Drugi geni koji su često mutirani ili amplificirani su c-MET, NKX2-1,LKB1, PIK3CA, i BRAF.[40]
Dijagnoza
[уреди | уреди извор]
Radiografija grudnog koša je jedan od prvih koraka ispitivanja ako osoba prijavi simptome koji sugerišu karcinom pluća. Ovim se može otkriti postojanje mase, širenje medijastinuma (nagoveštaj širenja na limfne čvorove u tom predelu), atelektaza (kolaps), konsolidacija (pneumonija) ili pleurali izliv.[2] CT snimanje se obično koristi za dobijanje više informacija o tipu i obimu bolesti. Bronhoskopija ili biopsija pomoću CT-a se često koristi za uzimanje uzorka tumora za histopatologiju.[10]
Karcinom pluća se često javlja kao pojedinačna plućna kvržica na radiogramu grudnog koša. Međutim, diferencijalna dijagnoza je širokog opsega. Mnoge druge bolesti pokazuju ove simptome, uključujući tuberkulozu, gljivične infekcije, metastatički tumor ili organizovanje pneumonije. Manje učestali uzroci pojedinačne plućne kvržice uključuju hamartome, bronhogene ciste, adenome, arteriovenske malformacije, pulmonarnu sekvestraciju, reumatoidne kvržice, Vegenerovu granulomatozu ili limfom.[43] Karcinom pluća može biti i slučajni nalaz, kao pojedinačna plućna kvržica na radiogramu grudnog koša ili CT-u načinjenom iz nepovezanih razloga.[44] Konačna dijagnoza karcinoma pluća zasniva se na histološkom ispitivanju sumnjivog tkiva u kontekstu kliničkih i radioloških nalaza.[1]
Klasifikacija
[уреди | уреди извор]| Histološki tip | Učestalost na 100.000 po godini |
|---|---|
| Svi tipovi | 66.9 |
| Adenokarcinom | 22.1 |
| Karcinom skvamoznih ćelija | 14.4 |
| Mikrocelularni karcinomi | 9.8 |
Karcinomi pluća se klasifikuju u skladu sa histološkim tipom.[13] Ova klasifikacija je važna za utvrđivanje lečenja i predviđanje ishoda bolesti. Najveći broj slučajeva raka pluća su karcinomi — maligniteti koji nastaju iz epitelnih ćelija. Karcinomi pluća se kategorišu prema veličini i obliku malignih ćelija koje histopatolog vidi pod mikroskopom. Dve široke klase su nemikrocelularni i mikrocelularni karcinom pluća.[45]
Nemikrocelularni karcinom pluća
[уреди | уреди извор]
Tri glavna podtipa nemikrocelularnog karcinoma pluća su adenokarcinom, karcinom pluća skvamoznih ćelija i makrocelularni karcinom pluća.[1]
Skoro 40% slučajeva raka pluća su adenokarcinomi, koji obično nastaju u perifernom plućnom tkivu.[13] Većina slučajeva adenokarcinoma su povezani sa pušenjem; mada je kod ljudi koji su tokom svog života popušili manje od 100 cigareta (“nepušači”),[1] adenokarcinom najučestaliji oblik raka pluća.[46] Podtip adenokarcinoma, bronhioloalveolarni karcinom, je najučestaliji kod nepušača ženskog pola i može imati bolji dugoročniji opstanak.[47]
Skoro 30% slučajeva raka pluća su karcinomi skvamoznih ćelija. Često se javljaju u blizini velikih disajnih puteva. Šupljina i odgovarajuća smrt ćelija se često nalaze u središtu tumora.[13] Oko 9% raka pluća su makrocelularni karcinomi. Nazivaju se tako jer su ćelije raka velike, sa prekomernom citoplazmom, velikim jedrom i upadljivim jedarcima.[13]
Mikrocelularni karcinom pluća
[уреди | уреди извор]
Kod mikrocelularnog karcinoma pluća ćelije sadrže guste neurosekretorne granule (vezikule koji sadrže neuroednokrine hormone), koji povezuju sa endokrinim/paraneoplastičnim sindromom.[48] Većina slučajeva nastaje u velikim disajnim putevima (primarne i sekundarne bronhije).[10] Ovi karcinomi brzo rastu i šire se u ranoj fazi bolesti. Šezdeset do sedamdeset posto slučajeva ima metastaze već prilikom javljanja. Ovaj tip raka pluća se čvrsto povezuje sa pušenjem.[1]
Drugi
[уреди | уреди извор]Prepoznata su četiri različita histološka podtipa, iako neki karcinomi sadrže kombinaciju različitih podtipova.[45] Retki podtipovi uključuju glandularni tumori, karcinoidni tumori i nediferencirani karcinomi.[1]
Metastaza
[уреди | уреди извор]| Histološki tip | Immunostain |
|---|---|
| Karcinom skvamoznih ćelija | CK5/6 pozitivan CK7 negativan |
| Adenokarcinom | CK7 pozitivan TTF-1 pozitivan |
| Makrocelularni karcinom | TTF-1 negativan |
| Mikrocelularni karcinom | TTF-1 pozitivan CD56 pozitivan Hromogranin pozitivan Sinaptofizin pozitivan |
Pluća su uobičajeno mesto za širenje tumora sa ostalih delova tela. Sekundarni karcinomi se klasifikuju prema mestu porekla, npr. rak dojke koji se proširio na pluća naziva se metastatski rak dojke. Metastaze često imaju karakterističan zaobljeni oblik na radiogramu grudnog koša.[49]
Sami primarni rak pluća najčešće daje metastaze u mozak, kosti, jetru i nadbubrežnu žlezdu.[13] Imunobojenje biopsije često pomaže pri utvrđivanju originalnog izvora.[50]
Određivanje stadijuma
[уреди | уреди извор]Određivanje stadijuma raka pluća je ispitivanje stepena širenja raka sa svog originalnog izvora. To je jedan od faktora koji utiču na prognozu i mogućnost lečenja raka pluća.[1]
Prilikom inicijalne procene stadijuma kod nemikrocelularnog raka pluća koristi se TNM klasifikacija. Zasniva se na veličini primarnog tumora, zahvaćenosti limfnih čvorova (engl. node) i udaljene metastaze. Nakon toga, koristeći TNM deskriptore, dodeljuje se grupa, u rasponu od skrivenog raka do stadijuma 0, IA (jedan-A), IB, IIA, IIB, IIIA, IIIB i IV (četiri). Ovo grupisanje stadijuma pomaže pri izboru lečenja i proceni prognoze..[51] Mikrocelularni karcinom pluća je tradicionalno klasifikovan kao „ograničeni stadijum“ (ograničen na polovinu grudnog koša i u okviru jednog podnošljivog polja radioterapije) ili „prošireni stadijum“ (proširenija bolest).[1] Međutim, TNM klasifikacija i grupisanje su korisni pri proceni prognoze.[51]
Za oba tipa raka, nemikrocelularni i mikrocelularni karcinom, dva opšta tipa procene stadijuma predstavljaju kliničko određivanje stadijuma i hirurško određivanje stadijuma. Klinički stadijumi se određuju pre konačne operacije. Zasniva se na rezultatima proučavanja snimaka (kao što su CT snimci i PET snimci) i rezultatima biopsije. Hirurški stadijumi se određuju ili tokom ili nakon operacije i zasnivaju se na kombinovanim rezultatima hirurških i kliničkih nalaza, uključujući hirurško uzimanje uzoraka torakalnih limfnih čvorova.[13]
Prevencija
[уреди | уреди извор]Prevencija je najefikasnije sredstvo u smanjenju razvoja raka pluća. Dok su u mnogim zemljama identifikovani i zabranjeni mnogi industrijski kancerogeni i karcinogeni u domaćinstvu, pušenje duvana je i dalje široko rasprostranjeno. Eliminacija pušenja duvana je primarni cilj u prevenciji raka pluća i zabrana pušenja je važno preventivno sredstvo u ovom procesu.[52]
Zakonske intervencije u pogledu smanjenja pasivnog pušenja na javnim mestima kao što su restorani i radna mesta su postale sve učestalije u mnogim zapadnim zemljama.[53] Butan primenjuje potpunu zabranu pušenja od 2005.godine.[54] dok je Indija uvela zabranu pušenja na javnim mestima u oktobru 2008.godine.[55] Svetska zdravstvena organizacija je uputila poziv vladama za uvođenje potpune zabrane reklamiranja duvana, kako bi mlade ljude sprečili da počnu da puše. Procenjuju da su takve zabrane smanjile konzumiranje duvana za 16% tamo gde su uvedene.[56]
Dugotrajno korišćenje dodatnog vitamina A,[57][58] vitamina C,[57] vitamina D[59] ili vitamina E[57] ne umanjuje rizik od raka pluća. Neka istraživanja sugerišu da ljudi koji jedu hranu sa većom količinam povrća i voća imaju manji rizik,[21][60] ali ovde je verovatno došlo do delovanja drugih faktora. Ozbiljnije istraživanja nisu pokazala jasnu povezanost.[60]
Skrining
[уреди | уреди извор]Skrining podrazumeva primenu medicinskih testova u cilju otkrivanja bolesti kod ljudi bez simptoma. U moguće testove za rak pluća spadaju citologija ispljuvka, rendgen pluća (CXR) i računarizovana tomografija (CT). Skrining programi u kojima se primenjuju rendgenski snimak pluća ili citologija nisu pokazali neku korist.[61] Godišnji skrining rizičnih osoba (tj. osoba starosti od 59 do 79 godina koje su pušile više od 30 pakličnih godina ili osoba koje su ranije imale rak pluća) sa niskom doznim CT skenerom može da smanji procenat smrtnosti od raka pluća u apsolutnom iznosu od 0.3% (relativnog iznosa od 20%).[62][63] Međutim, postoji visoka stopa lažno pozitivnih rezultata skeniranja što može dovesti do nepotrebnih invazivnih postupaka kao i do znatnih finansijskih troškova.[64] Na svaki pozitivni rezultat skeniranja dolazi 19 lažno pozitivnih rezultata.[65] Izlaganje radijaciji je još jedna potencijalna štetna osobina skrininga.[66]
Menadžment
[уреди | уреди извор]Lečenje raka pluća zavisi od specifičnog tipa ćelija raka, u kojoj meri se proširio i od performansnog statusa osobe. Uobičajeni oblici lečenja uključuju: palijativnu negu,[67] hirurške zahvate, hemoterapiju i radijacionu terapiju.[1]
Hirurgija
[уреди | уреди извор]
Ukoliko ispitivanja potvrde da postoji nemikrocelularni karcinom pluća, ispituje se stadijum radi određivanja da li je bolest lokalizovana i podložna hirurškom zahvatu ili se proširila u tolikoj meri da se ne može izlečiti hirurškim putem. Za donošenje ovakve odluke primenjuje se CT skeniranje i pozitronska emisiona tomografija.[1] Ukoliko se sumnja da je karcinom zahvatio i medijastinalni limfni čvor, onda se, u cilju dobijanja uzoraka i određivanja stadijuma može primeniti medijastinoskopija.[68] Radi utvrđivanja da li je pacijent dovoljno dobro za izvođenje hirurške intervencije, koristi se pregled krvi i testiranje funkcije pluća.[10] Ako se pri testiranju funkcije pluća utvrdi slab kapacitet pluća, operacija verovatno nije moguća.[1]
U većini slučajeva rane faze nemikrocelularnog karcinoma pluća, uklanjanje režnja plućnog krila (lobektomija) je preferentni hirurški zahvat. Kod ljudi koji nisu spremni za potpunu lobektomiju, može se uraditi manja sublobarna ekscizija (klinasta resekcija). Međutim, kod klinaste resekcije postoji veći rizik od rekurencije nego kod lobektomije.[69] Radioaktivna jodna brahiterapija na rubovima klinaste resekcije može smanjiti rizik od rekurencije.[70] Retko se pribegava uklanjanju celog plućnog krila (pneumonektomiji).[69] Video-asistirana torakoskopska hirurgija i VATS lobektomija koriste minimalno invazivni pristup u hirurgiji raka pluća.[71] VATS lobektomija je isto tako efikasna kao i konvencionalna otvorena lobektomija, ali sa manjim postoperativnim problemima.[72]
Kod mikrocelularnog karcinoma pluća, tipično se primenjuju hemoterapija i/ili zračenje.[73] Međutim, ponovo se razmatra uloga hirurgije kod mikrocelularnog karcinoma pluća. Hirurgija bi mogla poboljšati ishod kada bi se udružila sa hemoterapijom i zračenjem u ranom stadijumu mikrocelularnog karcinoma pluća.[74]
Radioterapija
[уреди | уреди извор]Radioterapija se često primenjuje zajedno sa hemoterapijom i može se koristiti u svrhu lečenja pacijenata sa nemikrocelularnim karcinomom pluća koji nisu za operaciju. Ova vrsta zračenja velikog intenziteta naziva se radikalna radioterapija.[75] Najsavršeniji oblik ove tehnike je neprekidna hiperfrakcionisana ubrzana radioterapija sa višekratnim dnevnim zračenjem (CHART), u kojoj se primenjuje visoka doza zračenja u kratkim vremenskim razmacima.[76] Postoperativna torakalna radioterapija se uopšte ne bi smela primenjivati posle kurativnog hirurškog zahvata kod nemikrocelularnog karcinoma pluća.[77] Neki ljudi kod kojih je zahvaćen mediastinalni N2 limfni čvor mogu imati koristi od postoperativne radioterapije.[78]
Kod potencijalno izlečivih slučajeva mikrocelularnog karcinoma pluća, često se uz hemoterapiju preporučuje i radioterapija grudnog koša.[13]
Ako rast karcinoma blokira kratak segment bronhija, brahiterapija (lokalizovana radioterapija) se može primeniti direktno unutar vazdušnog puta kako bi se prolaz oslobodio.[79] Za razliku od spoljašnje zračne radioterapije, brahiterapija omogućava smanjenje vremena lečenja i manje izlaganje zračenju medicinskog osoblja.[80]
Profilaktička kranijalna iradijacija (PKI) jeste vrsta radioterapije mozga, koja se koristi za smanjivanje rizika od metastaza. PKI je najkorisnija upravo kod pacijenata sa mikrocelularnim karcinomom. U ograničenom stadijumu bolesti, PKI povećava trogodišnje preživljavanje sa 15% na 20%; kod široko rasprostranjene bolesti, jednogodišnje preživljavanje povećava sa 13% na 27%.[81]
Nedavna poboljšanja u lociranju i snimanju je dovela do razvoja stereotaktičkog zračenja u lečenju ranog stadijuma raka pluća. U ovom obliku radioterapije, daju se visoke doze kod malog broja zračenja primenjujući stereotaktičke postupke lociranja. Ona se koristi prvenstveno kod pacijenata koji nisu kandidati za operaciju zbog zdravstvenih komorbiditeta.[82]
Za pacijente sa NMCKP i sa MCKP, se mogu koristiti manje doze zračenja grudnog koša u cilju kontrole simptoma (palijativna radioterapija).[83]
Hemoterapija
[уреди | уреди извор]Režim hemoterapije zavisi od vrste tumora.[13] Mikrocelularni karcinom pluća (MCKP), i u relativno ranom stadijumu bolesti, se prvenstveno leči hemoterapijom i zračenjem.[84] Kod MCKP se najčešće primenjuju cisplatin i etopozid.[85] Takođe se primenjuju kombinacije karboplatina, gemcitabina, paklitaksela, vinorelbina, topotekana i irinotekana.[86][87] Kod nemikrocelularnog karcinoma pluća (NMCKP) u poodmaklom stadijumu, hemoterapija poboljšava preživljavanje i primenjuje se kao prva linija borbe protiv bolesti, dovoljno osposobljavajući osobu za lečenje.[88] Najčešće se koriste dva leka, jedan od kojih je često na bazi platine (ili cisplatin ili karboplatin). Drugi obično korišćeni lekovi su gemcitabin, paklitaksel, docetaksel,[89][90] pemetreksed,[91] etopozid ili vinorelbin.[90]
Adjuvantna hemoterapija se odnosi na primenu hemoterapije posle očigledno kurativne hirurgije da bi se poboljšao ishod. Kod NMCKP-a, uzimaju se uzorci iz obližnjih limfnih čvorova tokom hirurške intervencije da bi se odredio stadijum. Ako je potvrđen stadijum bolesti II ili III, adjuvantna hemoterapija poboljšava preživljavanje za 5% tokom pet godina.[92][93] Kombinacija primene vinorelbina i cisplatina je efikasnija od starijih načina lečenja.[93] Adjuvantna hemoterapija kod osoba koje su u stadijumu raka IB je sporna, s obzirom da klinička ispitivanja nisu jasno pokazala korist za preživljavanje.[94][95] Ispitivanja preoperativne hemoterapije (neoadjuvantna hemoterapija) kod resektibilnog NMCKP-a nisu dala zaključak.[96]
Palijativna nega
[уреди | уреди извор]Kod osoba u terminalnom stadijumu bolesti, mogla bi biti podobna palijativna nega ili zbrinjavanje u domu za nemoćne.[10] Ovakav pristup daje prostor za dodatnu diskusiju o načinima lečenja i pruža mogućnost za donošenje odluka koje su dobro razmotrene[97][98] i kojima se može izbeći beskorisna a skupa nega na kraju života.[98]
Hemoterapija se može kombinovati sa palijativnom negom kod lečenja NMCKP-a. Kod uznapredovalih slučajeva, odgovarajuća hemoterapija poboljšava prosek preživljavanja u odnosu na primenu isključivo pomoćne nege za ublažavanje bolesti, a takođe poboljšava i kvalitet života.[99] Uz odgovarajuće fizičke sposobnosti, podvrgavanje hemoterapiji tokom palijacije raka pluća pruža 1,5 do 3 meseca produženja preživljavanja, simptomatsko olakšanje, kao i poboljšanje kvaliteta života, pri čemu su primećeni bolji rezultati sa modernim agensima.[100][101] Radna grupa za meta analize NMCKP-a preporučuje da se razmotri hemoterapija kod uznapredovalog NMCKP-a u slučaju da primalac želi i podnosi terapiju.[88][102]
Prognoza
[уреди | уреди извор]| Klinički stadijum | Petogodišnje preživljavanje (%) | |
|---|---|---|
| Nemikrocelularni karcinom pluća | Mikrocelularni karcinom pluća | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Prognoza je generalno loša. Od svih ljudi sa rakom pluća, 15% preživi pet godina od postavljanja dijagnoze.[2] Stadijum bolesti je često napredan u trenutku postavljanja dijagnoze. Na pregledu, 30–40% slučajeva NMCKP-a je u stadijumu IV i 60% slučajeva MCKP-a je u stadijumu IV.[13]
Prognostički činioci kod NMCKP-a obuhvataju prisustvo ili odsustvo pulmonarnih simptoma, veličinu tumora, tip ćelija (histologija), stepen rasprostranjenosti (stadijum) i metastaze na višestrukim limfnim čvorovima, kao i vaskularnu invaziju. Kod osoba u neoperativnom stadijumu bolesti, ishod je lošiji kod osoba sa lošim opštim stanjem i gubitkom težine većim od 10%.[103] Prognostički činioci kod mikrocelularnog karcinoma pluća uključuju procenu opšteg stanja, pol, stadijum bolesti i zahvaćenost centralnog nervnog sistema ili jetre u vreme dijagnostifikovanja.[104]
Kod NMCKP-a, najbolja prognoza se postiže potpunom hirurškom resekcijom kod bolesti u stadijumu IA, sa čak do 70% petogodišnjeg preživljavanja.[105] Kod MCKP-a, ukupno petogodišnje preživljavanje iznosi oko 5%.[1] Kod ljudi u razvijenom stadijumu MCKP-a prosečna stopa petogodišnjeg preživljavanja je manja od 1%. Prosečno vreme preživljavanja kod stadijuma ograničene bolesti je 20 meseci, sa petogodišnjom stopom preživljavanja od 20%.[2]
Prema podacima koje je dao Nacionalni institut za rak, srednje starosno doba pri postavljanju dijagnoze raka pluća u Sjedinjenim Državama iznosi 70 godina,[106] a srednja starosno doba u trenutku smrti je 72 godine.[107] U SAD-u, kod ljudi koji imaju zdravstveno osiguranje postoji veća verovatnoća za bolji ishod.[108]
Epidemiologija
[уреди | уреди извор]
- bez podataka
- ≤ 5
- 5-10
- 10-15
- 15-20
- 20-25
- 25-30
- 30-35
- 35-40
- 40-45
- 45-50
- 50-55
- ≥ 55
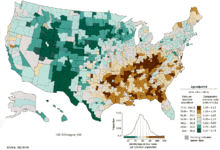
U svetu, rak pluća je najčešći tip raka u pogledu incidence i mortaliteta. U 2008. godini, bilo je 1,61 miliona novih slučajeva i 1,38 miliona smrtnih slučajeva uzrokovano rakom pluća. Najveće su stope u Evropi i Severnoj Americi.[110] Segment stanovništva kod koga je najveća verovatnoća za pojavu raka pluća su osobe starije od 50 godina sa istorijom pušenja. Nasuprot stopi mortaliteta kod muškaraca, koja je počela da opada pre više od 20 godina, stopa mortaliteta od raka pluća kod žena je u porastu tokom zadnjih decenija, i tek nedavno je počela da se ustaljuje.[111] U SAD-u, životni rizik od razvoja raka pluća je 8% kod muškaraca i 6% kod žena.[1]
Na svakih 3–4 miliona popušenih cigareta, desi se jedan smrtni slučaj od raka pluća.[1][112] Uticaj ,, Big Tobako" igra značajnu ulogu u pušačkoj kulturi.[113] Mladi nepušači koji vide reklame za duvan imaju veće šanse da krenu sa pušenjem.[114] Uloga pasivnog pušenja se sve više uočava kao faktor rizika za rak pluća,[25] vodeći ka primeni interventnih mera da bi se smanjila neželjena izloženost nepušača duvanskom dimu drugih pušača.[115] Emisija štetnih gasova iz automobila, fabrika i elektrana takođe predstavlja potencijalni rizik.[4]
Istočna Evropa ima najveću smrtnost od raka pluća među muškarcima, dok severna Evropa i SAD imaju najveću smrtnost među ženama. U Sjedinjenim Državama, kod crnaca i crnkinja je veća incidenca.[116] Stope raka pluća su trenutno niže u zemljama u razvoju.[117] Sa povećanjem pušenja u zemljama u razvoju, očekuje se povećanje stopa u nekoliko sledećih godina, u Kini[118] i Indiji značajno.[119]
Od 1960-tih stope adenokarcinoma pluća su počele da rastu u odnosu na ostale tipove raka pluća. Delimično je to posledica uvođenja filter cigareta. Upotrebom filtera otklanjaju se veće čestice iz duvanskog dima, čime se smanjuje njihovo taloženje u velikim disajnim putevima. Međutim, pušač mora da udahne dublje da bi primio istu količinu nikotina, povećavajući taloženje čestica u malim disajnim putevima, gde postoji tendencija pojave adenokarcinoma.[120] Incidenca za pojavu plućnog adenokarcinoma je i dalje u porastu.[121]
Istorija
[уреди | уреди извор]Rak pluća je bio neuobičajen pre pojave pušenja cigareta; do 1761. godine čak nije bio ni prepoznat kao posebna bolest.[122] Različiti aspekti raka pluća više su opisani 1810. godine.[123] Zloćudni tumori pluća čine samo 1% svih tipova raka koji su viđeni pri obdukciji 1878. godine, ali je broj porastao na 10–15% do početka 1900-tih.[124] Bilo je svega 374 izveštaja o slučajevima širom sveta prikazanih u medicinskoj literaturi 1912. godine,[125] ali je pregled obdukcija pokazao da je incidenca raka pluća porasla sa 0,3% u 1852. godini na 5,66% u 1952.godini.[126] Lekar Fric Likint je 1929. godine u Nemačkoj uočio vezu između pušenja i raka pluća,[124] što je dovelo do agresivne kampanje protiv pušenja.[127] Studija britanskih lekara, objavljena 1950-tih, bila je prvi čvrsti epidemiološki dokaz o vezi između raka pluća i pušenja.[128] Kao rezultat, glavni hirurg Sjedinjenih Država 1964. godine je dao preporuku pušačima da prestanu sa pušenjem.[129]
Povezanost sa gasom radonom je prvi put primećena među rudarima na Rudnim gorama u blizini grada Šneberg, Saksonija. Od 1470. godine tamo se iskopavalo srebro, a ovi rudnici su bili bogati uranijumom, kao i radijumom i gasom radonom.[130] Kod rudara se razvio nesrazmerno veliki broj slučajeva bolesti pluća, koji su na kraju prepoznati kao rak pluća 1870-tih.[131] Uprkos ovom otkriću, iskopavanja su nastavljena do 1950-tih, zbog potražnje SSSR-a za uranijumom.[130] Radon je potvrđen kao uzročnik raka pluća 1960-tih.[132]
Prva uspešna pneumoektomija kod raka pluća je izvršena 1933.godine.[133] Palijativna radioterapija se koristi od 1940-tih.[134] Primena radikalne radioterapije, prvobitno korišćena 1950-tih, bio je pokušaj upotrebe većih doza zračenja kod pacijenata koji su u relativno ranim fazama raka pluća, a kod kojih je hirurška intervencija nepodobna.[135] 1997. godine, neprekidna hiperfrakcionisana ubrzana radioterapija je viđena kao poboljšanje u odnosu na konvencionalnu radikalnu radioterapiju.[136] Kod mikroćelijskog karcinoma pluća, početni pokušaji 1960-tih u oblasti hirurške resekcije[137] i radikalne radioterapije[138] bili su neuspešni. Uspešni režimi hemoterapije razvijeni su tokom 1970-tih godina.[139]
Reference
[уреди | уреди извор]- ^ а б в г д ђ е ж з и ј к л љ м н њ о п р Horn, L; Pao W; Johnson DH (2012). „Chapter 89”. Harrison's Principles of Internal Medicine (18th изд.). McGraw-Hill. ISBN 978-0-07-174889-6.
- ^ а б в г „Lung Carcinoma: Tumors of the Lungs”. Merck Manual Professional Edition, Online edition. Приступљено 15. 8. 2007.
- ^ Thun, MJ; Hannan LM; Adams-Campbell LL; et al. (2008). „Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies”. PLoS Medicine. 5 (9): e185. PMC 2531137
 . PMID 18788891. doi:10.1371/journal.pmed.0050185.
. PMID 18788891. doi:10.1371/journal.pmed.0050185.
- ^ а б в г д ђ е ж Alberg AJ, Samet JM (2010). „Chapter 46”. Murray & Nadel's Textbook of Respiratory Medicine (5th изд.). Saunders Elsevier. ISBN 978-1-4160-4710-0.
- ^ а б O'Reilly, KM; Mclaughlin AM; et al. (2007). „Asbestos-related lung disease”. American Family Physician. 75 (5): 683—688. PMID 17375514. Архивирано из оригинала 29. 09. 2007. г. Приступљено 06. 07. 2013.
- ^ Carmona, RH (27. 6. 2006). „The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General”. U.S. Department of Health and Human Services. Архивирано из оригинала 3. 7. 2006. г. Приступљено 6. 7. 2013. „Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.”
- ^ „Tobacco Smoke and Involuntary Smoking” (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer. 83. 2002. „There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. [...] Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).”
- ^ Brown, KM; Keats JJ; et al. (2010). „8”. Holland-Frei Cancer Medicine (8th изд.). People's Medical Publishing House USA. ISBN 978-1607950141.
- ^ Chapman, S; Robinson G; et al. (2009). „Chapter 31”. Oxford Handbook of Respiratory Medicine (2nd изд.). Oxford University Press. ISBN 978-0-19-954516-2.
- ^ а б в г д ђ Collins, LG; Haines C; et al. (2007). „Lung cancer: diagnosis and management”. American Family Physician. American Academy of Family Physicians. 75 (1): 56—63. PMID 17225705. Архивирано из оригинала 29. 09. 2007. г. Приступљено 06. 07. 2013.
- ^ Ferlay, J; Shin HR; et al. (decembar 2010). „Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008”. International Journal of Cancer. 127 (12): 2893—2917. PMID 21351269. doi:10.1002/ijc.25516.
- ^ Honnorat, J; Antoine JC (2007). „Paraneoplastic neurological syndromes”. Orphanet Journal of Rare Diseases. BioMed Central. 2 (1): 22. PMC 1868710
 . PMID 17480225. doi:10.1186/1750-1172-2-22.
. PMID 17480225. doi:10.1186/1750-1172-2-22.
- ^ а б в г д ђ е ж з и Lu, C; Onn A; et al. (2010). „78: Cancer of the Lung”. Holland-Frei Cancer Medicine (8th изд.). People's Medical Publishing House. ISBN 9781607950141.
- ^ Greene, Frederick L. (2002). AJCC cancer staging manual. Berlin: Springer-Verlag. ISBN 978-0-387-95271-0.
- ^ Brown, KM; Keats JJ; et al. (2010). „8”. Holland-Frei Cancer Medicine (8th изд.). People's Medical Publishing House USA. ISBN 978-1607950141.
- ^ Biesalski, HK; Bueno de Mesquita B; et al. (1998). „European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel”. CA Cancer J Clin. Smoking is the major risk factor, accounting for about 90% of lung cancer incidence. 48 (3): 167—176; discussion 164—166. PMID 9594919. doi:10.3322/canjclin.48.3.167.
- ^ Hecht, S (2003). „Tobacco carcinogens, their biomarkers and tobacco-induced cancer”. Nature Reviews. Cancer. Nature Publishing Group. 3 (10): 733—744. PMID 14570033. doi:10.1038/nrc1190.
- ^ Sopori, M (2002). „Effects of cigarette smoke on the immune system”. Nature Reviews. Immunology. 2 (5): 372—7. PMID 12033743. doi:10.1038/nri803.
- ^ Peto, R; Lopez AD; et al. (2006). Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. ISBN 978-0-19-262535-9.
- ^ California Environmental Protection Agency (1997). „Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency”. Tobacco Control. 6 (4): 346—353. PMC 1759599
 . PMID 9583639. doi:10.1136/tc.6.4.346.
. PMID 9583639. doi:10.1136/tc.6.4.346.
* CDC (2001). Centers for Disease Control and Prevention (CDC). „State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000”. Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC. 50 (49): 1101—1106. PMID 11794619. - ^ а б в г Alberg, AJ; Samet JM (2007). „Epidemiology of lung cancer”. Chest. American College of Chest Physicians. 132 (S3): 29S—55S. PMID 17873159. doi:10.1378/chest.07-1347. Архивирано из оригинала 29. 03. 2020. г. Приступљено 08. 02. 2014.
- ^ Jaakkola, MS; Jaakkola JJ (2006). „Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention”. European Respiratory Journal. 28 (2): 397—408. PMID 16880370. doi:10.1183/09031936.06.00001306.
- ^ Parkin, DM (2011). „Tobacco—attributable cancer burden in the UK in 2010”. British Journal of Cancer. 105 (Suppl. 2): S6—S13. PMC 3252064
 . PMID 22158323. doi:10.1038/bjc.2011.475.
. PMID 22158323. doi:10.1038/bjc.2011.475.
- ^ National Health and Medical Research Council (april 1994). „The health effects and regulation of passive smoking”. Australian Government Publishing Service. Архивирано из оригинала 29. 9. 2007. г. Приступљено 10. 8. 2007.
- ^ а б Taylor, R; Najafi F; Dobson A (2007). „Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent”. International Journal of Epidemiology. 36 (5): 1048—1059. PMID 17690135. doi:10.1093/ije/dym158.
- ^ „Frequently asked questions about second hand smoke”. World Health Organization. Архивирано из оригинала 01. 01. 2013. г. Приступљено 25. 7. 2012.
- ^ Schick, S; Glantz S (2005). „Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke”. Tobacco Control. 14 (6): 396—404. PMC 1748121
 . PMID 16319363. doi:10.1136/tc.2005.011288.
. PMID 16319363. doi:10.1136/tc.2005.011288.
- ^ Schmid K, Kuwert T, Drexler H (2010). „Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine”. Dtsch Arztebl Int. 107 (11): 181—6. PMC 2853156
 . PMID 20386676. doi:10.3238/arztebl.2010.0181.
. PMID 20386676. doi:10.3238/arztebl.2010.0181.
- ^ EPA (2006). „Radiation information: radon”. EPA. Приступљено 11. 8. 2007.
- ^ Davies, RJO; Lee YCG (2010). „18.19.3”. Oxford Textbook Medicine (5th изд.). Oxford: Oxford University Press. ISBN 978-0199204854.
- ^ Chen, H; Goldberg MS; Villeneuve PJ (2008). „A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases”. Reviews on Environmental Health. 23 (4): 243—297. PMID 19235364.
- ^ Clapp, RW; Jacobs MM; Loechler EL (2008). „Environmental and Occupational Causes of Cancer New Evidence, 2005–2007”. Reviews on Environmental Health. 23 (1): 1—37. PMC 2791455
 . PMID 18557596.
. PMID 18557596.
- ^ а б Lim, WY; Seow, A (јануар 2012). „Biomass fuels and lung cancer.”. Respirology (Carlton, Vic.). 17 (1): 20—31. PMID 22008241.
- ^ а б Sood, A (децембар 2012). „Indoor fuel exposure and the lung in both developing and developed countries: an update.”. Clinics in chest medicine. 33 (4): 649—65. PMID 23153607.
- ^ Dudley, Joel (2013). Exploring Personal Genomics. Oxford University Press. стр. 25—. ISBN 9780199644483.
- ^ Kern JA, McLennan G (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. стр. 1802. ISBN 978-0-07-145739-2.
- ^ Cogliano, VJ; Baan, R; et al. (2011. 12. 21). „Preventable exposures associated with human cancers.” (PDF). Journal of the National Cancer Institute. 103 (24): 1827—39. PMID 22158127. Архивирано из оригинала (PDF) 20. 09. 2012. г. Приступљено 08. 02. 2014. Проверите вредност парамет(а)ра за датум:
|date=(помоћ) - ^ Fong, KM; Sekido Y; et al. (2003). „Lung cancer • 9: Molecular biology of lung cancer: clinical implications”. Thorax. BMJ Publishing Group Ltd. 58 (10): 892—900. PMC 1746489
 . PMID 14514947. doi:10.1136/thorax.58.10.892.
. PMID 14514947. doi:10.1136/thorax.58.10.892.
- ^ Salgia, R; Skarin AT (1998). „Molecular abnormalities in lung cancer”. Journal of Clinical Oncology. 16 (3): 1207—1217. PMID 9508209.
- ^ а б в г Herbst, RS; Heymach JV; Lippman SM (2008). „Lung cancer”. New England Journal of Medicine. 359 (13): 1367—1380. PMID 18815398. doi:10.1056/NEJMra0802714. Архивирано из оригинала 28. 09. 2008. г. Приступљено 06. 07. 2013.
- ^ Aviel-Ronen, S; Blackhall FH; et al. (2006). „K-ras mutations in non-small-cell lung carcinoma: a review”. Clinical Lung Cancer. Cancer Information Group. 8 (1): 30—38. PMID 16870043. doi:10.3816/CLC.2006.n.030.
- ^ Devereux, TR; Taylor JA; Barrett JC (1996). „Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors”. Chest. American College of Chest Physicians. 109 (Suppl 3): 14S—19S. PMID 8598134. doi:10.1378/chest.109.3_Supplement.14S.
- ^ Miller, WT (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. стр. 486. ISBN 978-0-07-145739-2.
- ^ Kaiser, LR (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. ISBN 978-0-07-145739-2.
- ^ а б Maitra, A; Kumar V (2007). Robbins Basic Pathology (8th изд.). Saunders Elsevier. стр. 528—529. ISBN 978-1-4160-2973-1.
- ^ Subramanian, J; Govindan R (2007). „Lung cancer in never smokers: a review”. Journal of Clinical Oncology. American Society of Clinical Oncology. 25 (5): 561—570. PMID 17290066. doi:10.1200/JCO.2006.06.8015.
- ^ Raz, DJ; He B; et al. (2006). „Bronchioloalveolar carcinoma: a review”. Clinical Lung Cancer. 7 (5): 313—322. PMID 16640802. doi:10.3816/CLC.2006.n.012.
- ^ Rosti, G; Bevilacqua G; et al. (2006). „Small cell lung cancer”. Annals of Oncology. 17 (Suppl. 2): 5—10. PMID 16608983. doi:10.1093/annonc/mdj910.
- ^ Seo, JB; Im JG; et al. (1. 3. 2001). „Atypical pulmonary metastases: spectrum of radiologic findings”. Radiographics. 21 (2): 403—417. PMID 11259704.
- ^ Tan D, Zander DS (2008). „Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update”. Int J Clin Exp Pathol. 1 (1): 19—31. PMC 2480532
 . PMID 18784820.
. PMID 18784820.
- ^ а б в Rami-Porta, R; Crowley JJ; Goldstraw P (2009). „The revised TNM staging system for lung cancer” (PDF). Annals of Thoracic and Cardiovascular Surgery. 15 (1): 4—9. PMID 19262443.
- ^ Goodman, GE (2002). „Lung cancer. 1: prevention of lung cancer” (PDF). Thorax. 57 (11): 994—999. PMC 1746232
 . PMID 12403886.
. PMID 12403886.
- ^ McNabola, A; Gill LW (2009). „The control of environmental tobacco smoke: a policy review”. International Journal of Environmental Research and Public Health. 6 (2): 741—758. PMC 2672352
 . PMID 19440413. doi:10.3390/ijerph6020741.
. PMID 19440413. doi:10.3390/ijerph6020741.
- ^ Pandey, G (2005). „Bhutan's smokers face public ban”. BBC. Приступљено 7. 9. 2007.
- ^ Pandey, G (2. 10. 2008). „Indian ban on smoking in public”. BBC. Приступљено 25. 4. 2012.
- ^ „UN health agency calls for total ban on tobacco advertising to protect young” (Саопштење). United Nations News service. 30. 5. 2008.
- ^ а б в Fabricius, P; Lange P (July—September 2003). „Diet and lung cancer”. Monaldi Archives for Chest Disease. 59 (3): 207—211. PMID 15065316. Проверите вредност парамет(а)ра за датум:
|date=(помоћ) - ^ Fritz, H; Kennedy D; et al. (2011). „Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis”. PLoS ONE. 6 (6): e21107. PMC 3124481
 . PMID 21738614. doi:10.1371/journal.pone.0021107.
. PMID 21738614. doi:10.1371/journal.pone.0021107.
- ^ Herr, C; Greulich T; et al. (mart 2011). „The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer”. Respiratory Research. 12 (1): 31. PMC 3071319
 . PMID 21418564. doi:10.1186/1465-9921-12-31.
. PMID 21418564. doi:10.1186/1465-9921-12-31.
- ^ а б Key, TJ (januar 2011). „Fruit and vegetables and cancer risk”. British Journal of Cancer. 104 (1): 6—11. PMC 3039795
 . PMID 21119663. doi:10.1038/sj.bjc.6606032.
. PMID 21119663. doi:10.1038/sj.bjc.6606032.
- ^ Manser, RL; Irving LB; et al. (2004). „Screening for lung cancer”. Cochrane Database of Systematic Reviews (1): CD001991. PMID 14973979. doi:10.1002/14651858.CD001991.pub2.
- ^ Jaklitsch, MT; Jacobson FL; et al. (jul 2012). „The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups”. Journal of Thoracic and Cardiovascular Surgery. 144 (1): 33—38. PMID 22710039. doi:10.1016/j.jtcvs.2012.05.060.
- ^ Bach, PB; Mirkin JN; et al. (jun 2012). „Benefits and harms of CT screening for lung cancer: a systematic review”. JAMA: the Journal of the American Medical Association. 307 (22): 2418—2429. PMID 22610500. doi:10.1001/jama.2012.5521.
- ^ Boiselle, PM (20. 3. 2013). „Computed tomography screening for lung cancer.”. JAMA: the Journal of the American Medical Association. 309 (11): 1163—70. PMID 23512063. doi:10.1001/jama.2012.216988.
- ^ Bach PB; Mirkin JN; Oliver TK; et al. (jun 2012). „Benefits and harms of CT screening for lung cancer: a systematic review”. JAMA. 307 (22): 2418—29. PMID 22610500. doi:10.1001/jama.2012.5521.
- ^ Aberle, DR; Abtin, F; Brown, K (10. 3. 2013). „Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial.”. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 31 (8): 1002—8. PMID 23401434. doi:10.1200/JCO.2012.43.3110.
- ^ Ferrell, B; Koczywas M; et al. (april 2011). „Palliative care in lung cancer”. Surgical Clinics of North America. 91 (2): 403—417. PMID 21419260. doi:10.1016/j.suc.2010.12.003.
- ^ Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. ISBN 978-0-07-145739-2.
- ^ а б Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. ISBN 978-0-07-145739-2.
- ^ Odell, DD; Kent MS; Fernando HC (proleće 2010). „Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer”. Seminars in Thoracic and Cardiovascular Surgery. 22 (1): 32—37. PMID 20813314. doi:10.1053/j.semtcvs.2010.04.003.
- ^ Alam, N; Flores RM (July—September 2007). „Video-assisted thoracic surgery (VATS) lobectomy: the evidence base”. Journal of the Society of Laparoendoscopic Surgeons. 11 (3): 368—374. PMC 3015831
 . PMID 17931521. Проверите вредност парамет(а)ра за датум:
. PMID 17931521. Проверите вредност парамет(а)ра за датум: |date=(помоћ) - ^ Rueth, NM; Andrade RS (jun 2010). „Is VATS lobectomy better: perioperatively, biologically and oncologically?”. Annals of Thoracic Surgery. 89 (6): S2107—S2111. PMID 20493991. doi:10.1016/j.athoracsur.2010.03.020.
- ^ Simon GR, Turrisi A (septembar 2007). „Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)”. Chest. 132 (3 Suppl): 324S—339S. PMID 17873178. doi:10.1378/chest.07-1385.
- ^ Goldstein, SD; Yang SC (oktobar 2011). „Role of surgery in small cell lung cancer”. Surgical Oncology Clinics of North America. 20 (4): 769—777. PMID 21986271. doi:10.1016/j.soc.2011.08.001.
- ^ Arriagada, R; Goldstraw P; Le Chevalier T (2002). Oxford Textbook of Oncology (2nd изд.). Oxford University Press. стр. 2094. ISBN 978-0-19-262926-5.
- ^ Hatton, MQ; Martin JE (jun 2010). „Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions”. Clinical Oncology (Royal College of Radiologists). 22 (5): 356—364. PMID 20399629. doi:10.1016/j.clon.2010.03.010.
- ^ PORT Meta-analysis Trialists Group (2005). Rydzewska, Larysa, ур. „Postoperative radiotherapy for non-small cell lung cancer”. Cochrane Database of Systematic Reviews (2): CD002142. PMID 15846628. doi:10.1002/14651858.CD002142.pub2. Архивирано из оригинала 9. 2. 2010. г. Приступљено 6. 7. 2013.
- ^ Le Péchoux, C (2011). „Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data”. Oncologist. 16 (5): 672—681. PMC 3228187
 . PMID 21378080. doi:10.1634/theoncologist.2010-0150.
. PMID 21378080. doi:10.1634/theoncologist.2010-0150.
- ^ Cardona, AF; Reveiz L; et al. (april 2008). „Palliative endobronchial brachytherapy for non-small cell lung cancer”. Cochrane Database of Systematic Reviews (2): CD004284. PMID 18425900. doi:10.1002/14651858.CD004284.pub2.
- ^ Ikushima, H (februar 2010). „Radiation therapy: state of the art and the future”. Journal of Medical Investigation. 57 (1–2): 1—11. PMID 20299738.
- ^ Paumier, A; Cuenca X; et al. (jun 2011). „Prophylactic cranial irradiation in lung cancer”. Cancer Treatment Reviews. 37 (4): 261—265. PMID 20934256. doi:10.1016/j.ctrv.2010.08.009.
- ^ Girard, N; Mornex F (oktobar 2011). „Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update”. Cancer Radiothérapie. 15 (6–7): 522—526. PMID 21889901. doi:10.1016/j.canrad.2011.07.241.
- ^ Fairchild, A; Harris K; et al. (avgust 2008). „Palliative thoracic radiotherapy for lung cancer: a systematic review”. Journal of Clinical Oncology. 26 (24): 4001—4011. PMID 18711191. doi:10.1200/JCO.2007.15.3312.
- ^ Hann CL, Rudin CM (30. 11. 2008). „Management of small-cell lung cancer: incremental changes but hope for the future”. Oncology (Williston Park). 22 (13): 1486—92. PMID 19133604.
- ^ Murray, N; Turrisi AT (2006). „A review of first-line treatment for small-cell lung cancer”. Journal of Thoracic Oncology. 1 (3): 270—278. PMID 17409868.
- ^ Azim, HA; Ganti AK (2007). „Treatment options for relapsed small-cell lung cancer”. Anticancer drugs. 18 (3): 255—261. PMID 17264756. doi:10.1097/CAD.0b013e328011a547.
- ^ MacCallum, C; Gillenwater HH (2006). „Second-line treatment of small-cell lung cancer”. Current Oncology Reports. 8 (4): 258—264. PMID 17254525. doi:10.1007/s11912-006-0030-8.
- ^ а б NSCLC Meta-Analyses Collaborative Group (2008). „Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials”. J. Clin. Oncol. 26 (28): 4617—25. PMC 2653127
 . PMID 18678835. doi:10.1200/JCO.2008.17.7162.
. PMID 18678835. doi:10.1200/JCO.2008.17.7162.
- ^ Mehra R, Treat J (2008). Fishman's Pulmonary Diseases and Disorders (4th изд.). McGraw-Hill. стр. 1876. ISBN 978-0-07-145739-2.
- ^ а б Clegg, A; Scott DA; et al. (2002). „Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review”. Thorax. BMJ Publishing Group. 57 (1): 20—28. PMC 1746188
 . PMID 11809985. doi:10.1136/thorax.57.1.20.
. PMID 11809985. doi:10.1136/thorax.57.1.20.
- ^ Fuld AD, Dragnev KH, Rigas JR (jun 2010). „Pemetrexed in advanced non-small-cell lung cancer”. Expert Opin Pharmacother. 11 (8): 1387—402. PMID 20446853. doi:10.1517/14656566.2010.482560.
- ^ Carbone, DP; Felip E (2011). „Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms”. Clinical Lung Cancer. 12 (5): 261—271. PMID 21831720. doi:10.1016/j.cllc.2011.06.002.
- ^ а б Le Chevalier, T (2010). „Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?”. Annals of Oncology. 21 (Suppl. 7): vii196—198. PMID 20943614. doi:10.1093/annonc/mdq376.
- ^ Horn, L; Sandler AB; et al. (2007). „The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer”. Journal of Thoracic Oncology. 2 (5): 377—383. PMID 17473651. doi:10.1097/01.JTO.0000268669.64625.bb.
- ^ Wakelee, HA; Schiller JH; Gandara DR (2006). „Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial”. Clinical Lung Cancer. Cancer Information Group. 8 (1): 18—21. PMID 16870041. doi:10.3816/CLC.2006.n.028.
- ^ British Medical Journal (2005). Clinical evidence concise : the international resource of the best available evidence for effective health care. London: BMJ Publishing Group. стр. 486-488. ISBN 978-1-905545-00-1. ISSN 1475-9225.
- ^ Kelley AS, Meier DE (2010). „Palliative care–a shifting paradigm”. New England Journal of Medicine. 363 (8): 781—2. PMID 20818881. doi:10.1056/NEJMe1004139.
- ^ а б Prince-Paul M (2009). „When hospice is the best option: an opportunity to redefine goals”. Oncology (Williston Park, N.Y.). 23 (4 Suppl Nurse Ed): 13—7. PMID 19856592.
- ^ Souquet PJ, Chauvin F, Boissel JP, Bernard JP (1995). „Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer”. Lung Cancer. 12 Suppl 1: S147—54. PMID 7551923. doi:10.1016/0169-5002(95)00430-9.
- ^ Sörenson S, Glimelius B, Nygren P (2001). „A systematic overview of chemotherapy effects in non-small cell lung cancer”. Acta Oncol. 40 (2–3): 327—39. PMID 11441939.
- ^ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (2001). „A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer”. Health Technol Assess. 5 (32): 1—195. PMID 12065068.
- ^ Non-Small Cell Lung Cancer Collaborative Group (2010). Burdett, Sarah, ур. „Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer”. 2 (5). PMID 20464750.
- ^ „Non-Small Cell Lung Cancer Treatment”. PDQ for Health Professionals. National Cancer Institute. Приступљено 22. 11. 2008.
- ^ „Small Cell Lung Cancer Treatment”. PDQ for Health Professionals. National Cancer Institute. 2012. Приступљено 16. 5. 2012.
- ^ Spiro, SG (2010). „18.19.1”. Oxford Textbook Medicine (5th изд.). Oxford: Oxford University Press. ISBN 978-0199204854.
- ^ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ^ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ^ Slatore, CG; Au DH; Gould MK (novembar 2010). „An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes”. American Journal of Respiratory and Critical Care Medicine. 182 (9): 1195—1205. PMID 21041563. doi:10.1164/rccm.2009-038ST.
- ^ „WHO Disease and injury country estimates”. World Health Organization. 2009. Приступљено 11. 11. 2009.
- ^ Ferlay, J; Shin HR; et al. (decembar 2010). „Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008”. International Journal of Cancer. 127 (12): 2893—2917. PMID 21351269. doi:10.1002/ijc.25516.
- ^ Jemal A; Tiwari RC; Murray T; et al. (2004). „Cancer statistics, 2004”. CA: a Cancer Journal for Clinicians. 54 (1): 8—29. PMID 14974761. doi:10.3322/canjclin.54.1.8.
- ^ Proctor, RN (2012). „The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll”. Tobacco Control. 21 (2): 87—91. PMID 22345227. doi:10.1136/tobaccocontrol-2011-050338.
- ^ Lum, KL; Polansky JR; et al. (2008). „Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951”. Tobacco Control. 17 (5): 313—323. PMC 2602591
 . PMID 18818225. doi:10.1136/tc.2008.025445.
. PMID 18818225. doi:10.1136/tc.2008.025445.
- ^ Lovato, C; Watts A; Stead LF (oktobar 2011). „Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours”. Cochrane Database of Systematic Reviews (10): CD003439. PMID 21975739. doi:10.1002/14651858.CD003439.pub2.
- ^ Kemp, FB (2009). „Smoke free policies in Europe. An overview”. Pneumologia. 58 (3): 155—158. PMID 19817310.
- ^ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010 [1]
- ^ „Gender in lung cancer and smoking research” (PDF). World Health Organization. 2004. Приступљено 26. 5. 2007.
- ^ Zhang, J; Ou JX; Bai CX (novembar 2011). „Tobacco smoking in China: prevalence, disease burden, challenges and future strategies”. Respirology. 16 (8): 1165—1172. PMID 21910781. doi:10.1111/j.1440-1843.2011.02062.x.
- ^ Behera, D; Balamugesh T (2004). „Lung cancer in India” (PDF). Indian Journal of Chest Diseases and Allied Sciences. 46 (4): 269—281. PMID 15515828. Архивирано из оригинала (PDF) 17. 12. 2008. г. Приступљено 06. 07. 2013.
- ^ Charloux, A; Quoix E; et al. (1997). „The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma”. International Journal of Epidemiology. 26 (1): 14—23. PMID 9126499. doi:10.1093/ije/26.1.14.
- ^ Kadara, H; Kabbout M; Wistuba II (2012). „Pulmonary adenocarcinoma: a renewed entity in 2011”. Respirology. 17 (1): 50—65. PMID 22040022. doi:10.1111/j.1440-1843.2011.02095.x.
- ^ Morgagni, Giovanni Battista (1761). De sedibus et causis morborum per anatomen indagatis.
- ^ Bayle, Gaspard-Laurent (1810). Recherches sur la phthisie pulmonaire (на језику: French). Paris.
- ^ а б Witschi, H (2001). „A short history of lung cancer”. Toxicological Sciences. 64 (1): 4—6. PMID 11606795. doi:10.1093/toxsci/64.1.4.
- ^ Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. OCLC 14783544., navedeno u Spiro SG, Silvestri GA (2005). „One hundred years of lung cancer”. American Journal of Respiratory and Critical Care Medicine. 172 (5): 523—529. PMID 15961694. doi:10.1164/rccm.200504-531OE.
- ^ Grannis, FW. „History of cigarette smoking and lung cancer”. smokinglungs.com. Архивирано из оригинала 18. 7. 2007. г. Приступљено 6. 8. 2007.
- ^ Proctor, R (2000). The Nazi War on Cancer. Princeton University Press. стр. 173—246. ISBN 978-0-691-00196-8.
- ^ Doll, R; Hill AB (1956). „Lung Cancer and Other Causes of Death in Relation to Smoking”. British Medical Journal. 2 (5001): 1071—1081. PMC 2035864
 . PMID 13364389. doi:10.1136/bmj.2.5001.1071.
. PMID 13364389. doi:10.1136/bmj.2.5001.1071.
- ^ US Department of Health Education and Welfare (1964). „Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service” (PDF). Washington, DC: US Government Printing Office.
- ^ а б Greaves, M (2000). Cancer: the Evolutionary Legacy. Oxford University Press. стр. 196—197. ISBN 978-0-19-262835-0.
- ^ Greenberg, M; Selikoff IJ (1993). „Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879”. Annals of Occupational Hygiene. 37 (1): 5—14. PMID 8460878.
- ^ Samet, JM (2011). „Radiation and cancer risk: a continuing challenge for epidemiologists”. Environmental Health. 10 (Suppl. 1): S4. PMC 3073196
 . PMID 21489214. doi:10.1186/1476-069X-10-S1-S4.
. PMID 21489214. doi:10.1186/1476-069X-10-S1-S4.
- ^ Horn, L; Johnson DH (2008). „Evarts A. Graham and the first pneumonectomy for lung cancer”. Journal of Clinical Oncology. 26 (19): 3268—3275. PMID 18591561. doi:10.1200/JCO.2008.16.8260. Архивирано из оригинала 17. 03. 2020. г. Приступљено 06. 07. 2013.
- ^ Edwards, AT (1946). „Carcinoma of the Bronchus”. Thorax. 1 (1): 1—25. PMC 1018207
 . PMID 20986395. doi:10.1136/thx.1.1.1.
. PMID 20986395. doi:10.1136/thx.1.1.1.
- ^ Kabela, M (1956). „Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses” [Experience with radical irradiation of bronchial cancer]. Ceskoslovenská Onkológia (на језику: German). 3 (2): 109—115. PMID 13383622.
- ^ Saunders, M; Dische S; et al. (1997). „Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial”. Lancet. Elsevier. 350 (9072): 161—165. PMID 9250182. doi:10.1016/S0140-6736(97)06305-8.
- ^ Lennox, SC; Flavell G; et al. (1968). „Results of resection for oat-cell carcinoma of the lung”. Lancet. Elsevier. 2 (7575): 925—927. PMID 4176258. doi:10.1016/S0140-6736(68)91163-X.
- ^ Miller, AB; Fox W; Tall R (1969). „Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus”. Lancet. Elsevier. 2 (7619): 501—505. PMID 4184834. doi:10.1016/S0140-6736(69)90212-8.
- ^ Cohen, M; Creaven PJ; et al. (1977). „Intensive chemotherapy of small cell bronchogenic carcinoma”. Cancer Treatment Reports. 61 (3): 349—354. PMID 194691.
Spoljašnje veze
[уреди | уреди извор] | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |
