Растворљивост

Растворљивост је особина супстанце која се може растворити у одређеном растварачу под одређеним условима. Интеракција између молекула растварача и супстанце која се раствара назива се солватација (ако је растварач вода - хидратација).[1][2]
Растворљивост супстанце се објашњава помоћу поларности. Код растварања важи емпиријско правило: Слично се раствара у сличном. Поларне супстанце (нпр. HCl) и јонска једињења се добро растварају у поларним растварачима (нпр. вода), а неполарне у неполарним. Пример може бити растварање јода (неполарна супстанца) у хлороформу (CHCl3, неполарни органски растварач). Обично се за пример растварања неполарних супстанци узима растворљивост органских једињења у органским растварачима. Код растворљивости важну улогу има и водонична веза.
Раствор који се налази у равнотежи и не може растворити више супстанце назива се засићени раствор. За тешко растворљиве супстанце растворљивост се може процијенити на основу вриједности производа растворљивости.
Многи елементи су растворљиви (у различитим количинама) али има и оних који уопште немају ову особину. Такви су, на пример, племенити метали (платина, злато, сребро, ...)
IUPAC дефиниција
[уреди | уреди извор]Према IUPAC дефиницији,[3] растворљивост је аналитички састав засићеног раствора изражен као удео дате растворене супстанце у назначеном растварачу. Растворљивост се може навести у различитим јединицама концентрације, као што су моларност, молалност, моларна фракција, молски однос, маса (растворка) по запремини (растварача) и другим јединицама.
Квалификације се користе за описивање степена растворљивости
[уреди | уреди извор]Степен растворљивости је у широком опсегу, од бескрајно растворљивог (без ограничења) (мешљивог[4]) као што је етанол у води, до слабо растворљивог, као што је сребро хлорид у води. Термин нерастворљив често се примењује на слабо или врло слабо растворљива једињења. Бројни други описни изрази се такође користе да би се квалификовао степен растворљивости за дату апликацију. На пример, У.С. Фармакопеја даје следеће изразе:
| Појам | Масни делови растварача потребни за растварање 1 масеног дела растворка[5] |
|---|---|
| Веома растворљив | <1 |
| Слободно растворљив | 1 до 10 |
| Растворљив | 10 до 30 |
| Слабо растворљив | 30 до 100 |
| Мало растворљив | 100 до 1000 |
| Веома мало растворљив | 1000 до 10.000 |
| Практично нерастворљив или нерастворљив | ≥ 10.000 |
Прагови за описивање нечега као нерастворљивог, или слични термини, могу зависити од примене. На пример, један извор наводи да су супстанце описане као „нерастворљиве“ када је њихова растворљивост мања од 0,1 г на 100 мл растварача.[6]
Молекуларно гледиште
[уреди | уреди извор]Растворљивост се јавља у динамичкој равнотежи, што значи да је растворљивост резултат симултаних и супротстављених процеса растварања и фазног спајања (нпр. таложење чврстих материја). Равнотежа растворљивости настаје када се два процеса одвијају константном брзином.
Термин растворљивост се такође користи у неким пољима где је растворена супстанца промењена солволизом. На пример, за многе метале и њихове оксиде се каже да су „растворљиви у хлороводоничној киселини“, иако у ствари водена киселина неповратно разграђује чврсту супстанцу дајући растворљиве производе. Тачно је и да се већина јонских чврстих материја раствара поларним растварачима, али такви процеси су реверзибилни. У оним случајевима у којима се растворена супстанца не регенерише испаравањем растварача, поступак се назива солволиза. Термодинамички концепт растворљивости се не примењује директно на солволизу.
Када се растворак раствори, он може да формира неколико форми у раствору. На пример, водена суспензија железовог хидроксида, Fe(OH)
2, садржаће серију [Fe(H
2O)x(OH)x](2x)+ као и друге врсте. Даље, растворљивост железовог хидроксида и композиција његових растворљивих компоненти зависе од pH. Генерално, растворљивост у фази растварача може се дати само за одређену растворену супстанцу која је термодинамички стабилна, а вредност растворљивости ће обухватити све облике у раствору (у примеру изнад, све комплексе који садрже гвожђе).
Фактори растворљивости
[уреди | уреди извор]
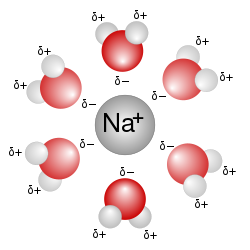
Растворљивост материје зависи од међумолекулских сила између растварача и растворка, односно енергетским променама током растварања.
Треба разликовати два дела процеса растварања. Први део процеса растварања је енергија потребна да се чврста материја дисоцира, односно да се материја раздвоји на слободне јоне (јонске материје) или слободне молекуле (ковалентне материје). Тај део процеса растварања тражи улагање енергије, он је ендотерман, јер је потребно разбити одређену кристалну структуру чврсте материје која се раствара. Други део процеса растварања је енергија која се ослобађа, јер код слободних јонских честица долази до хидратације, везивања с молекулама воде (јон-дипол веза), односно код слободних молекула долази до солватације, везивања с молекулама неког неполарног растварача (веза индуковани дипол-индуковани дипол). Тај други део процеса растварања ослобађа енергију, јер су хидратација и солватација егзотермни процеси. Ултиматно је процес растварања ендотерман, ако је енергија дисоцијације већа од енергије хидратације, односно процес растварања је егзотерман ако је енергија дисоцијације мања од енергије хидратације. Слично вреди за ковалентне материје које се добро растварају у неполарним растварачима и где је хидратација замењена солватацијом.[7]
Утицај поларности растварача на растворљивост неке материје најчешће се описује правилом према којем се слично раствара сличним, што значи да ће се поларне материје најбоље растварати у поларним растварачима, а неполарне у неполарнима, иако то правило није увек применљиво. Температура и притисак утичу на равнотежу растварања. С порастом температуре растворљивост чврстих материја најчешће се повећава, док гасови постају слабије растворни у води, али боље растворни у органским растварачима. Растворљивост плинова пропорционална је притиску плина (Хенријев закон). Брзина растварања зависи од величине честица, јер се растварање збива само на површини честице, те се мање честице растварају брже, јер имају већу специфичну површину. Брзина растварања такође зависи од мешања (које убрзава растварање), количине већ растворене материје (приближавањем концентрације максималној растворљивости растварање се успорава) и температуре, која уз повећање максималне растворљивости повећава и брзину растварања.[8]
Зависност растворљивости од температуре
[уреди | уреди извор]
Растворљивост датог растворка у датом растварачу је функција температуре. У зависности од промене Гибсове слободне енергије (ΔG) реакције растварања, тј. од ендотермног (ΔG > 0) или егзотермног (ΔG < 0) карактера реакције растварања, растворљивост датог једињења може се повећати или смањити са температуром. Вант Хофова једначина се односи на промену константе равнотеже растворљивости (Ksp) са променом температуре и променом енталпије реакције (ΔH). За већину чврстих тела и течности њихова растворљивост расте са температуром, јер је њихова реакција растварања ендотермна (ΔG > 0).[9] У течној води на високим температурама (нпр. оној која се приближава критичној температури) растворљивост јонских растворака има тенденцију смањења услед промене својстава и структуре течне воде; нижа диелектрична константа резултира мање поларним растварачем и променом енергије хидратације која утиче на ΔG реакције растварања.
Гасовите растворене материје показују сложеније понашање са температуром. Како се температура подиже, гасови обично постају мање растворљиви у води (реакција егзотермног растварања повезана са њиховом хидратацијом) (до минимума, што је испод 120 °C за већину перманентних гасова[10]), али су растворљивији у органским растварачима (реакција ендотермног растварања повезана са њиховом солватацијом).[9]
Графикон приказује криве растворљивости за неке типичне чврсте неорганске соли (температура је у степени Целзијуса, тј. Келвини минус 273,15).[11] Многе соли се понашају као баријум нитрат и динатријум хидроген арсенат и показују велико повећање растворљивости са температуром (ΔG > 0). Неки растворци (нпр. натријум хлорид у води) показују растворљивост која је прилично независна од температуре (ΔG ≈ 0). Неколико њих, попут калцијум сулфата (гипса) и церијум(III) сулфата, постају мање растворљиви у води како температура расте (ΔG < 0).[12] То је случај и са калцијум хидроксидом (портландит), чија је растворљивост на 70 °C око половине његове вредности на 25 °C. Растварање калцијум-хидроксида у води је такође егзотермни процес (ΔG < 0) и следи вант Хофову једначину и Ле Шатељеов принцип. Снижавање температуре фаворизује уклањање топлоте од растварања из система и на тај начин фаворизује растварање Ca(OH)2: те се растворљивост портландита повећава на ниским температурама. Ова зависност од температуре се понекад назива „ретроградном“ или „инверзном“ растворљивости. Повремено се примећује сложенији образац, као код натријум сулфата, где мање растворљиви кристали декахидрата (мирабилит) губе кристализациону воду на 32 °C да би створили растворљивију безводну фазу (тенардит), због промене Гибсове слободне енергије (ΔG) реакције растварања.
Растворљивост органских једињења готово се увек повећава са температуром. Техника рекристализације која се користи за пречишћавање чврстих супстанци зависи од различитих растворљивости растворених супстанци у топлом и хладном растварачу. Постоји неколико изузетака, попут одређених циклодекстрина.[13]
Подела материја и раствора према растворљивости
[уреди | уреди извор]Материје се растварањем могу међусобно мешати у свим односима (на пример етанол и вода), у ограниченим односима или у занемаривим односима, када се сматрају нерастворним. Раствор који садржи максималну равнотежну количину растворка при датим условима назива се засићеним раствором. При одређеним условима количина растворене материје може бити нешто већа од равнотежне, а настали метастабилни раствор назива се презасићеним.
Постоје и чврсти раствори, хомогене смесе чврстих материја (нпр. легуре, стакло). Количина растворене материје се најчешће изражава као моларна или масена концентрација, или пак као моларни или масени удео растворка у растварачу.
Растворљивост у води према врсти хемијске везе
[уреди | уреди извор]
Способност супстанце да се раствара у води градећи хомогену смешу назива се хидратација.
| Врста везе | Растворљивост супстанце у води | Пример |
|---|---|---|
| јонска | углавном растворљиве | види испод |
| метална | нераствориве | Fe |
| осим ако реагују са водом | K | |
| поларна ковалентна | растворљиве ако граде водоничну везу | глукоза |
| растворљиве ако реагују са водом | HCl | |
| иначе нерастворљиве | етер | |
| неполарна ковалентна | углавном нерастворљиве | бензен |
| неке слабо растворљиве | O2 | |
| ковалентна у кристалу | нeрастворљиве | дијамант |
Растворљивост јонских једињења у води
[уреди | уреди извор]| Растворљиве соли | Нерастворљиве соли |
|---|---|
| све соли алкалних метала и NH4+ | карбонати (осим алкалних метала и NH4+) |
| нитрати | sulfiti (осим алкалних метала и NH4+) |
| ацетати | fosfati (осим алкалних метала и NH4+) |
| хлориди, бромиди и јодиди (осим Ag+, Pb2+, Cu+ и Hg22+) | хидроксиди и оксиди (осим алкалних метала, NH4+, Ba2+, Sr2+, Ca2+ i Tl+) |
| сулфати (осим Ag+, Pb2+, Ba2+, Sr2+ i Ca2+) | сулфиди (осим алкалних и земноалкалних метала те NH4+) |
Растворљивост материје у растварачима
[уреди | уреди извор]Вода је уобичајено али истовремено врло особен растварач. Молекули воде су диполи међу којима делује водонична веза те је вода најполарнији растварач. Неки други растварачи су такође поларни (алкохоли), слабо поларни (етри) или неполарни (угљоводоници). У води се зато добро растварају поларне односно јонске материје, грађене од наелектрисаних честица јона, а то су разне соли, киселине, хидроксиди, док се неполарне материје (јод, сумпор) не растварају или не мешају (угљеноводоници, уља). Обрнуто у неполарним или слабо поларним растварачима (угљоводоници, етри) слабо се растварају јонске материје, а добро се растварају неполарне ковалентне материје (уља, масти). Зато је постављено „златно правило” растварања:
„Слично се раствара у сличном!”[7]
Такође вреди генерално: растворљивост чврстих материја расте с порастом температуре растварача, док растворљивост гасова опада.
Референце
[уреди | уреди извор]- ^ Clugston M. and Fleming R. (2000). Advanced Chemistry (1st изд.). Oxford: Oxford Publishing. стр. 108.
- ^ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 978-0-9678550-9-7. Gold, Victor, ур. (2019). „The IUPAC Compendium of Chemical Terminology”. doi:10.1351/goldbook..
- ^ IUPAC. „Solubility”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clugston, M.; Fleming, R. (2000). Advanced Chemistry (1st изд.). Oxford: Oxford Publishing. стр. 108.
- ^ "Pharmacopeia of the United States of America, 32nd revision, and the National Formulary, 27th edition," 2009, pp. 1 to 12.
- ^ Rogers, Elizabeth; Stovall, Iris (2000). „Fundamentals of Chemistry: Solubility”. Department of Chemistry. University of Wisconsin. Архивирано из оригинала 13. 4. 2015. г. Приступљено 22. 4. 2015.
- ^ а б Habuš, Strićević, Liber: Opća kemija 2, Udžbenik kemije, 2. izd., Profil, Zagreb, 2008., ISBN 978-953-12-0390-6, str.30-42
- ^ [1] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija: Topljivost
- ^ а б John W. Hill, Ralph H. Petrucci, General Chemistry, 2nd edition, Prentice Hall, 1999.
- ^ P. Cohen, ур. (1989). The ASME Handbook on Water Technology for Thermal Power Systems. The American Society of Mechanical Engineers. стр. 442.
- ^ Handbook of Chemistry and Physics (27th изд.). Cleveland, Ohio: Chemical Rubber Publishing Co. 1943.
- ^ „What substances, such as cerium sulfate, have a lower solubility when they are heated?”. Приступљено 28. 5. 2014.
- ^ Salvatore Filippone, Frank Heimanna and André Rassat (2002). „A highly water-soluble 2+1 b-cyclodextrin–fullerene conjugate”. Chem. Commun. 2002 (14): 1508—1509. doi:10.1039/b202410a.
Литература
[уреди | уреди извор]- Clugston M. and Fleming R. (2000). Advanced Chemistry (1st изд.). Oxford: Oxford Publishing. стр. 108.
