Метод радиоактивног угљеника
Метод радиоактивног угљеника (енгл. radioactive carbon method)[н. 1] метод је који се користи приликом одређивања старости органских твари на темељу омјера броја атома стабилног угљениковог изотопа 12C и радиоактивног изотопа 14C.
Изотоп 14C настаје у високим слојевима Земљине атмосфере, деловањем космичких зрака на азот (14N). Он се, везан у угљеник(IV)-оксид (CO2), шири брзо и равномерно целом биосфером. Његова се количина у атмосфери није мењала кроз дуго временско раздобље; заправо, била је константна све до 1950-их, када је тестирањем термонуклеарног оружја у великим количинама био произведен и распршен у спољну средину. Из атмосфере, 14C прелази директно у биљке и индиректно, преко ланца исхране, у друге живе организме. Због тога је у живим бићима омер 12C и 14C константан. Када се смрћу прекине измена твари између организма и атмосфере, радиоактивни распад се не зауставља и органска твар почиње да губи 14C. Одређивањем преосталог 14C у неком узорку неживе твари може се израчунати колико је времена прошло од тренутка смрти.
Време полураспада угљеника 14C износи око 5.730 година. Установи ли се, на пример, да неки комад дрвета или дрвеног угљена садржи упола мање угљеника 14C него живо стабло, закључује се да је тај комад дрвета или угљена стар око 5.730 година; ако садржи само четвртину количине 14C коју је имао док је дрво било живо, стар је око 11.460 година и сл.
Гајгер-Милеровим бројачем могу се одредити и екстремно мале количине тог изотопа. У живом дрвету, од једног билиона атома угљеника само је један радиоактиван, а у једном граму свежег узорка угљеника деси се приближно 13,5 распада у минути.
Данас се овом методом може одредити старост органских твари: пергамента, одеће, фосила, људских и животињских костију и др., од 500 до 50.000 година уназад. Поступак се примењује у археологији, антропологији, геологији, геофизици итд.[1]
Датирање угљеником-14 развио је Вилард Либи 1949. године као професор на Универзитету у Чикагу. За то је добио Нобелову награду за хемију 1960. године.[2][3]
Физичке основе
[уреди | уреди извор]У природи, угљеник се може наћи у облику два стабилна, нерадиоактивна изотопа. Први је угљеник-12 (12
C) са заступљеношћу од ≈ 99%, а други угљеник-13 (13
C) са заступљеношћу од ≈ 1%. Угљеник се може наћи и као један нестабилан, радиоактивни изотоп. Реч је о угљенику-14 (14
C), којег има само у траговима (1 део на 1×1012 делова или 0,000 000 000 1%), такође познатом и као „радиоугљеник”. Полуживот за 14
C (време које је потребно да се половина дате количине 14
C распадне, време полураспада) износи (5.730 ± 40) година, тако да може да се очекује да ће концентрација овог изотопа у следећих неколико хиљада година да опадне. Распада се у азот-14 преко бета распада. Активност је око 14 распада у минути по граму угљеника-14.
Међутим, 14
C се константно производи у доњим слојевима стратосфере и горњим слојевима тропосфере, на висинама 9 km до 15 km изнад површине Земље, и то због космичког зрачења. Наиме, угљеник-14 оксидира у 14CO2 и распоређује се по целој атмосфери. Омер концентрација изотопа угљика 12C : 13C : 14C износи 1012 : 1010 : 1. Од ових изотопа, једино је угљеник-14 радиоактиван, па се његове нуклиде распадају према реакцији приказаној испод. Дакле, настају неутрони који при погађању атома азота-14 (14
N) успут стварају и изотоп угљеника 14
C.[4] Следећом нуклеарном реакцијом настаје изотоп 14
C:
где представља неутрон, а представља протон.[5]
Када се произведе овим путем, 14
C се веома брзо спаја са кисеоником из атмосфере да би настао угљен-диоксид (CO
2). Угљен-диоксид који је настао на овај начин дифузира се у атмосфери, раствара уокеану, а биљке га примају преко процеса фотосинтезе. Животиње једу биљке, а на крају се пратећи ланац исхране радиоугљеник дистрибуише кроз целу биосферу. Однос 14
C наспрам 12
C је око 1,5 делова 14
C на 1012 делова 12
C.[6] Додатно, око 1% атома угљеника потиче од стабилног изотопа 13
C.[4]
Једначина радиоактивног распада 14
C је:[7]
Емитујући једну бета честицу (електрон, ) и један електронски антинеутрино (), један од неутрона у језгру 14
C мења се у протон и језгро 14
C се претвара назад у стабилни (нерадиоактивни) изотоп 14
N.[8]
Фактори који утичу на тачност прорачуна старости узорка
[уреди | уреди извор]Стабилни атом азота-14 је створен, електрон и антинеутрино. Неколико фактора утиче на тачност:
- процес изотопне измене тј. фракционисање угљеникових атома
- варијације концентрације угљеника-14 у атмосфери у прошлости
- контаминација/загађивање узорака савременим или старим угљеником-14
Изотопско фракционисање
[уреди | уреди извор]| Материјал | Типични интервал (≈) за δ13 C |
|---|---|
| PDB | 0 ‰ * |
| Морски планктон | [−22 ‰, −17 ‰][9] |
| C3 биљке | [−30 ‰, −22 ‰][9] |
| C4 биљке | [−15 ‰, −9 ‰][9] |
| Атмосферски CO 2 |
−8 ‰ *[10] |
| Морски CO 2 |
[−32 ‰, −13 ‰][9] |
Фотосинтеза је примарни процес посредством којег угљеник долази из атмосфере у жива бића. На фотосинтетичким путањама, 12
C се апсорбује нешто лакше него 13
C, који је се опет лакше апсобује од 14
C. Разлика у уносу ових трију изотопа води до стварања различитих односа 13
C : 12
C и 14
C : 12
C у биљкама у односу на те односе заступљене у атмосфери. Овај ефекат је познат као изотопско фракционисање.[9][10]
Да би се одредио степен фракционисања који се дешава у одређеној биљци, мере се количине и изотопа 12
C и изотопа 13
C, а резултујућа размера 13
C : 12
C се пореди са стандардним односом, познатим под енглеском скраћеницом PDB (енгл. Pee Dee Belemnite — „пи-ди-белемнит”, фосил из Пи Ди формације у Јужној Каролини).[11] Пропорција 13
C : 12
C се користи уместо 14
C : 12
C зато што је много лакша за измерити, а ова друга може да се изведе од. израчуна без проблема ако је прва позната: релативно трошење 13
C у односу на 12
C је пропорционално разлици у атомским масама двају изотопа, тако да је трошење 14
C једнако двоструком трошењу 13
C.[12] Фракционисање за 13
C, познато и као δ13
C, рачуна се по следећој формули:[10]
где (знак за промил, ‰) означава „делове од хиљаду”.[10] Пошто PDB стандард садржава необично велике пропорције 13
C (PDB вредност износи 11,2372 ‰)[13] већина измерених вредности за δ13
C је негативна, што није грешка.

C од обичне траве, а узорци који су узети од ових животиња мерили су вредности за δ13
C и до ≈ −13 ‰, што је много више од вредности за овце које се хране обичном травом[10]
Основни принцип прорачуна старости узорка
[уреди | уреди извор]Живе биљке из атмосфере узимају угљеник-14 14
C, као и угљеник-12 12
C и уграђују их у шећере, животиње једу биљке и у њих се преноси исти однос угљеника-14 14
C и угљеника-12 12
C какав је постојао у атмосфери Земље у време тог храњења.[14]
Када биљка, или животиња умре, она престаје да стиче 14
C, али 14
C унутар њеног биолошког материјала у том моменту ће наставити да се распада. Дакле, однос 14
C и 12
C у остацима ће постепено да се смањује.
Пошто је брзина којом се 14
C распада позната, постотак радиоугљеника може да се искористи да би се одредио временски период који је прошао од момента када је дати узорак престао да размењује угљеник са околином — што је узорак старији, мање 14
C ће се да остаје у њему.[6]
Једначина која управља распадом радиоактивног изотопа је:[4]
где је — број атома изотопа у оригиналном узорку (у тренутку , када је организам чији се узорак испитује умро), броја преосталих атома после времена ,[4] а константа која зависи од одређеног изотопа (за дати изотоп она је једнака реципрочној вредности средњег живота — просечног или очекиваног времена које ће дати атом да преживи пре него што буде подвргнут процесу радиоактнивног распада)[4]
Средњи живот, који се означава са , за 14
C износи око 8.267 година, тако да једначина изнад може да се препише у следећем облику:[15]
где је дато у годинама.
Подразумева се да узорак мора да оригинално има исти однос 14
C : 12
C као што га има атмосфера, а пошто је величина узорка позната, укупан број атома у узроку може да се израчуна, дајући — број атома 14
C у оригиналном узорку (у моменту када је организам умро). Мерење вредности за — тренутни број атома 14
C у узорку, омогућава израчунавање времена — старост узорка, а све користећи једначину приказану изнад.[6]
Полуживот радиоактивног изотопа (који се обично означава са ) је много чешће коришћен концепт од средњег живота. Иако једначине представљене изнад у обзир узимају само средњи живот, више је уобичајена употреба вредности полуживота за изотоп 14
C него његовог средњег живота. Средњи живот и полуживот су повезани следећом једначином:[4]
Тренутно прихваћена вредност за полуживот 14
C је 5.730 година.[4] Ово значи, као што је већ поменуто, да ће након 5.730 година само половина почетног 14
C да преостане у узорку; након 11.460 година ће да преостане четвртина почетног 14
C; након 17.190 година ће да преостане осмина почетног 14
C и тако даље.
Детаљнији прорачун старости узорка
[уреди | уреди извор]Радиоактивни распад изотопа угљеника-14 следи експоненцијални распад:
где је: — број радиоактивних атома угљеника-14; — константа распада (позитиван број).
Као решење ове једначине, број радиоактивних атома се може написати као функција времена:
Функција описује експоненцијално распадање у временском распону , а као почетни услов дато је — број атома угљеника-14 на почетку распадања, када је .
Два релативна времена се могу дефинисати према наведеноме:
- средњи живот (средње време које сваки радиоактивни атом проведе у датом узорку док се не распадне)
- = /угљеник-14 средњи или просечни живот (8.033 године; Либи вредност)/
- полуживот (време које је прошло за пола броја радиоактивних атома да се распадну у датом узорку)
- = /угљеник-14 полуживот (5.568 година; Либи вредност)/
Према томе, за радиоактивни датум следи:
С друге стране, за радиоактивно доба важи негативна вредност радиоактивног датума:
Након замене вредности, за теоретско радиоактивно доба — добијено користећи логаритам за природни број (број е) — вреди следећа формула:
Користећи логаритам са базом 2, време полуживота је:
Методе мерења
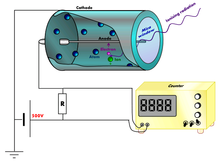
[уреди | уреди извор]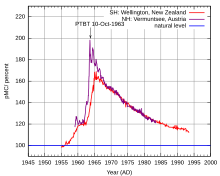
Генерално, у употреби су три основне технике мерења активности изотопа угљика-14 у разним материјалима:
- мерење гасним пропорционалним бројачем
- мерење текућинским сцинитилацијским бројачем
- мерење акцелераторском масеном спектроскопијом
Основна карактеристика свих ових метода је да су деструктивне, тј. узорак чију се старост жели одредити треба спалити и даље припремити у облику погодном за мерење активности угљеника-14.
Радиометријске методе се заснивају на бројању појединачних распада радиоактивног изотопа угљеника-14. Потребна количина угљеника овиси о величини и типу бројача, али није мања од 5 g, с тим да ваља узети у обзир чињеницу да угљеник чини око трећину масе органског материјала. За датирање костију треба узети далеко већу количину узорка, јер из њих треба екстрахирати органски дио (колаген), чији се удио смањује код старих костију.
Посебан проблем радиометријских мерења представља утицај зрачења околине и космичког зрачења, који засењује детекцију радиоактивног распада атома угљеника-14. Ово тзв. основно зрачење потребно је редуковати што је више могуће, применом тзв. пасивних и активних штитова. Пасивни штит се састоји од велике количине олова које редукује утиецај космичких зрака, односно парафина који смањује утиецај неутронског зрачења. У циљу смањења утиецаја космичког зрачења, лабораторије се обично смештају у сутеренске или подрумске просторије. Активни штит се састоји од додатних детектора који региструју пролаз космичког зрачења и који раде у тзв. антикоинцидентној техници.
Ако оба детектора (онај који мери активност угљеника-14 у узорку и овај заштитни) истовремено детектују неки импулс, онда то значи да он потиече од основног зрачења, а не од распада атома угљеника-14, па се такви импулси одбацују.
Гасни пропорционални бројач
[уреди | уреди извор]
Код мерења активности угљеника-14 гасним пропорционалним бројачем (енгл. gas proportional counter, GPC), потребно је одређеним хемијским поступцима добити неки гас који садржи сав угљеник из узорка, а истовремено се може користити као радни гас у бројачу. Зависно о лабораторији, као бројачки гас употребљавају се угљен-диоксид, метан, ацетилен или бензен. Пропорционални бројач се састоји обично од цилиндричне катоде и аноде у облику танке централне жице. Између њих разлика потенцијала износи неколико хиљада волти. Бета честице настале распадом угљеника који је саставни део молекула бројачког гаса, јонизирају на свом путу молекуле гаса, остављајући за собом траг који се састоји од позитивних јона и електрона. Електрони се убрзавају према аноди те у њеној близини — где је електрично поље најјаче — производе лавине парова „јон — електрон” који се сакупљају на аноди, даље производећи електричне импулсе. Сваки бета распад створи један импулс и исти се детектује електроничким путем.
Текућински сцинтилацијски бројач
[уреди | уреди извор]Код мерења активности угљеника-14 текућинским сцинтилацијским бројачем (енгл. liquid scintillation counter, LSC), узорак се хемијским поступцима претвара у бензен (C6H6), који је веома погодан материјал будући да је 96% његовог састава угљеник. Сцинтилацијски детектори заснивају свој рад на чињеници да честице јонизацијског зрачења — успоравајући се или заустављајући се у одређеним органским спојевима названим сцинтилатори — узрокују пулсеве светлосних фотона. Стога се бензену додаје мања количина органског сцинтилатора, како би се добио сцинтилацијски раствор, тзв. коктел. Будући да је угљеник-14 саставни дио узорка, електрони настали бета распадом ексцитирају његове молекуле. Ексцитацијска енергија се преноси од једне молекуле до друге, све док је не зароби молекула сцинтилатора, приликом чега се емитује светло (фотон). Број емитованих фотона пропорционалан је енергији јонизације. Добијени светлосни фотони се на фото-катоди претварају у електроне (фотоелектрични ефекат). Фотомултипликатор убрзава примарне електроне с фото-катоде и при том се њихов број умножава. На излазу се добија снажан електрични пулс пропорционалан амплитуди светла (сцинтилација) од. енергији упадне честице.
Акцелераторска масена спектроскопија
[уреди | уреди извор]Код мерења активности угљеника-14 акцелераторском масеном спектроскопијом/спектрометријом (енгл. accelerator mass spectrometry, AMS), насупрот радиометријским техникама, овде се уместо појединачних распада атома угљеника-14 мери омер атома изотопа угљеника-14 у односу на најзаступљенији изотоп угљеника, угљеник-12. Код ове технике на бројање не утиче космичко зрачење које је главни извор сметњи код гасних и текућинских бројача. Акцелераторском техником се може одредити старост далеко мање количине узорка, све до милиграма или чак микрограма (нпр. зрно жита, комадић тканине, део листа папира); гранична старост која се може измерити овом методом износи до приближно 60.000 година. Додатне предности ове методе су кратко време мерења и мања могућност погрешке, с тим да је она далеко скупља и захтева рад на скупим нуклеарним машинама. Узорак се хемијским путем преводи у графит, који представља мету која се излаже бомбардирању честицама из акцелератора. Јонизирани атоми се затим убрзавају у јаком електричном пољу. Проласком кроз магнет, раздвајају се атоми 14C од атома 12C и 13C, након чега се у посебно конструисаном детектору одређује омер 14C : 12C за сваки узорак.[19]
Калибрација
[уреди | уреди извор]
Старост мерена методом радиоактивног угљеника темељи се на претпоставци да је концентрација активности угљеника-14 у природним резервоарима (првенствено атмосфери) у прошлости била константна. Међутим, понајвише услед флукутација Сунчевог магнетског поља (Сунчев циклус), она није била константна; према томе, резултати мерења не одговарају апсолутно правој старости материјала чија се старост одређује.[21] Због тога се указала потреба да се промене у концентрацији активности угљеника-14 у прошлости одреде неком независном методом. Цикличке промене годишњих доба узрокују неправилности у ширини годова у дрвећу, а оне су сличне за све дрвеће исте врсте у одређеној климатској зони. След годова ствара тиме врсту календара. Спајањем следа годова појединог старог дрвета познате старости и мерењем активности угљеника-14 код појединачних годова, било је могуће добити непрекинуту калибрацијску кривуљу за протеклих чак 12.000 година.
Продужавање калибрацијске кривуље на још веће старости могуће је методом бројања варви (годишњи слој седиментних стена), те датирањем сига (сталактити, сталагмити) или седри методом торијум-230 / уранијум-234 / уранијум-238.
Стварање угљеника-14 за време нуклеарних експеримената
[уреди | уреди извор]Надземни нуклеарни експерименти који су извођени у неколико држава између 1955. и 1980, знатно су повећали количину угљеника-14 у атмосфери, а аутоматски и у целој биосфери. Након тога се количина угљеника-14 почела смањивати.[22]
Види још
[уреди | уреди извор]Напомене
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ „Radioizotopno datiranje” (2014). enciklopedija.hr. Hrvatska enciklopedija. Leksikografski zavod Miroslav Krleža.
- ^ Arnold, J. R.; Libby, W. F. (1949). „Age Determinations by Radiocarbon Content: Checks with Samples of Known Age”. Science. 110 (2869): 678—680. PMID 15407879. doi:10.1126/science.110.2869.678. Архивирано из оригинала 15. 01. 2019. г. Приступљено 28. 12. 2015.
- ^ Willard Frank Libby
- ^ а б в г д ђ е Bowman 1995, стр. 9–15
- ^ Bianchi & Canuel (2011). стр. 35.
- ^ а б в Aitken 1990, стр. 56–58
- ^ Currie, Lloyd A. (2004). „The remarkable metrological history of radiocarbon dating II”. Journal of Research of the National Institute of Standards and Technology. 109: 185—217. doi:10.6028/jres.109.013.
- ^ Taylor & Bar-Yosef (2014). стр. 33.
- ^ а б в г д Maslin & Swann (2006). стр. 246.
- ^ а б в г д Bowman 1995, стр. 20–23
- ^ Taylor & Bar-Yosef (2014). стр. 125.
- ^ Aitken 1990, стр. 61–66
- ^ Dass 2007, стр. 276.
- ^ Логос 2017, стр. 307-308.
- ^ Aitken 1990, стр. 59.
- ^ „Atmospheric δ14C record from Wellington”. Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center. Oak Ridge National Laboratory. 1994. Архивирано из оригинала 01. 02. 2014. г. Приступљено 16. 10. 2016.
- ^ Levin, I.; et al. (1994). „δ14C record from Vermunt”. Trends: A Compendium of Data on Global Change. Carbon Dioxide Information Analysis Center. Архивирано из оригинала 23. 09. 2008. г. Приступљено 16. 10. 2016.
- ^ „Radiocarbon dating”. University of Utrecht. Приступљено 16. 10. 2016.
- ^ Taylor, R. E.; Southon, J. (2007). „Use of natural diamonds to monitor chem 14C – AMS instrument backgrounds”. Nuclear Instruments and Methods in Physics Research B. 259: 282—328. doi:10.1016/j.nimb.2007.01.239.
- ^ Stuiver, M.; Reimer, P. J.; Braziunas, T. F. (1998). „High-precision radiocarbon age calibration for terrestrial and marine samples”. Radiocarbon. 40: 1127—1151. Архивирано из оригинала 29. 05. 2010. г. Приступљено 28. 12. 2015.
- ^ Kudela, K.; Bobik, P. (2004). „Long-Term Variations of Geomagnetic Rigidity Cutoffs”. Solar Physics. 224: 423—431. doi:10.1007/s11207-005-6498-9.
- ^ Reimer, Paula J.; Brown, Thomas A.; Reimer, Ron W. (2004). „Discussion: Reporting and Calibration of Post-Bomb chem 14C – Data”. Radiocarbon. 46 (3): 1299—1304.
Литература
[уреди | уреди извор]- Aitken, M.J. (1990). Science-based Dating in Archaeology. London: Longman. ISBN 0-582-49309-9.
- Aitken, Martin J. (2003). „Radiocarbon Dating”. Ур.: Ellis, Linda. Archaeological Method and Theory. New York: Garland Publishing. стр. 505—508.
- Bianchi, Thomas S.; Canuel, Elizabeth A. (2011). Chemical Markers in Aquatic Ecosystems. Princeton: Princeton University Press. ISBN 978-0-691-13414-7.
- Bousman, C. Britt; Vierra, Bradley J. (2012). „Chronology, Environmental Setting, and Views of the Terminal Pleistocene and Early Holocene Cultural Transitions in North America”. Ур.: Bousman, C. Britt; Vierra, Bradley J. From the Pleistocene to the Holocene: Human Organization and Cultural Transformations in Prehistoric North America. College Station, Texas: Texas A&M University Press. стр. 1—15. ISBN 978-1-60344-760-7.
- Bowman, Sheridan (1995) [1990]. Radiocarbon Dating. London: British Museum Press. ISBN 0-7141-2047-2.
- Cronin, Thomas M. (2010). Paleoclimates: Understanding Climate Change Past and Present. New York: Columbia University Press. ISBN 978-0-231-14494-0.
- Dass, Chhabil (2007). Fundamentals of Contemporary Mass Spectrometry. Hoboken, New Jersey: John Wiley & Sons. ISBN 978-0-471-68229-5.
- Eriksson Stenström, Kristina; Skog, Göran; Georgiadou, Elisavet; Genberg, Johan; Johansson, Anette (2011). A guide to radiocarbon units and calculations. Lund: Lund University.
- Ferronsky, V.I.; Polyakov, V.A. (2012). Isotopes of the Earth's Hydrosphere. New York: Springer. ISBN 978-94-007-2855-4.
- Killick, David (2014). „Using evidence from natural sciences in archaeology”. Ур.: Chapman, Robert; Alison, Wylie. Material Evidence: Learning From Archaeological Practice. Abingdon, UK: Routledge. стр. 159—172. ISBN 978-0-415-83745-3.
- L'Annunziata, Michael F. (2007). Radioactivity: Introduction and History. Amsterdam: Elsevier. ISBN 978-0-444-52715-8.
- L'Annunziata, Michael F.; Kessler, Michael J. (2012). „Liquid scintillation analysis: principles and practice”. Ур.: L'Annunziata, Michael F. Handbook of Radioactivity Analysis (III изд.). Oxford: Academic Press. стр. 423—573. ISBN 978-0-12-384873-4.
- Libby, Willard F. (1965) [1952]. Radiocarbon Dating (II (1955) изд.). Chicago: Phoenix.
- Macdougall, Doug (2008). Nature's Clocks: How Scientists Measure the Age of Almost Everything. Berkeley, California: University of California Press. ISBN 978-0-520-24975-2.
- Malainey, Mary E. (2010). A Consumer's Guide to Archaeological Science. New York: Springer. ISBN 978-1-4419-5704-7.
- Maslin, Mark A.; Swann, George E.A. (2006). „Isotopes in marine sediments”. Ур.: Leng, Melanie J. Isotopes in Palaeoenvironmental Research. Dordrecht: Springer. стр. 227—290. ISBN 978-1-4020-2503-7.
- Mook, W.G.; Waterbolk, H.T. (1985). Handbooks for Archaeologists: No. 3: Radiocarbon Dating. Strasbourg: European Science Foundation. ISBN 2-903148-44-9.
- Post, Wilfred M. (2001). „Carbon cycle”. Ур.: Goudie, Andrew; Cuff, David J. Encyclopedia of Global Change: Environmental Change and Human Society, Volume 1. Oxford: Oxford University Press. стр. 127—130. ISBN 0-19-514518-6.
- Renfrew, Colin (2014). „Foreword”. Ур.: Taylor, R.E.; Bar-Yosef, Ofer. Radiocarbon Dating. Walnut Creek, California: Left Coast Press. стр. 12—14. ISBN 978-1-59874-590-0.
- Schoeninger, Margaret J. (2010). „Diet reconstruction and ecology using stable isotope ratios”. Ур.: Larsen, Clark Spencer. A Companion to Biological Anthropology. Oxford: Blackwell. стр. 445—464. ISBN 978-1-4051-8900-2.
- Šilar, Jan (2004). „Application of environmental radionuclides in radiochronology: Radiocarbon”. Ур.: Tykva, Richard; Berg, Dieter. Man-made and Natural Radioactivity in Environmental Pollution and Radiochronology. Dordrecht: Kluwer Academic Publishers. стр. 150—179. ISBN 1-4020-1860-6.
- Suess, H.E. (1970). „Bristlecone-pine calibration of the radiocarbon time-scale 5200 B.C. to the present”. Ур.: Olsson, Ingrid U. Radiocarbon Variations and Absolute Chronology. New York: John Wiley & Sons. стр. 303—311.
- Taylor, R.E. (1987). Radiocarbon Dating. London: Academic Press. ISBN 0-12-433663-9.
- Taylor, R.E. (1997). „Radiocarbon dating”. Ур.: Taylor, R.E.; Aitken, Martin J. Chronometric Dating in Archaeology. New York: Plenum Press. стр. 65—97. ISBN 0-306-45715-6.
- Taylor, R.E.; Bar-Yosef, Ofer (2014). Radiocarbon Dating (2nd изд.). Walnut Creek, California: Left Coast Press. ISBN 978-1-59874-590-0.
- Terasmae, J. (1984). „Radiocarbon dating: some problems and potential developments”. Ур.: Mahaney, W.C. Quaternary Dating Methods. Amsterdam: Elsevier. стр. 1—15. ISBN 0-444-42392-3.
- Theodórsson, Páll (1996). Measurement of Weak Radioactivity. Singapore: World Scientific Publishing. ISBN 9810223153.
- Trumbore, Susan E. (1996). „Applications of accelerator mass spectrometry to soil science”. Ур.: Boutton, Thomas W.; Yamasaki, Shin-ichi. Mass Spectrometry of Soils. New York: Marcel Dekker. стр. 311—340. ISBN 0-8247-9699-3.
- Tuniz, C.; Zoppi, U.; Barbetti, M. (2004). „Radionuclide dating in archaeology by accelerator mass spectrometry”. Ур.: Martini, M.; Milazzo, M.; Piacentini, M. Physics Methods in Archaeometry. Amsterdam: IOS Press. стр. 385—405. ISBN 978-1-58603-424-5.
- Walker, Mike (2005). Quaternary Dating Methods (PDF). Chichester: John Wiley & Sons. ISBN 978-0-470-86927-7. Архивирано из оригинала (PDF) 14. 07. 2014. г. Приступљено 16. 10. 2016.
- Warneck, Peter (2000). Chemistry of the Natural Atmosphere. London: Academic Press. ISBN 0-12-735632-0.
- Логос, Александар А. (2017). Путовање мисли : увод у потрагу за истином. Београд.
Спољашње везе
[уреди | уреди извор]- (језик: енглески) RADON – база података за европске 14C датуме
- (језик: хрватски) Одређивање старости твари методом 14C — Институт Руђер Бошковић
- (језик: хрватски) Употреба физичких метода у археологији (Марко Север)





























