Амин (хемија)
| Примарни амин | Секундарни амин | Терцијарни амин |
|---|---|---|
 |
 |
 |
Амини припадају групи органских једињења која садрже најмање једну или више базних азотових атома у молекулу. Амини се сматрају дериватима амонијака и структурно су му сличи. Један или више водоникових атома замијењен са једном или више алкилних или арилних органских група.[1] Важни амини су аминокиселине, триметиламини, и анилини. Неоргански деривати амонијака се такође називају аминима, нпр. хлорамин (NClH2).
Слични аминима су амиди, међутим они су деривати карбоксилних киселина и имају карбонилну групу везану на амино скупину, нпр.: RC(O)NR2. Амиди и амини имају различиту структуру и својства, стога је разлика у називу важна. Супституент -NH2 се назива амино група.[2] Једињења са атомом азота везаним за карбонил групу, која имају структуру R–CO–NR′R″, се називају амидима и имају различита хемијска својства од амина.[3][4][5][6][7][8]
Номенклатура амина
[уреди | уреди извор]Амини се могу класификовати према природи и броју супституената на азоту. Алифатични амини садрже само Х и алкил супституенте. Ароматични амини имају атом азота повезан са ароматичним прстеном.
Амини, подједнако алкилни и арилни, организовани су у три подкатегорије [[#табела_повезаности_амино_група|(погледајте табелу)в] на основу броја атома угљеника у близини азота (колико је атома водоника у молекулу амонијака замењено угљоводоничним групама):[2][9]
Код нижих амина користи се суфикс -амин, а код виших амина користи се префикс амино-.
- Примарни амини: метиламин, етаноламин или 2-аминоетанол
- Секундарни амини: диметиламин, док би пример ароматичног амина био дифениламин.
- Терцијарни амини: триметиламин, диметилетаноламин или 2-(диметиламин)етанол
Четврта подкатегорија је одређена повезаношћу супституената везаних за азот:
- Циклични амини — Циклични амини су било секундарни или терцијарни амини. Примери цикличних амина су трочлани прстен азиридина и шесточлани прстен пиперидина. N-метилпиперидин и N-фенилпиперидин су примери цикличних терцијарних амина.
Исто тако је могуће да постоје четири органска супституента на азоту. Ове врсте нису амини већ су кватернарни амонијум катјони и имају наелектрисани азотни центар. Кватернарне амонијум соли постоје са многим врстама ањона.
Конвенције именовања
[уреди | уреди извор]Амини се именују на неколико начина. Типично, једињењу се даје префикс „амино-” или суфикс „-амин”. Префикс N означава супституцију на атому азота (нпр.: N,N-диметилетиламин). Органско једињење са више амино група назива се диамин, триамин, тетраамин и тако даље.
Нижи амини се именују суфиксом -амин.

Виши амини имају префикс амино као функционалну групу. ИУПАЦ, међутим, не препоручује ову конвенцију,[10] али преферира облик алканамина, нпр. бутан-2-амин. 2-аминобутан (или бутан-2-амин)

Физичка својства
[уреди | уреди извор]Водонична веза знатно утиче на својства амина[11], због тога је тачка кључања виша него код сличних алкана и нижа од сличних алкохола. Због веће електронегативности кисеоника од азота, амини су више базични од алкохола и алкана који су тиме киселији. Амини мањих релативних молекулских маса (метил-, диметил-, триметил- и етиламин) су гасови при собној температури. Амини веће молекулске масе су течности или чврсте материје (диетиламин или триетиламин).
Гасовити амини имају неугодан мирис сличан амонијаку, док течни амини миришу попут покварене рибе. Амини с мањим бројем угљеникових атома добро се растварају у води стварајући водоничне везе, растворљивост се смањује с повећањем молекулске масе амина - односно хидрофобног дела молекула. Алифатични амини добро су растворни у органским растварачима, поготово поларним. Примарни амини реагирају са кетонима као што је ацетон.
Спектроскопска идентификација
[уреди | уреди извор]Типично се присуство аминске функционалне групе одређује комбинацијом техника, укључујући масену спектрометрију као и НМР и ИР спектроскопије. 1H НМР сигнали за амини нестају након третирања узорка са D2О. У свом инфрацрвеном спектру примарни амини испољавају две N-H везе, док секундарни амини имају само једну.[2][12]
Структура
[уреди | уреди извор]Алифатични амини
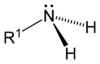
[уреди | уреди извор]Разликују се три врсте амина: примарни, секундарни и терцијарни, и то с обзиром на број угљоводоничних група везаних за азотов атом умјесто водоника. Слово R означава органску (угљоводоничну) групу.
Алкил амини карактеристично имају тетраедралне азотне центре. C-N-C и C-N-H углови теже идеализованом углу 109°. C-N растојања су нешто краћа од C-C растојања. Енергетска баријера баријера за азотну инверзију стереоизомера је око 7 kcal/mol за триалкиламин. Интерконверзија се може упоредити са инверзијом отвореног кишобрана на јаком ветру.
Амини типа NHRR′ и NRR′R″ су хирални: азотни центар носи четири супституента рачунајући слободни пар. Услед ниске баријере инверзије, амини типа NHRR′ се не могу добити у оптички чистој форми. За хиралне терцијарне амине, NRR′R″ се једино може решити кад су R, R′, и R″ групе ограничене у цикличним структурама као што су N-супституисани азиридини (кватернарне амонијум соли се могу раздвојити).

|
⇌ | 
|
| Инверзија амина. Пар тачака представља усамљени електронски пар на атому азота. | ||
Ароматични амини
[уреди | уреди извор]Ароматични амини на азотовом атому имају везан ароматични прстен, тривијално се зову анилини, пример је фениламин. Анилин и његови деривати су у индустријској синтези боја полазна једињења. Ароматични прстен снижава базичност амина зависно од супституената, а присуство амино групе повећава реактивност код ароматичног прстена, због електрон-донатора. Једна од реакција ароматичног прстена је Голдбергова реакција.[13][14]
У ароматичним аминима („анилинима”), азот је често скоро планаран услед конјугације слободног електронског пара са арил субституентом. C-N растојање је респективно краће. У анилину, C-N растојање је исто као C-C растојања.[15]
Базичност
[уреди | уреди извор]Попут амонијака, амини су базе.[16] У поређењу са алкалним металним хидроксидима, амини су слаби (погледајте табелу за примере Ка вредности конјугованих киселина).
| Алкиламин[17] ор анилине[18] | pKa протонованог амина | Kb |
|---|---|---|
| метиламин (MeNH2) | 10,62 | 4,17Е-04 |
| диметиламин (Me2NH) | 10,64 | 4,37Е-04 |
| триметиламин (Me3N) | 9,76 | 5,75Е-05 |
| етиламин (EtNH2) | 10,63 | 4,27Е-04 |
| анилин (PhNH2) | 4,62 | 4,17Е-10 |
| 4-метоксианилин (4-MeOC6H4NH2) | 5,36 | 2,29Е-09 |
| N,N-диметиланилин (PhNMe2) | 5,07 | 1,17Е-09 |
| 3-Нитроанилин (3-NO2-C6H4NH2) | 2,46 | 2,88Е-12 |
| 4-Нитроанилин (4-NO2-C6H4NH2) | 1 | 1,00Е-13 |
| 4-трифлуорометиланилин (CF3C6H4NH2) | 2,75 | 5,62Е-12 |
Базичност амина зависи од:
- Електронскиох својстава супституената (алкил групе повећавају базичност, арил групе смањују итд).
- Степена солвације протонисаног амина, чиме су обухваћени стерни ефекти група на азоту.
Електронски ефекти
[уреди | уреди извор]Захваљујући индуктивним ефектима, може се очекивати да се базичност амина повећава са бројем алкил група на амину. Корелације су компликоване због ефеката солватације који су супротни трендовима индуктивних ефеката. Ефекти солватације такође доминирају базичност ароматичних амина (анилина). За анилине, усамљени пар електрона на азоту се делокализује у прстен, што доводи до смањења базичности. Супституенти на ароматичном прстену, и њихови положаји у односу на амино групу, такође утичу на базичност као што се види у табели.
Солвациони ефекти
[уреди | уреди извор]Солватација значајно утиче на базичност амина. N-H групе формирају јаке интеракције са водом, а посебно амонијум јони. Насупрот томе, базичност амонијака се повећава за 1011 услед солвације. Интринзична базичност амина, тј. ситуација у којој је солватација неважна, је изучавана у гасној фази. У гасној фази амини показују базичности предвиђене из деловања органских супституената на ослобађање електрона. Тако су терцијарни амини у већој мери базични од секундарних амина, који су више базични од примарних амина, и на крају амонијак је најмање базичан. pKb редослед (базичности у води) не следи овај тренд. Слично томе анилин је више базичан од амонијака у гасној фази, али је десет хиљада пута мање базичан у воденом раствору.[19]
У апротичним поларним растварачима као што су DMSO, DMF, и ацетонитрил енергија солвације није једнако висока као у протичним растворима попут воде и метанола. Из тог разлога, базичност амина у тим апротичним растварачима је скоро потпуно вођена електронским ефектима.
Синтеза
[уреди | уреди извор]Алкилација
[уреди | уреди извор]Најзначајнији индустријски поступак припреме амина је путем алкилације амонијака алкохолима:[20]
- ROH + NH3 → RNH2 + H2O
За разлику од реакција амина са алкил халидима, овај индустријски метод је зелен у смилу да се као нуспроизвод формира вода. Реакција амина и амонијака са алкил халидима се користи за лабораторијску синтезу:
- RX + 2 R′NH2 → RR′NH + [RR′NH2]X
Такве реакције, које су најкорисније за алкил јодиде и бромиде, ретко се примењују јер је степен алкилације тешко контролисати.[20] Селективност се може побољшати путем Делепинове реакције, мада се она ретко користи у индустријским размерама.
Редуктивне руте
[уреди | уреди извор]Путем процеса хидрогенације, нитрили се редукују до амина користећи водоник у присуству никла као катализатора. Реакције су сензитивне за киселе и базне услове, што може да узрокује хидролизу –CN групе. LiAlH4 се чешће користи за редукцију нитрила у лабораторијским размерама. Слично томе, LiAlH4 редукује амиде до амина. Многи амини се формирају из алдехида и кетона путем редуктивне аминације, која се може одвијати било каталитички или стехиометријски.
Анилин (C6H5NH2) и његов и деривати се припремају редукцијом нитроароматичних једињења. У индустрији, водоник је преферентни реактант, док се у лабораторијским условима често користе калај и гвожђе.
Специјализоване методе
[уреди | уреди извор]Постоје многе методе за припрему амина, а многе од ових метода су прилично специјализоване.
| Назив реакције | Супстрат | Коментар |
|---|---|---|
| Стаудингерова редукција | Органски азид | Ова реакција се такође одвија са редукционим агенсом као што је литијум алуминијум хидрид. |
| Шмитова реакција | Карбоксилна киселина | |
| Аза-Бејлис-Хилманова реакција | Имин | Синтеза алилних амина |
| Бирчова редукција | Имин | Корисно за реакције које хватају нестабилне иминске интермедијере, као што су Григнардове реакције са нитрилима.[21] |
| Хофманова деградација | Амид | Ова реакција је валидна само за припрему примарних амина. Даје добре приносе примарних амина незагађених другим аминима. |
| Хофманова елиминација | Кватернарна амонијумова со | Након третмана са јаком базом |
| Лукартова реакција | Кетони и алдехиди | Редуктивна аминација мрављом киселином и амонијаком преко иминског интермедијера |
| Хофман-Лофлерова реакција | Халоамин | |
| Ешвајлер-Кларкова реакција | Амин | Редуктивна аминација мрављом киселином и формалдехидом преко иминског интермедијера |
Реакције
[уреди | уреди извор]Алкилација, ацилација, и сулфонација, итд
[уреди | уреди извор]Поред њихове базичности, доминантна реактивност амина је њихова нуклеофилност.[22] Већина примарних амина су добри лиганди за металне јоне да формирају координационе комплексе. Амини се алкилују алкил халогенидима. Ацил хлориди и анхидриди киселина реагују са примарним и секундарним аминима и формирају амиде („Шотен–Бауманова реакција“).

Слично, са сулфонил хлоридима, добијају се сулфонамиди. Ова трансформација, позната као Хинсбергова реакција, хемијски је тест за присуство амина.
Пошто су амини базни, они неутралишу киселине да би формирали одговарајуће амонијумове соли Р
3НХ+
. Када се формирају од карбоксилних киселина и примарних и секундарних амина, ове соли се термички дехидрирају и формирају одговарајуће амиде.
Амини подлежу сулфамацији након третмана са сумпор триоксидом или његовим изворима:
Диазотизација
[уреди | уреди извор]Амини реагују са азотном киселином дајући диазонијум соли. Алкил диазонијум соли су од малог значаја јер су превише нестабилне. Најважнији чланови су деривати ароматичних амина као што је анилин („фениламин”) (А = арил или нафтил):
Анилини и нафтиламини формирају стабилније диазонијум соли, које се могу изоловати у кристалном облику.[23] Диазонијум соли пролазе кроз низ корисних трансформација које укључују замену Н
2 група са ањонима. На пример, цијанид бакра даје одговарајуће нитриле:
Арилдиазонијуми се спајају са ароматичним једињењима богатим електронима као што је фенол да би формирали азо једињења. Такве реакције се широко примењују у производњи боја.[24]
Конверзија у имине
[уреди | уреди извор]Формирање имина је важна реакција. Примарни амини реагују са кетонима и алдехидима, и формирају имине. У случају формалдехида (Р' = Х), ови производи обично постоје као циклични тримери: Редукција ових имина даје секундарне амине:
Слично, секундарни амини реагују са кетонима и алдехидима да би формирали енамине:
Живини јони реверзибилно оксидирају терцијарне амине са α водоником до иминијум јона:[25]
Преглед
[уреди | уреди извор]У наставку је дат преглед реакција амина:
Биолошка активност
[уреди | уреди извор]Амини су свеприсутни у биологији. Разлагањем аминокиселина ослобађају се амини, што је познато у случају распадајућих риба које миришу на триметиламин. Многи неуротрансмитери[26] су амини, укључујући епинефрин, норепинефрин, допамин, серотонин и хистамин. Протонисане амино групе (–НХ+
3) су најчешћи позитивно наелектрисани делови у протеинима, посебно у аминокиселини лизин.[27] ДНК ањонског полимера је типично везан за различите протеине богате амином.[28] Додатно, терминално наелектрисани примарни амонијум на лизину формира соне мостове са карбоксилатним групама других амино киселина у полипептидима, што је један од примарних утицаја на тродимензионалне структуре протеина.[29]
Амински хормони
[уреди | уреди извор]Хормони добијени модификацијом аминокиселина називају се аминским хормонима. Типично, оригинална структура аминокиселине је модификована тако да се уклони –ЦООХ, или карбоксилна група, док –НХ+
3, или амино група остаје. Амински хормони се синтетишу из аминокиселина триптофана или тирозина.[30]
Примена амина
[уреди | уреди извор]Боје
[уреди | уреди извор]Примарни ароматични амини се користе као полазни материјал за производњу азо боја. Они реагују са азотном киселином да би се формирала диазонијумова со, која се може подвргнути реакцији купловања у којој настају азо једињење. Азо једињења су јарко обојена, те се она широко користе у индустрији бојења. Примери таквих једињења су:
- Метил оринџ
- Директно браон 138
- Сансет жуто ФЦФ
- Понсо
Лекови
[уреди | уреди извор]Већина лекова и кандидата за лекове садрже аминске функционалне групе:[31]
- Хлорфенирамин је антихистаминик који помаже у ублажавању алергијских поремећаја услед прехладе, поленске грознице, свраба коже, уједа инсеката и убода.
- Хлорпромазин је средство за смирење које умирује без изазивања сна. Користи се за ублажавање анксиозности, узбуђења, немира или чак менталног поремећаја.
- Ефедрин и фенилефрин, као амин хидрохлориди, користе се као деконгестиви.
- Амфетамин, метамфетамин и меткатинон су психостимулативни амини које је америчка ДЕА навела као контролисане супстанце.
- Тиоридазин, антипсихотик, је амин за који се верује да испољава своје антипсихотичке ефекте, делимично, због ефеката на друге амине.[32]
- Амитриптилин, имипрамин, лофепрамин и кломипрамин су трициклични антидепресиви и терцијарни амини.
- Нортриптилин, дезипрамин и амоксапин су трициклични антидепресиви и секундарни амини. (Трицикличне групе су груписане по природи коначне амино групе на бочном ланцу.)
- Супституисани триптамини и фенетиламини су кључне основне структуре за велики број психоделичних лекова.
- Опијатни аналгетици као што су морфијум, кодеин и хероин су терцијарни амини.
Третман гасом
[уреди | уреди извор]Водени моноетаноламин (МЕА), дигликоламин (ДГА), диетаноламин (ДЕА), диизопропаноламин (ДИПА) и метилдиетаноламин (МДЕА) се широко користе у индустрији за уклањање угљен-диоксида (ЦО2) и водоник сулфида (Х2С) из природног гаса и рафинеријских токова процеса. Такође се могу користити за уклањање ЦО2 из гасова сагоревања и димних гасова и могу имати потенцијал за смањење гасова стаклене баште. Повезани процеси су познати као заслађивање.[33]
Средства за очвршћавање епоксидне смоле
[уреди | уреди извор]Амини се често користе као средства за очвршћавање епоксидне смоле.[34][35] То укључује диметилетиламин, циклохексиламин и разне диамине као што је 4,4-диаминодициклохексилметан.[20] Мултифункционални амини као што су тетраетиленпентамин и триетилентетрамин се такође широко користе у овом својству.[36] Реакција се наставља тако што усамљени пар електрона на аминском азоту напада најудаљенији угљеник на оксиранском прстену епоксидне смоле. Ово ублажава оптерећење прстена на епоксиду и представља покретачку снагу реакције.[37] Молекули са функционалношћу терцијарног амина се често користе за убрзавање реакције очвршћавања епокси-амина и укључују супстанце као што је 2,4,6-трис(диметиламинометил)фенол. Наведено је да је ово најраспрострањенији акцелератор собне температуре за двокомпонентне системе епоксидне смоле.[38][39]
Безбедност
[уреди | уреди извор]Прости амини мале молекуларне тежине, као што је етиламин, су само слабо токсични са ЛД50 између 100 и 1000 мг/кг. Они иритирају кожу, посебно зато што се неки лако апсорбују кроз кожу.[20] Амини су широка класа једињења, а сложенији чланови класе могу бити изузетно биоактивни, на пример стрихнин.
Неке врсте амина
[уреди | уреди извор]Алкалоиди
[уреди | уреди извор]Алкалоиди су амини у природи, посебно у биљном свету. У природи већином настају из аминокиселина. Знатан број алкалоида је отрован, горког укуса с врло јаким фармаколошким учинком. Примери алкалоида: кофеин (налази се у кафи, чају, безалкохолним пићима, летална доза кофеина је 10 грама), никотин (налази се у лишћу духана, летална доза никотина је 500 милиграма (у крвотоку)), морфин (налази се у опијуму, осушеном соку из мака).
Триптамини
[уреди | уреди извор]Триптамини су алкалоидни моноамини. Стварају се око индолног прстена. Одговарају аминокиселини триптофан. Неки делују као неуротрансмитери, а неки као халуциногени (психоактивне дроге, психоделичне дроге). Примери триптамина: серотонин, мелатонин, диметилтриптамин, псилоцин. Дроге врсте триптамина се налазе у породици (ТиХКАЛ).
Фенилетиламини
[уреди | уреди извор]Фенилетиламини су алкалоидни моноамини. Одговарају аминокиселини фенилаланин. Супституисани фенилетиламини су једињења са мноштвом функција: неуротрансмитери, хормони, стимуланти, халуциногени, антидепресиви. Примери фенилетиламина: допамин, адреналин, норадреналин, амфетамин, метамфетамин, мескалин, МДМА, тирамин, салбутамол. Друге врсте фенилетиламина се налазе у породици (PiHKAL).
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ МцМуррy Јохн Е. (1992). Фундаменталс оф Органиц Цхемистрy (3рд изд.). Белмонт: Wадсwортх. ISBN 0-534-16218-5.
- ^ а б в Smith, Janice Gorzynski (2011). „Chapter 25 Amines”. Ур.: Hodge, Tami; Nemmers, Donna; Klein, Jayne. Organic chemistry (на језику: енглески) (3rd изд.). New York, NY: McGraw-Hill. стр. 949—993. ISBN 978-0-07-337562-5. Архивирано из оригинала (Book) 28. 06. 2018. г. Приступљено 12. 05. 2019.
- ^ Harrison L. G. : The shaping of life: The generation of biological pattern. . Cambridge University Press. 2011. ISBN 978-0-521-55350-6. Недостаје или је празан параметар
|title=(помоћ); http://books.google.com/books?id=-IPG-vg7Pr8C. - ^ Хаџиселимовић Р., Појскић Н. : Увод у хуману имуногенетику. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ), Сарајево. . 2005. ИСБН 978-9958-9344-3-8 [http://books.google.com/books?id=-IPG-vg7Pr8C.
- %5б%5б#ците_реф-5|^%5д%5д Хаџиселимовић http://books.google.com/books?id=-IPG-vg7Pr8C.
- [[#cite_ref-5|^]] Hadžiselimović] Проверите вредност параметра
|url=(помоћ). line feed character у|url=на позицији 54 (помоћ); Недостаје или је празан параметар|title=(помоћ); Сукоб URL—викивеза (помоћ) - ^ Alberts B. ː Molecular biology of the cell. Garland Science. . New York. 2002. ISBN 978-0-8153-3218-3. Недостаје или је празан параметар
|title=(помоћ) - ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. : Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2005. ISBN 978-9958-9344-1-4.
- ^ Капур Појскић L., Ед. : Увод у генетичко инжењерство и биотехнологију, 2. издање. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ), Сарајево. 2014. ISBN 978-9958-9344-8-3.
- ^ „3.11 Basic properties of amines”. Chemistry LibreTexts (на језику: енглески). 2015-09-28. Архивирано из оригинала 23. 5. 2021. г. Приступљено 2021-05-23.
- ^ Hellwich, K.-H.; Hartshorn, R. M.; Yerin, A.; Damhus, T.; Hutton, A. T. (јун 2021). „Brief Guide to the Nomenclature of Organic Chemistry” (PDF). The International Union of Pure and Applied Chemistry (IUPAC). Приступљено 2024-03-07.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Smith, Brian (март 2019). „Organic Nitrogen Compounds II: Primary Amines”. Spectroscopy. Spectroscopy-03-01-2019. 34: 22—25. Приступљено 12. 2. 2024.
- ^ Ullmann, Fritz (1905). „Ueber die Phenylirung von Phenolen”. Berichte der deutschen chemischen Gesellschaft. 38 (2): 2211—2212. doi:10.1002/cber.190503802176.
- ^ Irma Goldberg (1906). „Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator”. Berichte der deutschen chemischen Gesellschaft. 39 (2): 1691—1692. doi:10.1002/cber.19060390298.
- ^ G. M. Wójcik, 2007, "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. Weinheim: Wiley-VCH. doi:10.1002/9780470682531.pat0385.
- ^ Smith, J. W. (1968). S. Patai, ур. „Basicity and complex formation”. Patai's Chemistry of Functional Groups. doi:10.1002/9780470771082.ch4.
- ^ Hall, H. K. (1957). „Correlation of the Base Strengths of Amines”. Journal of the American Chemical Society. 79 (20): 5441—5444. doi:10.1021/ja01577a030.
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). „Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales”. The Journal of Organic Chemistry. 70 (3): 1019—1028. PMID 15675863. doi:10.1021/jo048252w.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ а б в г Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_001.
- ^ Weiberth, Franz J.; Hall, Stan S. (1986). „Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines”. Journal of Organic Chemistry. 51 (26): 5338—5341. doi:10.1021/jo00376a053.
- ^ March, Jerry (1992), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (4th изд.), New York: Wiley, ISBN 0-471-60180-2
- ^ A. N. Nesmajanow (1943). „β-Naphthylmercuric chloride”. Org. Synth.; Coll. Vol., 2, стр. 432
- ^ Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (2000). „Azo Dyes”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a03_245.
- ^ Williams, D. L. H. (1988). Nitrosation
 . Cambridge, UK: Cambridge University. стр. 195. ISBN 0-521-26796-X.
. Cambridge, UK: Cambridge University. стр. 195. ISBN 0-521-26796-X.
- ^ Cuevas J (2019-01-01). „Neurotransmitters and Their Life Cycle”. Reference Module in Biomedical Sciences. Elsevier. ISBN 978-0-12-801238-3. doi:10.1016/b978-0-12-801238-3.11318-2.
- ^ Andrade, Miguel A.; O'Donoghue, Seán I.; Rost, Burkhard (1998). „Adaptation of protein surfaces to subcellular location”. Journal of Molecular Biology. 276 (2): 517—25. CiteSeerX 10.1.1.32.3499
 . PMID 9512720. doi:10.1006/jmbi.1997.1498.
. PMID 9512720. doi:10.1006/jmbi.1997.1498.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry
 (3rd изд.). New York: Worth Publishing. ISBN 1-57259-153-6.
(3rd изд.). New York: Worth Publishing. ISBN 1-57259-153-6.
- ^ Dill, Ken A. (1990). „Dominant forces in protein folding”. Biochemistry. 29 (31): 7133—55. PMID 2207096. S2CID 30690389. doi:10.1021/bi00483a001.
- ^ Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (26. 7. 2023). Anatomy & Physiology. Houston: OpenStax CNX. 17.2 Hormones. ISBN 978-1-947172-04-3.
- ^ Roughley, Stephen D.; Jordan, Allan M. (2011). „The Medicinal Chemist's Toolbox: An Analysis of Reactions Used in the Pursuit of Drug Candidates”. Journal of Medicinal Chemistry. 54 (10): 3451—3479. PMID 21504168. doi:10.1021/jm200187y.
- ^ American Society of Health System Pharmacists; AHFS Drug Information 2010. Bethesda, MD. (2010), p. 2510
- ^ Hammer, Georg; Lübcke, Torsten; Kettner, Roland; Davis, Robert N.; Recknagel, Herta; Commichau, Axel; Neumann, Hans-Joachim; Paczynska-Lahme, Barbara (2000). „Natural Gas”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a17_073.
- ^ „amine curing agent: Topics by Science.gov”. science.gov (на језику: енглески). Приступљено 2022-03-01.
- ^ Howarth, Graham (1995-01-01). „The use of water-based epoxies for anti-corrosive primers”. Pigment & Resin Technology. 24 (6): 3—6. ISSN 0369-9420. doi:10.1108/eb043156.
- ^ Eller K, Henkes E, Rossbacher R, Höke H (2005). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a02_001.
- ^ Howarth G.A "Synthesis of a legislation compliant corrosion protection coating system based on urethane, oxazolidine and waterborne epoxy technology" pages 12, Chapter 1.3.1 Master of Science Thesis April 1997 Imperial College London
- ^ Seo, Jiae; Yui, Nobuhiko; Seo, Ji-Hun (јануар 2019). „Development of a supramolecular accelerator simultaneously to increase the cross-linking density and ductility of an epoxy resin”. Chemical Engineering Journal. 356: 303—311. Bibcode:2019ChEnJ.356..303S. ISSN 1385-8947. doi:10.1016/j.cej.2018.09.020.
- ^ Chen, Fengjun; Liu, Fan; Du, Xiaogang (2023-01-10). „Molecular dynamics simulation of crosslinking process and mechanical properties of epoxy under the accelerator”. Journal of Applied Polymer Science (на језику: енглески). 140 (2). ISSN 0021-8995. doi:10.1002/app.53302.
Literatura
[уреди | уреди извор]- „Amines | Introduction to Chemistry”. courses.lumenlearning.com. Приступљено 2021-07-22.
- Flick, Ernest W. (1993). Epoxy Resins, Curing Agents, Compounds, and Modifiers: An Industrial Guide. Park Ridge, NJ: Noyes Publications. ISBN 978-0-8155-1708-5. OCLC 915134542.
- Santos, M.H.Silla (1996). „Biogenic amines: their importance in foods”. International Journal of Food Microbiology. 29 (2–3): 213—231. PMID 8796424. doi:10.1016/0168-1605(95)00032-1.
- Burchett SA, Hicks TP (август 2006). „The mysterious trace amines: protean neuromodulators of synaptic transmission in mammalian brain”. Prog. Neurobiol. 79 (5–6): 223—46. PMID 16962229. S2CID 10272684. doi:10.1016/j.pneurobio.2006.07.003.
- Suzzi G, Torriani S (2015). „Editorial: Biogenic amines in foods”. Front Microbiol. 6: 472. PMC 4435245
 . PMID 26042107. doi:10.3389/fmicb.2015.00472
. PMID 26042107. doi:10.3389/fmicb.2015.00472  .
. - Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (6. 7. 2023). Anatomy & Physiology. Houston: OpenStax CNX. 12.5 Communication between neurons. ISBN 978-1-947172-04-3.
- Vanda, Pereira (17. 2. 2017). „Analytical methodologies for the determination of biogenic amines in wines: an overview of the recent trends”. Journal of Analytical, Bioanalytical and Separation Techniques (на језику: енглески). 2 (1). doi:10.15436/2476-1869.17.1296. Архивирано из оригинала 11. 09. 2024. г. Приступљено 10. 10. 2024.
- „Definition of AMMINE”. www.merriam-webster.com (на језику: енглески). Приступљено 2024-06-27.
- A. von Zelewsky "Stereochemistry of Coordination Compounds" John Wiley: Chichester, 1995. ISBN 0-471-95599-X.
- Wернер, Алфред (1893). „Беитраг зур Конститутион анорганисцхер Вербиндунген”. Зеитсцхрифт фüр Анорганисцхе Цхемие. 3: 267—330. дои:10.1002/заац.18930030136.
- "Wернер Центенниал" Георге Б. Кауффман, Ед. Адв. Цхем. Сер., 1967, Волуме 62. ISBN 978-0-8412-0063-0
- Хухееy, Јамес Е. (1983). Инорганиц Цхемистрy (3рд изд.). стр. 360.
- Атоји, M.; Рицхардсон, Ј. W.; Рундле, Р. Е. (1957). „Он тхе Црyстал Струцтурес оф тхе Магнус Салтс, Пт(НХ3)4ПтЦл4”. Ј. Ам. Цхем. Соц. 79 (12): 3017—3020. дои:10.1021/ја01569а009.
- Лауренце, C. анд Гал, Ј-Ф. Леwис Басицитy анд Аффинитy Сцалес, Дата анд Меасуремент, (Wилеy 2010) пп 50–51 ISBN 978-0-470-74957-9
- Cramer, R. E.; Bopp, T. T. (1977). „Graphical display of the enthalpies of adduct formation for Lewis acids and bases”. Journal of Chemical Education. 54: 612—613. doi:10.1021/ed054p612. The plots shown in this paper used older parameters. Improved E&C parameters are listed in ECW model.
- Hair, Neil J.; Beattie, James K. (1977). „Structure of Hexaaquairon(III) Nitrate Trihydrate. Comparison of Iron(II) and Iron(III) Bond Lengths in High-Spin Octahedral Environments”. Inorganic Chemistry. 16 (2): 245—250. doi:10.1021/ic50168a006.
Dodatna literatura
[уреди | уреди извор]- „The Biogenic Amines”. – Neuroscience 2nd edition, Dale Purves et al.
Spoljašnje veze
[уреди | уреди извор]- Sinteza primarnih amina - Sintetički protokoli
- Synthesis of amines
- Factsheet, amines in food Архивирано 19 фебруар 2018 на сајту Wayback Machine

![Amine reaction with carboxylic acids {\displaystyle {\underbrace {\ce {H-\!\!{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!\!\!:}} _{\text{amin}}+\underbrace {\ce {R3-{\overset {\displaystyle O \atop \|}{C}}-OH}} _{\text{karboksilna kiselina}}->}\ \underbrace {\ce {{H-{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N+}}}-H}+R3-COO^{-}}} _{{\text{supstituisana-amonijum}} \atop {\text{karboksilatna so}}}{\ce {->[{\text{heat}}][{\text{dehydration}}]}}{\underbrace {\ce {{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!-{\overset {\displaystyle O \atop \|}{C}}-R3}} _{\text{amid}}+\underbrace {\ce {H2O}} _{\text{voda}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53a2578ea2d8f763f798345f6beff0a9051066f2)






![{\displaystyle {\ce {Hg^2+ + R2NCH2R' <=> Hg + [R2N=CHR']+ + H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/577bae0e4c2a18b653c850439a5ad969c30ef050)