Кето-енолни таутомеризам
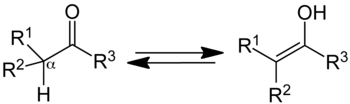
Лево је кето форма; десно је енолна.
У органској хемији, кето-енолни таутомеризам се односи на хемијски еквилибријум између кето форме (кетона или алдехида) и енола (алкохола). Енолна и кето форма су таутомери. Прелаз из једне форме у другу је праћен кретањем протона и премештањем везујућих електрона.
Једињење које садржи карбонилну групу (C=O) је нормално у равнотежи са енолним таутомером, који садржи пар двоструко везаних атома угљеника поред хидроксилне (−OH) групе, C=C-OH. Кето форма је предоминатна у равнотежи за већину кетона. Међутим, енолна форма је важна за поједине реакције. Депротонисани интермедијар у интерконверзији две форме, енолатни ањон, је значајан у карбонилној хемији, зато што је јак нуклеофил.
Нормално је кето-енолна таутомеризациона равнотежа у знатној мери условљена термодинамичким факторима, и на собној температури она је померена ка кето форми. Класични пример преферентног формирања кето форме се може видети у равнотежи између винил алкохола и ацеталдехида (К = [енол]/[кето] ≈ 3 x10−7). Међутим, познато је да у случају винил алкохола, формирање стабилизоване енолне форме могуће уз контролу концентрације воде у систему и употребу кинетички повољног деутеријума(kH+/kD+ = 4.75, kH2O/kD2O = 12). Деутеријумска стабилизација се може остварити путем хидролизе кетенског прекурзора у присуству малог стоихиометријског вишка тешке воде (D2O). Студије су показале да је процес таутомеризације знатно инхибиран на собној температури (kt ≈ 10−6 M/s), и да се полуживот енолне форме може лако продужити до t1/2 = 42 минута за хидролизе првог кинетичког реда.[1]
