Миоцит
| Миоцит | |
|---|---|
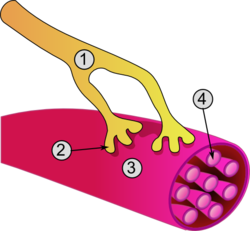 Општа структура мишићне ћелије и живчано-мишићног споја:
| |
| Детаљи | |
| Латински | Мyоцyтус |
| Показатељи | |
| ТХ | Х2.00.05.0.00002 |
| ФМА | 67328 |
| Анатомска терминологија | |
Миоцит (такође познат као мишићна ћелија)[1] је тип ћелија присутан у мишићном ткиву. Миоцити су дуге, цевасте ћелије које се развијају из миобласта да формирају мишиће у процесу познатом као миогенеза.[2] Постоје различити специјализовани облици миоцита са изразитим својствима: ћелије срца, скелета и глатких мишића. Пругасте ћелије срчаних и скелетних мишића називају се мишићним влакнима.[3] Кардиомиоцити су мишићна влакна која формирају коморе срца и имају једно централно једро.[4] Скелетна мишићна влакна помажу потпори и померању тела и имају тенденцију да имају периферна језгра.[5][6] Ћелије глатких мишића контролишу несвесне покрете, попут контракција перисталтика у једњаку и желуцу.
Структура
[уреди | уреди извор]Терминологија
[уреди | уреди извор]Необична микроструктура мишићних ћелија навела је цитологе да створе специјализовану терминологију. Међутим, сваки израз специфичан за мишићне ћелије има противвредност која се користи у терминологији која се примењује на друге врсте ћелија:
| Мишићна ћелија | Друге ћелије организма |
|---|---|
| саркоплазма | цитоплазма |
| саркоплазматични ретикулум | глатки ендоплазматични ретикулум (СЕР) |
| саркозом | митохондрија |
| сарколема | ћелијска мембрана |
Саркоплазма је цитоплазма мишићног влакна. Већина саркоплазме је испуњена миофибрилима, који су дуге протеинске нити састављене од миофиламената. Саркоплазма се такође састоји од гликогена, полисахарида од глукозних мономера, који ћелији даје енергију при интензивном вежбању, и миоглобина, црвеног пигмента који складишти кисеоник док није потребан за мишићну активност.[7]
Постоје три врсте миофиламената:[7]
- Дебели филаменти, састављени од молекула протеина званог миозин. У стријацијама мишићних трака, то су тамне нити које сачињавају А-бенд.
- Танки филаменти су састављени од молекула протеина званог актин. У стријацијама мишићних трака, то су лагана влакна која чине појас I.
- Еластични филаменти су сачињени од титина, великог опружног протеина; ове нити се учвршћују дебелим нитима на З диску.
Ови миофиламенти заједно раде на стварању контракције мишића.
Саркоплазматични ретикулум, специјализовани тип глатког ендоплазматичног ретикулума, формира мрежу око сваког миофибрила мишићног влакна. Мрежа је састављена од група два дилататора, названа терминални судови, и једне попречне тубуле, или Т тубуле, који пролазе кроз ћелију и излазе на другу страну; ове три компоненте заједно чине тријаде које постоје унутар мреже саркоплазматског ретикулума, у којима свака Т цев има по два терминална суда са сваке стране. Саркоплазматски ретикулум служи као резервоар за јоне калцијума, па када се акциони потенцијал шири преко Т тубула, он сигнализира саркоплазматском ретикулуму да ослобади јоне калцијума из запорних мембранских канала како би се стимулисала мишићна контракција.[7][8]
Сарколема је ћелијска мембрана пругастих мишићних влакана која прима и проводи подражаје. На крају сваког мишићног влакна, спољни слој сарколеме се комбинује са тетивским влакнима.[9] Унутар мишићног влакна притиснутог уз сарколемму налазе се вишеструко спљоштена језгра; ово мултинуклеарно стање резултат је вишеструких миобласта који су спајени при форомирању сваког мишићног влакна, при чему сваки миобласт доприноси једним језгром.[7]
Унутрашња структура
[уреди | уреди извор]
Ћелијска мембрана миоцита има неколико специјализованих подручја, која могу укључивати интеркалирани диск и попречни цевасти систем. Ћелијска мембрана је покривена слојем ламине ширине око 50 nm. Ламинарни премаз може се одвојити у два слоја; ламина денса и ламина луцида. Између ова два слоја може бити присутно неколико различитих врста јона, укључујући калцијумове.[10]
Ћелијска мембрана је причвршћена на ћелијском цитоскелету анкерским влакнима која су широка приближно 10 nm. Она се генерално налазе на З линијама тако да формирају бразде и попречне цевчице. У срчаним миоцитима ово формира ишарану површину.[10]
Цитоскелет је оно од чега се гради остатак ћелије и има две главне сврхе; прво је да се стабилизује топографију унутарћелијских компоненти, а друго је да се контролише величина и облик ћелије. Док је прва функција важна за биохемијске процесе, последња је пресудна у дефинисању односа површине и запремине ћелије. То снажно утиче на својства електричног потенцијала ћелија које се могу побуђивати. Поред тога, одступање од стандардног облика и величине ћелије може имати негативан прогностички утицај.[10]
Референце
[уреди | уреди извор]- ^ ал.], цонсултантс Даниел Алберт ... [ет (2012). Дорланд'с иллустратед медицал дицтионарy. (32нд изд.). Пхиладелпхиа, ПА: Саундерс/Елсевиер. стр. 321. ИСБН 978-1-4160-6257-8.
- ^ Мyоцyтес на US National Library of Medicine Medical Subject Headings (MeSH)
- ^ al.], consultants Daniel Albert ... [et (2012). Dorland's illustrated medical dictionary. (32nd изд.). Philadelphia, PA: Saunders/Elsevier. стр. 321 and 697. ISBN 978-1-4160-6257-8.
- ^ „Muscle tissues”. Архивирано из оригинала 13. 10. 2015. г. Приступљено 31. 07. 2019.
- ^ Scott, W; Stevens, J; Binder-Macleod, SA (2001). „Human skeletal muscle fiber type classifications.”. Physical Therapy. 81 (11): 1810—1816. PMID 11694174. Архивирано из оригинала 13. 2. 2015. г.
- ^ „Does anyone know why skeletal muscle fibers have peripheral nuclei, but the cardiomyocytes not? What are the functional advantages?”. ResearchGate. Архивирано из оригинала 19. 9. 2017. г.
- ^ а б в г Saladin, K (2012). Anatomy & Physiology: The Unity of Form and Function (6th изд.). New York: McGraw-Hill. стр. 403–405. ISBN 978-0-07-337825-1.
- ^ Sugi, Haruo; Abe, T; Kobayashi, T; Chaen, S; Ohnuki, Y; Saeki, Y; Sugiura, S; Guerrero-Hernandez, Agustin (2013). „Enhancement of force generated by individual myosin heads in skinned rabbit psoas muscle fibers at low ionic strength”. PLoS ONE. 8 (5): e63658. Bibcode:2013PLoSO...863658S. PMC 3655179
 . PMID 23691080. doi:10.1371/journal.pone.0063658.
. PMID 23691080. doi:10.1371/journal.pone.0063658.
- ^ Bentzinger, CF; Wang, YX; Rudnicki, MA (1. 2. 2012). „Building muscle: molecular regulation of myogenesis.”. Cold Spring Harbor Perspectives in Biology. 4 (2): a008342. PMC 3281568
 . PMID 22300977. doi:10.1101/cshperspect.a008342.
. PMID 22300977. doi:10.1101/cshperspect.a008342.
- ^ а б в Ferrari, Roberto. „Healthy versus sick myocytes: metabolism, structure and function” (PDF). oxfordjournals.org/en. Oxford University Press. Архивирано из оригинала (PDF) 19. 02. 2015. г. Приступљено 12. 2. 2015.
Literatura
[уреди | уреди извор]- Yaffe, David; Feldman, Michael (1965). „The formation of hybrid multinucleated muscle fibers from myoblasts of different genetic origin”. Developmental Biology. 11 (2): 300—317. PMID 14332576. doi:10.1016/0012-1606(65)90062-X.
- Wei L, Zhou W, Croissant JD, Johansen FE, Prywes R, Balasubramanyam A, Schwartz RJ (новембар 1998). „RhoA signaling via serum response factor plays an obligatory role in myogenic differentiation”. J Biol Chem. 273 (46): 30287—94. PMID 9804789. doi:10.1074/jbc.273.46.30287
 .
. - Vlahopoulos S, Zimmer WE, Jenster G, Belaguli NS, Balk SP, Brinkmann AO, Lanz RB, Zoumpourlis VC, Schwartz RJ, et al. (2005). „Recruitment of the androgen receptor via serum response factor facilitates expression of a myogenic gene”. J Biol Chem. 280 (9): 7786—92. PMID 15623502. doi:10.1074/jbc.M413992200
 .
. - Kitamura, Tadahiro; Kitamura YI; Funahashi Y; Shawber CJ; Castrillon DH; Kollipara R; DePinho RA; Kitajewski J; Accili D (4. 9. 2007). „A Foxo/Notch pathway controls myogenic differentiation and fiber type specification”. The Journal of Clinical Investigation. 117 (9): 2477—2485. PMC 1950461
 . PMID 17717603. doi:10.1172/JCI32054.
. PMID 17717603. doi:10.1172/JCI32054. - Maroto, M; Reshef R; Münsterberg A E; Koester S; Goulding M; Lassar A B. (4. 4. 1997). „Ectopic Pax-3 activates MyoD and Myf-5 expression in embryonic mesoderm and neural tissue”. Cell. 89 (1): 139—148. PMID 9094722. doi:10.1016/S0092-8674(00)80190-7
 .
. - Ito, Yoshiaki (2012). „A Systems Approach and Skeletal Myogenesis”. International Journal of Genomics. Hindawi Publishing Organization. 2012: 1—7. PMC 3443578
 . PMID 22991503. doi:10.1155/2012/759407
. PMID 22991503. doi:10.1155/2012/759407  .
. - Windner SE, Doris RA, Ferguson CM, Nelson AC, Valentin G, Tan H, Oates AC, Wardle FC, Devoto SH (2015). „Tbx6, Mesp-b and Ripply1 regulate the onset of skeletal myogenesis in zebrafish”. Development. 142 (6): 1159—68. PMC 4360180
 . PMID 25725067. doi:10.1242/dev.113431.
. PMID 25725067. doi:10.1242/dev.113431. - Maroto, M; Reshef R; Münsterberg A E; Koester S; Goulding M; Lassar A B. (4. 4. 1997). „Ectopic Pax-3 activates MyoD and Myf-5 expression in embryonic mesoderm and neural tissue”. Cell. 89 (1): 139—148. PMID 9094722. doi:10.1016/S0092-8674(00)80190-7
 .
. - Mathew, Sam J.; Hansen JM; Merrell AJ; Murphy MM; Lawson JA; Hutcheson DA; Hansen MS; Angus-Hill M; Kardon G (15. 1. 2011). „Connective tissue fibroblasts and Tcf4 regulate myogenesis”. Development. 138 (2): 371—384. PMC 3005608
 . PMID 21177349. doi:10.1242/dev.057463.
. PMID 21177349. doi:10.1242/dev.057463. - Baylies, Mary (2001). „Invertebrate Myogenesis: looking back to the future of muscle development”. Current Opinion in Genetics & Development. 66 (4): 1281—6. PMID 11448630. doi:10.1016/s0959-437x(00)00214-8.
- Laclef, Christine; Hamard G; Demignon J; Souil E; Houbron C; Maire P (14. 2. 2003). „Altered myogenesis in Six1-deficient mice”. Development. 130 (10): 2239—2252. PMID 12668636. doi:10.1242/dev.00440
 .
. - Havis, Emmanuelle; Pascal Coumailleau; Aline Bonnet; Keren Bismuth; Marie-Ange Bonnin; Randy Johnson; Chen-Min Fan; Frédéric Relaix; De-Li Shi; Delphine Duprez (2012-03-16). „Development and Stem Cells”. Development. 139 (7): 1910—1920. PMC 3347684
 . PMID 22513369. doi:10.1242/dev.072561.
. PMID 22513369. doi:10.1242/dev.072561. - Rios, Anne; Serralbo, Olivier; Salgado, David; Marcelle, Christophe (2011-06-15). „Neural crest regulates myogenesis through the transient activation of NOTCH”. Nature. 473 (7348): 532—535. Bibcode:2011Natur.473..532R. PMID 21572437. S2CID 4380479. doi:10.1038/nature09970.
- Bland, C.S; Wang, David; Johnson, Castle; Burge, Cooper (јул 2010). „Global regulation of alternative splicing during myogenic differentiation”. Nucleic Acids Research. 38 (21): 7651—7664. PMC 2995044
 . PMID 20634200. doi:10.1093/nar/gkq614. hdl:1721.1/66688.
. PMID 20634200. doi:10.1093/nar/gkq614. hdl:1721.1/66688. - Wood, Jackie D. (2009), „Gastrointestinal Physiology”, Ур.: Rhoades, Rodney A.; Bell, David R., Medical Physiology: Principles for Clinical Medicine (3 изд.), Philadelphia, PA: Lippincott Williams & Wilkins, стр. 463—496
- Thomsen, L.; Robinson, T. L.; Lee, J. C.; Farraway, L. A.; Hughes, M. J.; Andrews, D. W.; Huizinga, J. D. (1998-07-01). „Interstitial cells of Cajal generate a rhythmic pacemaker current”. Nature Medicine. 4 (7): 848—851. ISSN 1078-8956. PMID 9662380. doi:10.1038/nm0798-848.
- Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6. 3. 2013). „Smooth muscle”. Архивирано из оригинала 07. 10. 2021. г. Приступљено 10. 6. 2021.
- „Thesaurus results for STRIATED”. www.merriam-webster.com (на језику: енглески). Приступљено 22. 4. 2022.
- Song, NN; Xu, WX (2016-10-25). „[Physiological and pathophysiological meanings of gastrointestinal smooth muscle motor unit SIP syncytium].”. Sheng li xue bao: [Acta Physiologica Sinica]. 68 (5): 621—627. PMID 27778026.</ref><ref name="Sanders">Sanders, KM; Ward, SM; Koh, SD (јул 2014). „Interstitial cells: regulators of smooth muscle function.”. Physiological Reviews. 94 (3): 859—907. PMC 4152167
 . PMID 24987007. doi:10.1152/physrev.00037.2013.
. PMID 24987007. doi:10.1152/physrev.00037.2013.
Spoljašnje veze
[уреди | уреди извор]- Structure of a Muscle Cell
- Пестронк, Алан. „Мyогенесис & Мусцле Регенератион”. WУ Неуромусцулар. Wасхингтон Университy. Приступљено 2013-03-16.
- Гилберт, Сцотт Ф. Девелопментал Биологy, Сиxтх Едитион - Мyогенесис - Тхе Девелопмент оф Мусцле
