Оксазол
Изглед

| |
| Називи | |
|---|---|
| IUPAC назив
1,3-oxazole
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ECHA InfoCard | 100.005.474 |
| |
| Својства | |
| C3H3NO | |
| Моларна маса | 69,06 g/mol |
| Густина | 1,050 g/cm3 |
| Тачка кључања | 69-70 °C |
| Базност (пКб) | 0.8 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Оксазол је основа велике класе хетероцикличних ароматичних органских једињења. Они су азоли код којих су кисеоник и азот одвојени једним угљеником.[3] Оксазоли су у мањој мери ароматични од тиазола. Оксазол је слаба база. Његова коњугована киселина има pKa од 0.8, у поређењу са 7 за имидазол.[4][5][6][7]
Припрема
[уреди | уреди извор]Класични синтетички методи оксазола су
- Робинсон-Габриелова синтеза дехидрацијом 2-ациламинокетона[8][9][10]

- Фишерова синтеза оксазола из цијанохидрина и алдехида[11][12]

Други методи су исто тако познати.
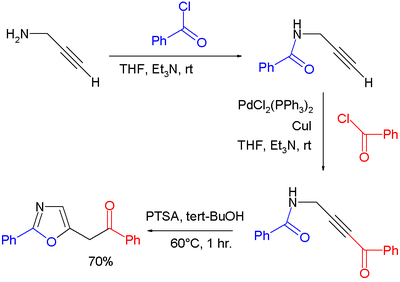
- Оксазоли се могу добити циклоизомеризацијом појединих пропаргил амида. У једној студији[13] оксазоли су припремљени путем кондензације пропаргил амина и бензоил хлорида до амида, чему је следило Соногашира спајање краја алкина са еквивалентом бензоилхлорида, и завршна циклоизомеризација каталисана п-толуенсулфонском киселином:
- У једној објављеној синтези оксазола реактанти су нитро-супституисани бензоил хлорид и изонитрил:[14]
Биосинтеза
[уреди | уреди извор]У биомолекулима, оксазоли су производ циклизације и оксидације серина или треонина нерибозомских пептида:

Где је X = H, ЦХ
3 за серин и треонин респективно, B = база.
(1) Ензиматска циклизација. (2) Елиминација. (3) [О] = ензиматска оксидација.
Оксазоли су мање заступљени у биомолекулима од сродних тиазола.
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Heterocyclic Chemistry TL Gilchrist, The Bath press (1985) ISBN 0-582-01421-2
- ^ Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ МцМуррy Јохн Е. (1992). Фундаменталс оф Органиц Цхемистрy (3рд изд.). Белмонт: Wадсwортх. ISBN 0-534-16218-5.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Robinson, R. J. Chem. Soc. 1909, 95, 2167.
- ^ Gabriel, S. Chemische Berichte 1910, 43, 134.
- ^ Gabriel, S. Chemische Berichte 1910, 43, 1283.
- ^ Emil Fischer, Chemische Berichte 1896, 29, 205.
- ^ Wiley, R. H. Chem. Rev. 1945, 37, 401.
- ^ A new consecutive three-component oxazole synthesis by an amidation–coupling–cycloisomerization (ACCI) sequence, Eugen Merkul and Thomas J. J. Müller, Chem. Commun., 2006, 4817 - 4819, . doi:10.1039/b610839c. Недостаје или је празан параметар
|title=(помоћ) - ^ Fully Automated Continuous Flow Synthesis of 4,5-Disubstituted Oxazoles Marcus Baumann, Ian R. Baxendale, Steven V. Ley, Christoper D. Smith, and Geoffrey K. Tranmer, Org. Lett.; 2006; 8(23) pp. 5231 - 5234; (Letter) . дои:10.1021/ол061975ц. Недостаје или је празан параметар
|титле=(помоћ)