Тумори лобањске дупље
| Тумори лобањске дупље | |
|---|---|
 | |
| МРТ (Т2): примарни лимфом ЦНС. | |
| Класификација и спољашњи ресурси | |
| Специјалност | неурологија неурохирургија онкологија |
Тумори лобањске дупље, интракранијални тумори, тумори мозга, тумори ЦНС[а] су новотворевине у интракранијуму или лобањској дупљи које се развијају на нервном ткиву и крвним судовима мозга, можданим опнама, унутарлобањским деловима можданих живаца, ембрионалним дефектима, хипофизи, епифизи и унутрашњој површини кранијума. Ова врста тумора има прогресивни растући ток и у својој еволуцији разара, замењују или потискују мождано ткиво и раније или касније доводе до повећања интракранијалног (унутарлобањског) притиска.[1][2]
Тумори лобањске дупље су засебна и хетерогена група новотворевина, чије су особине, на више нивоа, различите у односу на туморе других органских система.[3] Наиме разлика између доброћудних и злоћудних унутарлобањских тумора је мање изражена него код тумора других система, јер могу довести до тешког неуролошког испада или убрзаног смртног исхода. Код тумори лобањске дупље долази до пораста притиска унутар лобањске шупљине због раста туморске масе, едема (отока) који захвата углавном белу мождану масу, или због препрека у нормалној циркулацији мождане течности (ликвора). Управо је због раста, експанзије и ограничене могућности ширења тумора унутар коштаног оклопа лобањске дупље сваки процес, па био он и доброћудан, по своме понашању је злоћудан и захтева хитну неурохируршку интервенцију.[2]
| „ | Значај волумена тумора лобањске дупље за преживљавање оболелих, јасно истиче Сwансон,[4] који у свом чланку дефинише време преживљавања оболелог од нпр астроцитома мозга као временски интервал потребан да тумор запремине А (волумен тумора на првом ЦТ) досегне запремину Б (волумен тумора на аутопсији). Зато је нпр код астроцитома мозга, већег преоперативног волумена, евидентно краће преживљавање оболелих и обрнуто.[5][6] | ” |
Од примарних неоплазми ЦНС-а нешто више од половине су астроцитоми, односно око четвртина од укупног броја тумора лобањске дупље. Карактеристике клиничке слике оболелих од тумора лобањске дупље може бити условљен, локализацијом процеса, али и биолошким особинама тумора (брзина раста, инфилтративност, величина перифокалног едема), као и индивидуалног стања болесника (нпр. сенилна атрофија мозга код старијих болесника). Биолошке особине тумори лобањске дупље везане су за његову патохистолошки градус, а на компјутеризованој томографији се, између осталог, испољавају и величином туморске масе.[7]
Епидемиологија
[уреди | уреди извор]Тумори мозга могу да потичу из неуронских елемената унутар мозга, или представљају метастазе удаљених тумора. Примарни тумори лобањске дупље настају из ткива ЦНС и на њих отпада око половина свих неоплазми лобањске дупље. Преостали део неоплазми лобањске дупље узрокован је метастатским лезијама примарних тумора локализованих у другим деловима тела.[8]
Код одраслих особа, две трећине примарних тумора мозга настаје из структура изнад тенторијума (супратенторијални тумори), док код деце, две трећине тумора мозга настаје из структура испод тенторијума (инфратенторијални тумори) [б]. Глиоми, метастазе, менингиоми, аденоми хипофизе и акустични неуриноми чине 95% свих тумора мозга.
- Морбидитет и морталитет
Учесталост примарних тумора мозга у САД износи 8,2 (или у распону од 7-19,1), на 100.000 становника годишње. Код деце учесталост је од 1 до 5 на 100.000 деце годишње. Метастатски тумори на мозгу јављају се у САД у 200.000 пацијената годишње. Морталитет од тумора мозга у САД износи 5 случајева на 100.000 одраслих особа. У Сједињеним Америчким Државама у 1999, примарни карциноми централног нервног система били су узрок смрти око 13.100 особа[2][8].
На међународном нивоу учесталост тумора ЦНС није позната, али се сматра да је слична оној у Сједињеним Државама.
Најбројнији примарни унутарлобањских тумора су астроцитоми високог степена злоћудности који чине око 38%, док менингеоми и други мезенхималне тумори чине око 27% примарних тумора. Морталитет, на међународном ниво, примарних тумора ЦНС је 4,7 на 100.000 становника годишње[2] и трећи је по учесталости узрок смрти од злоћудних болести код особа старости од 15 до 34 године.[9] Метастатски тумори чине око 40-50% свих можданих тумора[8], а најчешће су то метастазе карцинома плућа и дојке[10].
| Дистрибуција тумора ЦНС по хистолошким подтиповима ЦБТРУС 1998–2002 (Н=63.968)[11] | |
| Хистологија | Проценат |
| Глиобластоми* | 20,3 |
| Астроцитоми* | 9,8 |
| Олигодендроглиоми* | 3,7 |
| Епендимоми* | 2,3 |
| Ембрионалне тумор (нпр. Медуллобластом) | 1,7 |
| Тумора омотача периферних живаца | 8,0 |
| Менингиоми | 30,1 |
| Линфоми | 3,1 |
| Краниофарингиомаи | 0,7 |
| Тумори хипофизе | 6,3 |
| Остали | 14,0 |
| (*) У ЦНС поновљени глиоми. 40% свих врста тумора и 78% малигних тумора. | |
- Анатомска локализација тумора
У зависности од анатомске локализације, тумора у лобањској дупљи, тумори мозга могу бити малигног тока, без обзира на хистолошке особине. Веома ретко метастазирају изван централног нервног система, али су склони инфилтрацији околног ткива. Метастазе системских малигних тумора чешће су код одраслих са пратећим тумором ЦНС, 15% болесника умрлих од карцинома имало је промене у ЦНС. Патохистолошка природа тумора утиче на клиничку слику и прогнозу болести, при чему је анатомска локализација тумора исто тако може бити лош прогностички знак као и малигност тумора.[7]
- Старост
Примарни унутарлобањски тумори су трећи најчешћи узрок смрти од злоћудних болести код особа старости од 15 до 34 године[2]. Примарни тумори имају највећу учесталост код болесника старости од 60 до 69 година, док је други период највеће учесталости између 5 и 9. године живота.[12] Тумори мозга су друге најчешће новотворевин код деце, које чине 15-25% свих малигних педијатријских болести, одмах иза леукемија, и најчешћи су солидни тумори у деце и адолесцената, са годишњом инциденцом од 27 на 1.000.000 особа млађих од 20 година. Тумори мозга чине више од 90% примарних тумора ЦНС код деце.[13]
Више од половине (око 55%) свих тумора мозга локализовано је у задњој лобањској јами.[13][14] Такође одређени хистолошки типови тумора настају у специфичним старосним групама, нпр. медулобластом у деце, а глиобластом у старијих особа.[13]
- Раса
Инциденца унутарлобањских тумора највећа је код припадника беле расе.[2][15] Етничке разлике се виде и између етничких група унутар исте земље, и могу бити и до три пута различите учесталости између земаља широм света. Према тим извештајима развијене земље наизглед имају највеће стопу учесталости тумора ЦНС, али то можда бити и последица бољег системе евиденције тумора, а не учесталости.[2]
- Пол
Примарни унутарлобањски тумори имају минимално већу преваленцију код мушкараца (55% ), уз изузетак менингеома који су готово двоструко чешћи код жена[2][16].
Хистолошка класификација тумора лобањске дупље
[уреди | уреди извор]Према класификације СЗО из 2007. тумори лобањске дупље груписани су према биолошком потенцијалу, у четири степена (од I до IV), што представља полазну тачку на скали њихове агресивности (малигности)[3]. Тумори ниског степена имају бољу прогнозу, те се први степен односи на туморе са стабилном хистолошком сликом, без очекиване прогресивне трансформације. У складу са четири кључна хистолошка обележја, злоћудне туморе централног нервног система са високим биолошким потенцијалом карактерише висока целуларност, митотичка активност ћелија, ендотелна пролиферација и некроза, са постављањем дијагнозе на основу најзлоћуднијег подручја унутар тумора[17] [18].
Класификација СЗО[3] заснива се на претпоставци да сваки тип тумора постаје абнормалан растом специфичног типа ћелија, те су зато дефинисане две основне групе тумора, неуроепителијални тумори и тумори који су пореклом из других врста ћелија[1]
Етиологија
[уреди | уреди извор]У поређењу са другим најчешћим малигним туморима, медицина релативно мало зна о интракранијалним туморима, упркос њиховог значајног утицаја на појаву инвалидности и скраћење година живота оболелих особа. За то постоји неколико разлога;
Прво, као група тумора они су релативно ретки; нпр. према подацима из Велике Британије од 4.532 малигних и 3.470 немалигних тумора регистрованих у 2006; на интракранијалне туморе отпада мање од 2% од свих малигних тумора[19].
Друго, они обухватају велики број различитих хистолошких типова; према задњој хистолошкој класификацији СЗО интракранијалних тумора, идентификовано је више од 130 различитих врста, а промена овог система класификације у последњих двадесет година вршена је доста често, што је отежало спровођење дугорочних студија истраживања етиолошких фактора[20].
На основу данашњих сазнања о канцеру као биолошком феномену, интракранијални тумори се схватају као наследна болест, а процес канцерогенеза као комплексна међузависност фактора генетике и средине. У случају тумора мозга, који због своје локализације и постојања крвно – мождане баријере нису непосредно изложени дејству егзогених чинилаца, фактори генетике би можда могли бити од већег значаја[21][22][23]
У великом броју случајева, етиологија интракранијалних тумора је непозната, а као могући етиолошки чиниоци у литератури се наводе[24][25]:
Изложеност јонизујућем зрачењу
Јонизујуће зрачење се у бројним изворима наводи као могући иницијални фактор у расту тумора ЦНС и доказани фактор ризика за педијатријске интракранијалне туморе. Већина тумора деце последица је радиотерапије других кранијалних неоплазми. Деца, код које је примењено зрачење централног нервног система у лечењу акутне лимфатичне леукемије, имају седам пута већи ризик за развој секундарне неоплазме и двадесет пута већи ризик за интракранијалне туморе. Најчешће неоплазме су астроцитоми и менингеоми. Деца мајки које су пренатално зрачене у дијагностичке сврхе такође имају већи ризик за настанак интракранијалне туморе[26]
Имуносупресија
Имуносупресија се виђа нпр. код болесника са примарним лимфомом мозга, било код оних лечених имуносупресивном терапијом због трансплантације бубрега или костне сржи, било код оних са АИДС-ом
Изложеност винил хлориду
До примарне изложености винил хлориду долази удисањем. Дуготрајна изложеност може да изазове рак јетре, мозга, крви или плућа. Винил хлорид је, према Међународној агенцији за истраживање рака, класификован у групу 1 карциногена, што значи да представља сигурни узрок рака код људи.
Изложеност вирусима
У експерименталним условима показано је да се уносом онкогених вируса могу изазвати тумори мозга (РНА туморски вирус, Роус сарцома вирус, Полyома вирус сарком менингеа)
Траума и инфекције
Као могући, али истраживањима недовољно потврђени, узроци тумора ЦНС наводе се трауме и инфекције главе.
Хемотерапија
Примену цитостатика у хемотерапији често прате и њихова нежељена дејства. Они не делују селективно само на примарни малигни процес-тумор, већ „уништавају“ у већој или мањој мери и део здравих ћелија што може резултовати појавом бројних нежељених реакција па и интракранијалних тумора.
Хормонски поремећаји
Већа учесталост глиома у мушкараца, а менингеома у жена не може се објаснити другим факторима осим хормонским[27].
Акумулација генских поремећаја
Према бројним изворима они се наводе као један од значајнијих етиолошких фактора у настанку примарних интракранијалних тумора. Наиме акумулацијом генских поремећаја, ћелије избегавају нормалне регулационе механизме и уништење од стране имунског система[28]. Зато различити наследни синдроми могу бити предиспонирајући фактор у појави тумора, међу њима доминирају неурофиброматоза, туберозна склероза, вон Хиппел-Линдауова болест, Турцотов синдром и Ли-Фраумени синдром.
Поремећаји хромозома имају значајну улогу у настанку тумора. Губитак хромозома 17p виђа се у болесника са астроцитомом ниског степена малигности[29][30], а губитак дела хромозома-10 везан је уз појаву мултиформног глиобластома[31][32]. Претпоставља се да делеције хромозома резултује губитком туморских супресорских гена који нормално спречавају настанак тумора, (нпр повезаност настанка менингеома са мултиплим делецијама хромозома-22 ). Насупрот овоме, прото-онкогени као c-cis, c-erbB, gli, c-MIC i n-ras могу бити претерано изражени у неких тумора[28]. Разлике између клиничко-патолошких ентитета астроцитома последица су типа и редоследа генетичких поремећаја стечених за време трансформације.
Више је молекуларних механизама укључено у настанак глиома и њихову прогресију у малигније туморе. Прогресија глиома ниског у глиома високог степена малигности везана је са инактивацијом p53 туморског супресорског гена на хромозому 17 p i s прејаком експресијом фактора раста који потиче од тромбоцита (енгл. platelet-derived grovth factor – PDGF)[33]. Настанак глиобластома укључује појачавање рецептора епидермалног фактора раста (енгл. epidermal grovth factor receptor – EGF-R) и експресију фактора ангиогенезе као што је васкуларни ендотелни фактор раста (енгл. vascular endothelial grovth factor – VEGF)[34][35]. Различита истраживања показала су имуносупресију код болесника који болују од глиобластома.
Бројни имуносупресивни молекули, као трансформишући фактор раста – б (енгл. transforming grovth factor – b), интерлеукин-10 и простагландин Е2 укључени су у потискивање ћелијског имунског одговора у болесника са глиомом[36][37])
| Карактерисике хромозомских и генских аберација интракранијалних тумора[38][39] | ||
| Тип тумора | Хромозомске абнормалности | Генске алтерације |
|---|---|---|
| Астроцитом I степена | ТП53 недостају мутације | |
| Астроцитом II степена | ТП53 мутације у 60% уколико прогредира у ГБМ[40] | |
| Глиобластом мултиформни | +7 | непознате |
| -9п | ЦДКН2А, ЦДКН2Б | |
| -10 | ПТЕНИ МИМАЦ1 Мутација гена | |
| -17п | П53 мутација | |
| Дмин | Амплификација ЕФГР гена | |
| Олигодендроглиом | -1п,19q | непознате |
| Медулобластом | -17п | непознате |
| Неурофиброматоза I степена | 17q12 | Мутација НФ1 гена |
| Неурофиброматоза II степена | 22q12 | Мутација НФ2 гена |
Метастазе у лобањској дупљи примарног тумора другог органског система најчешћи су унутарлобањски тумори код болесника старије животног доба. Према учесталости на првом месту су метастазе карцинома плућа, дојке, меланома, карцинома бубрега и дебелог црева. Унутарлобањско ширење метастатског карцинома одвија се претежно артеријском циркулацијом, а ређе Батсоновим венским плексусом [в], код болесника са гастроинтестиналним и карличним туморима. унутарлобањске метастазе се дијагностикују у отприлике 24% болесника који умиру од злоћудних тумора. Учесталост је значајно већа у одраслој и старијој животној доби, док је инциденца код деце око 6%.
Унутарлобањске метастазе су, типично овалне, добро ограничене лезије на граници сиве и беле масе, окружене обимним вазогеним едемом насталим као последица нарушене функције крвно-мождане баријере. У нешто више од 50% болесника јављају се вишеструке метастазе, са већом вероватноћом умножавања код болесника са карциномом плућа или дојке, меланомом итд. Већина унутарлобањских метастаза (80%) су лезије мозга и меких можданих омотача, локализоване супратенторијално, док је остатак локализован на дури и костима лобање. Унутармождано крварење је учесталије код метастаза меланома и карцинома бубрега.
Патогенеза
[уреди | уреди извор]Патогенетски гледано свака новотворевина у лобањској дупљи има прогресивни растући ток и у својој еволуцији разара, замењује или потискује мождано ткиво и раније или касније доводи до повећања интракранијалног притиска. Тумори мозга производе неуролошке манифестације кроз низ механизама међу којима су најважнији:
- Разарање можданог паренхима и одређених нервних путева,
- Пораст интракранијалног притиска
Патохистолошка природа тумора утиче на клиничку слику и прогнозу болести, при чему локализација тумора може бити лош прогностички знак као и малигност тумора, исто као што и хистолошка малигност тумора представља примарно лош прогностички знак и када је тумор приступачан хируршкој интервенцији, (нпр на конвекситету мозга).
Пораст интракранијалног притиска основни је покретач свих патофизиолошких процеса и пратећих поремећаја код тумора мозга. Тотални волумен интракранијалне (унутарлобањске) дупље је сталан те промене у волумену мозга и његових омотача или промене волумена крвних судова и крви или цереброспиналне течности настаје на рачун волумена једног од ових ткива или течности.
На интракранијални притисак утичу четири фактора:
- Увећање масе мозга (изражен пораст масе мозга доводи до хернијације делова мозга због пораста локалног притиска у ограниченим деловима лобањске јаме, пошто је лобања подељена фалксом и тенторијумом)
- Поремећај церебралне циркулације (компресија вена и венских синуса повећава притисак што је додатни фактор увећања можданог едема. Притисак на артерије редукује проток и често изазива артеријску хипертензију)
- Поремећај циркулација цереброспиналне течности (многи тумори ремете проток ликвора и нарочито ако су локализовани у задњој лобањској јами и изазивају пораст интракранијалног притиска)
- Код деце, застој доводи до хидроцефалуса, док код одраслих повећање интракранијалног притиска доводи до структурних оштећења можданог паренхима)
Клиничка слика
[уреди | уреди извор]У тренутку када врло мали пораст волумена тумора може резултирати значајним растом тлака, настаје опасност од транстенторијске и тонзиларне хернијације, коме и смрти. Неуролошки испади овисе о смјештају тумора, а укључују моторне или осјетне испаде, хемианопсију, афазију или комбинацију наведенога у супратенторијских тумора, те парезе кранијалних живаца и дисфункцију малог мозга у болесника с тумором стражње лубањске јаме
Симптоми и знаци клиничке слике интракранијалних тумора у директној су зависности од локализације, величине (масе), околног едема и брзине раста тј инфилтрације и деструкције можданог ткива. У тренутку када врло мали пораст волумена тумора резултира значајним порастом притиска, настаје опасност од транстенторијске и тонзиларне хернијације, коме и смрти. Неуролошки испади зависе о локализације тумора, а укључују моторне или осећајне испаде, хемианопсију, афазију или комбинацију наведену код супратенторијских тумора, те парезе кранијалних живаца и дисфункцију малог мозга у болесника са тумором задње лобањске јаме.[41]
- Спорорастући тумори лобањске дупље
Спорорастући тумори изазивају масивно увећање нормалних структура, те су најчешће већ јако велики у тренутку испољавања симптома. Слободан простор лобањске дупље, који код здравих одраслих особа износи просечно 150 cm³, ограничава могућност компензације промена односа унутар лобање.
Мало већа могућност ширења процеса унутар лобање постоји код деце која још немају затворене шавове костију лобање[42] и старијих људи код којих је мозак атрофичан, што у почетку ствара у лобањи више места за ширење евентуалних туморских израслина, па зато ће оне тек касније дати симптоме.
- Брзорастући тумори
Ови тумори врло рано изазивају симптоме и зато се код њих први клинички знаци јављају док су туморске новотворевине још релативно мале.
Ако симптоми и знаци повишеног интракранијалног притисак претходе почетку локалних неуролошких дисфункција, врло је вероватно да се ради о тумору мождане коморе или дубоких структура средње линије. Ако су локализовани знаци (епилептички напади, атаксија, сметње вида, кранијалне неуропатије или дисфункција кортикоспиналног пута) доминантни у одсутности повећаног интракранијалног притисак, највероватније тумор потиче из паренхимских структура (мождане хемисфере, мождано стабло или мали мозак).
Тумори могу бити добро ограничени од околног ткива (капсулирани), а могу бити и инфилтративни и тиме уништавати нервне ћелије и ометати им функцију[43].
| Знаци | Карактеристике |
|---|---|
| Општи знаци | Настају као последица повећаног интракранијалног притисак (ИКП). Повишен интракранијални притисак одговоран је за класични тријас симптома: главобољу, мучнину и повраћање. |
| Жаришни или фокални знаци или неуролошки „испади“ | Настају као последица директног притиска или инфилтрације туморског ткива у одговарајућа подручја ЦНС. |
Општи знаци и симптоми унутарлобањских тумора
[уреди | уреди извор]Међу општим знацима унутарлобањских тумора најчешће се наводе главобоља, повраћање и промене на очном дну у облику тзв. застојне папиле ока.
Код унутарлобањских тумора главобоља може настати због притиска или растезања структура осјетљивих на бол (тврде мождане опне, венских синуса, артерија на бази мозга или можданих живаца који преносе осећај бола). Главобоља као симптом се нешто раније јавља код тумора у задњој лобањској јами, често је пулсирајућег карактера или “жарења”, постепено се појачава и најизраженија је рано ујутро, мада се понекад јавља и у току ноћу. Обично се појачава при активностима које повећавају притисак унутар лобање: физичко напрезање, кашаљ, кијање, напрезање у току нужде, сношаја итд. У почетку, централни нервни систем, својим компензаторним механизмима, дозвољава латентну фазу тј. фазу адаптације мождане масе на едем, што се клинички манифестује периодицитетом у јављању главобоље, као и у њеном интензитету и трајању. У том периоду, локализација главобоље је у највећем броју случајева везана за регионалну диференцијацију тумора, да би, након исцрпљивања поменутих компензаторних механизама и настајања дифузног едема мозга, и главобоља постала дифузна и континуирана током целог дана.[44]
Промене на очном дну
Такозвана застојна папила, настаје због застоја крви у венама очног дна услед пораста унутарлобањског притиска. Застојна папила се јавља врло рано код тумора малог мозга, али и код других поремећаја у лобањи.
Један од најчешћих знакова унутарлобањских тумора је повраћање, које се манифестује у јутарњим часовима. Наступа нагло, у виду лучног млаза, без претходне мучнине. Као знак болести повраћање је присутно је у 50 посто случајева унутарлобањских тумора.
Један од чест симптом који се јавља први пут у животу болесника (у виду изненадног губитка свести са грчевима екстремитета, пеном на устима, угризом језика или спонтаним мокрењем, или у облику сужења свести са грчењем једне руке или руке и ноге једнострано и грчењем мишића лица) који такође указује на повишен притисак унутар лобање је епилептички напад.
Остали знаци и симптоми.
У остале знаке и симптоме унутарлобањских тумора спадају; несигурност и губитак равнотеже, вртоглавица, поремећај интелектуалних функција (знаци лагане занесености, осјећајне тупости, знаци успорења интелектуалних функција, заборавност, општа успореност, сметње апстрактног мишљења, поспаност, депресија), знаци поремећене свести (од поспаности до коме) те поремећаји вегетативних функција (поремећај пулса, крвног притиска, ритма и правилности дисања), такође су веома често присутни знаци интракранијалних тумора код многи болесника.
| {[центер|Општи знаци и симптоми унутарлобањских тумора}} | |
Знаци и симптоми |
Манифестације
|
|---|---|
| |
| |
| |
| |
| |
| |
| |
| |
Жаришни супратенторијски и инфратенторијских мождани симптоми
[уреди | уреди извор]Жаришни знаци и симптоми поремећаја функција појединих подручја централног нервног система, који помажу у локализацији туморског процеса
| |
| Локализација тумора | Знаци и симптоми |
|---|---|
| Чеони режањ |
|
| Слепоочни режањ |
|
| Потиљачни режањ |
|
| Темени режањ |
|
| Мали мозак |
|
| Мождано стабло |
|
| Кичмена мождина |
|
| Хипофиза |
|
| Мождане опне |
|
Дијагноза
[уреди | уреди извор]
Дијагноза тумора лобањске дупље наилази на многобројне потешкоће, нарочито у раним фазама болести, код спорорастућих тумора, када су најчешће недовољно изражени и нејасни знаци и симптоми који би упућивали на постојање новотворевина у интракранијалном простору. Како су унутарлобањске структуре окружене костима оне нису доступне спољашњем прегледу и зато су уведене различите и многобројне дијагностичке методе за доказивање присуства тумора лобањске дупље. Рутинска примена компјутеризоване томографије (ЦТ) и магнетне резонанце (МР), значајно је убрзала дијагностику можданих тумора. Примена најсавременијих дијагностичких метода, позитронске емисионе томографије (ПЕТ) и емисионе томографије једног фотона (СПЕЦТ) даје нове квалитете што се тиче прецизнијег препознавања хистолошких, биолошких и биохемијских карактеристика тумора, тј. њиховог типа и градуса, методама неурорадиолошке визуелизације.

1. Анамнеза
[уреди | уреди извор]Добро узети анамнестички подаци о тегобама прикупљени од самог болесника или чланова породице, могу указати на постојање процеса у лобањској дупљи и правилно усмерити даљи ток дијагностике и лечења.
2. Објективан (физикалан) преглед
[уреди | уреди извор]Објективним клиничким физикалним прегледом неуролога, офталмолога и других лекара специјалиста, могу се прикупити важни подаци, којима се утврђују различити знаци и симптоми интракранијалних процеса (види табеле испод),
3. Електроенцефалографија
[уреди | уреди извор]Електроенцефалографија (ЕЕГ) је посебна неурофизиолошка метода која региструје мождану електричну активност преко електрода смештених на поглавини (што је најчешћи вид коришћења) или субдурално односно унутар можданог ткива. Резултујући дијаграм је познат као електроенцефалограм (ЕЕГ). ЕЕГ бележи мождане таласе који су према фреквенцији подељени на делта таласе (активност до 4 херца), тета таласе (од 4 до 8 херца), алфа таласе (од 8-12 херца) и бета таласе (преко 12 херца). У патолошким стањима (епилепсија, енцефалопатија, мождани удар или друге структурне лезије мозга) мождани таласи имају свој специфичан ЕЕГ запис, захваљујући којем је ЕЕГ уврштен као дијагностичка метода у испитивању интракранијалних процеса.
4. Лабораторијске анализе]
[уреди | уреди извор]Лабораторијском анализом цереброспиналног ликвора могуће је утврдити број и изглед ћелија (цитоцентрифугирање), садржај глукозе и протеина, алфа-фетопротеин (AFP), хуманог хорионског гонадотропина (hCG).
5. Сликовне (радиолошке) методе
[уреди | уреди извор]Примена сликовних или радиолошких метода у дијагностици тумора није само процена структуралних абнормалности и откривање компликација, већ обухвата приказ функционалних, хемодинамских, метаболичких, ћелијских и цитоархитектонских поремећаја. Тиме се описују морфолошке и биолошке особине са циљем откривања и степеновања интракранијалних тумора и процене ефикасности одговора организма на лечење и прогнозу.
- 5.1. Компјутеризована томографија
Компјутеризована томографија (CT) је важна у дијагностици интракранијалних тумора, а посебно када даје увид у локализацију и величину процеса, евентуалну мултицентричност (нпр. код метастаза), увид у однос према околним структурама и њиховом померању, израженост едема који се приказује у подручјима хиподензитета те приказ вентрикуларни комора и величине евентуалног хидроцефалуса. -ЦТ}- је кориснији од магнетне резонанције у евалуацији коштаних лезија и откривању калцификација у тумору. ЦТ-дијагностика, представља једну од најзаступљенију метода визуелизације тумора мозга, због њене високе поузданости (око 98%), кратког времена и нижих трошкова снимања, као и због веће заступљености по регионалним центрима у односу на конкурентне методе.[45]
Претрага је повезана с одређеном дозом зрачења којој је болесник изложен, па се индикације за примену овог испитивања морају врло прецизно одредити како би се избегло непотребно озрачивање болесника[46].
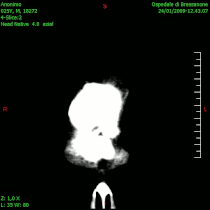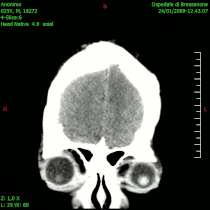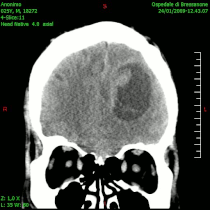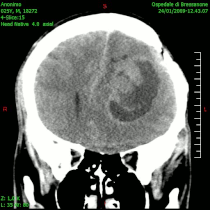
- ЦТ неких облика унутарлобањских тумора
-
Компјутеризована томографија глиобластома
-
Менингеом
-
Медулобластом
- 5.2. Магнетна резонантна томографија
МР представља супериоран метод у морфолошкој дијагностици тумора мозга. Снимање магнетном резонанцом (МРТ) ендокранијума и кичмене мождине данас је веома примењивана метода у дијагностици болести ЦНС не само код одраслих већ и у популацији педијатријских болесника. Она је супериорна у односу на компјутеризовану томографију (ЦТ), нарочито код испитивања унутарлобањских и спиналних лезија, због своје дијагностичке прецизности и одсуства јонизујућег зрачења.
| „ | Захваљујући МР, могуће је видети однос тумора са елементима базе мозга, пре свега кранијалним нервима и крвним судовима, као и структурама горњих и доњих делова можданог стабла. Предности МР у односу на ЦТ јесте висококонтрастна резолуција слике, могућност реконструкције слике у више равни, одсуство коштаних артефакта, могућност приказивања унутарлобањских крвних судова. МР решава и диференцијално дијагностичке дилеме у односу на цереброваскуларне инзулте или хематоме у ресорпцији, проистекле након реализације ЦТ код оболелих од нискоградусних астроцитома. Код оболелих од глиобластома у односу на апцесе и мултипле метастазе. Захваљујући својим могућностима и карактеристикама, МР се квалификовала и као метода избора код постоперативног дефинисања обима хируршке ресекције глиома.[47] | ” |
- МРТ неких облика примарних и секундарних интракранијалних тумора
-
Олигодендроглиом
-
Медулобластом
-
Метастаза меланома у левој хемисфери
- 5.3. Радиографија лобање
Нативна радиографија лобање циљано се никада не индикује код нпр астроцитома моyга, за разлику од примене у дијагностици неких других типова унутарлобањских тумора, јер код астроцитома не игра никакву улогу.
- 5.4. Ангиографија
Магнетска резонантска ангиографија (MRA) помаже у преоперативној визуелизацији анатомски нормалних крвних судова и крвних судова тумора. У данашњим условима, пре него што се неурохирург упусти у оперативно лечење тумора мозга, туморску промену визуелизује захваљујући претходно реализованој компјутеризованој томографији или магнетној резонанци. Ређе се одлучује за реализацију церебралне ангиографије, и то у циљу диференцијалне дијагнозе према другим типовима тумора или уопште мас лезија, и прецизирања положаја тумора у односу на васкулатуру ендокранијума.
6. Лумбална пункција
[уреди | уреди извор]Лумбална пункција се предлаже код диференцијално дијагностичке нејасне ситуације и сумње на менингеалну карциноматозу, базални менингитис и M. Lyme.
Лумбална пункција је контраиндикација код деце са инфратенторијалним тумором и код деце са хидроцефалусом због опструкције цереброспиналног ликвора, јер може довести до хернијације мозга. Зато се код деце са симптомима повишеног унутарлобањског притиска лумбална пункција одлаже до хируршког захвата или постављања шанта[48].
7. Позитронска емисиона томографија
[уреди | уреди извор]Позитронска емисиона томографија (ПЕТ) је корисна за евалуацију унутарлобањских тумора, јер омогућава визуелизацију (сликовно приказивање) метаболичке разлике између нормалних и малигних ћелија. Астроцитоми и олигодендроглиоми су хипометаболички док анапластички астроцитоми и глиобластом мултиформе су хиперметаболички. -ПЕТ}- је корисна у утврђивању: степена малигности тумора, прогнози, одређивању места биопсије, разликовању ремисије тумора од постхируршких промена, некрозе, ожиљака и едема (у болесника који су се подвргли радио или хемотерапији).
8. Стереотаксична биопсија
[уреди | уреди извор]Стереотаксична биопсија се најчешће препоручуј код фокалних лезије које се обично не могу потврдити ни клиничким налазима ни радиографски. Ова метода служи да се дође до узорака унутарлобањских тумора који даје јасне индикације о типу малигног оштећења и врсти терапије коју треба применити за лечење пацијента. Такође, биопсија омогућава да се дође до сигурног закључка да ткиво у зони оштећења нема малигне карактеристике, чиме се отклања свака сумња у његову злоћудност[49].
Терапија
[уреди | уреди извор]I поред значајног развоја нових метода лечења, на почетку 21. века, постигнуто је тек скромно побољшање петогодишњег преживљења болесника са интракранијским туморима.[50] Лечења интракранијалних тумора је сложен процес који најчешће захтева мултидисциплинарни притуп тима стручњака у којем, поред онколога, учествују неурохирург, неуроонколог, офталмолог, неурорадиолог, неуропатолог, психолог, ендокринолог, физијатар, а по потреби и други субспецијалисти.
Правовремено лечење најчешће побољшава шансе за добар исход интракранијалних тумора, и првенствено зависи од локализације, величине, врсте тумора и општег здравственог стања оболеле особе.
Циљ лечења интракранијалних тумора може бити; излечење или олакшање тегоба. Зависно од задатог циља лечење је најчешће комбиновано; применом хируршких метода, радиотерапије и хемотерапије.
Хируршко лечење
[уреди | уреди извор]| Циљеви | Бенефити хируршког лечења |
|---|---|
Продужење живота |
У случајевима када је потпуно одстрањење тумора немогуће, знатна редукција масе тумора уз постоперативну примену радиотерапије и хемотерапије продужује и поправља квалитет живота оболеле особе. |
Побољшања симптома |
Одстрањењем тумора долази до декомпресије околног можданог ткива чиме се у мањој или већој мери поново успостављају његове функције. |
Редукција ћелија |
Хируршко лечење је једини начин код кога се туморске ћелије, уз уништавање и физички одстрањују из организма. Сматра се да и делимично уклањање тумора има позитиван учинак, због смањења интракранијског притиска, прекида крвно-мождане баријере и стварања простора за раст тумора, чиме се постиже циклус раста ћелија тумора. Наведене промене омогућавају појачану изложеност тумора хемотерапеутицима и бољи одговор тумора на хемотерапију и радиотерапију. |
Повећање осјетљивости на радиотерапију и хемотерапију |
Истраживања које су се бавиле проучавањем механизама раста унутарлобањских тумора показале су да редукција туморске масе подстиче на раст до тада мирне ћелије, чинећи их сензитивнијим на друге методе лечења. |
Постављање коначне дијагнозе |
Након хистопатолошке анализе одстрањеног туморског ткива хируршким путем поставља се коначна дијагноза и одређује даљи правац лечења |
Радиотерапија
[уреди | уреди извор]Радиотерапија се примјењује на масу тумора и до 2 цм околног ткива, са могућношћу хиперфракциониране радиотерапије, односно примене честих фракција мањих доза зрачења на мању површину можданог ткива.
Прецизнија примена већих доза зрачења могућа је стереотаксијском радиохирургијом, уз смањење изложености нормалног можданог ткива зрачењу.
Брахитерапија, односно интерстицијска радиотерапија може се користити за лечење добро ограничених тумора пречника <5 цм, са имплантацијом радиоактивног материјала у ткиво тумора.
Хемотерапија
[уреди | уреди извор]Циљ хемотерапије интракранијалних тумора је контрола раста тумора и побољшање квалитете живота болесника. Хемотерапија продужује преживљење, нарочито болесника са анапластичним астроцитомом, олигодендроглиомом и лимфомом, док је глиобластом често на хемотерапију резистентан.[51]
Прогноза и компликације
[уреди | уреди извор]Понашање унутарлобањских тумора зависи од основног типа ћелија од којих се он састоји, што се најбоље може видети у класификацији СЗО која одређује избор лечења и прогнозу. Упркос значајном развоју нових метода лечења интракранијалних тумора у последњих двадесет година, достигнуто је тек скромно побољшање до петогодишњег преживљења болесника.[50]
Основне компликације унутарлобањског (интракранијалног) раста тумора повезане су са разарањем нервног ткива, директним компресивним ефектом и у неким случајевима, опструкцијом ликворских путева (хидроцефалус) и компресијом крвних судова (инфаркт).
Преживљење болесника са злоћудним глиомима, који су најчешћи примарни тумори, ограничено је упркос комбиновању различитих приступа лечењу. Преживљење углавном зави о хистопатологији тумора, његовом положају у лобањи и старости болесника. Старост је важан прогностички чинилац. Зато млађи болесници са глиомима имају дуже преживљење. Просечно преживљење болесника са глиобластомом применом тренутних метода лечења износи мање од 9 месеци. Чак и након примене агресивне комбинације лечења, (хируршко, хемотерапија и радиотерапија) долази до рецидива глиобластома између 6 и 12 месеци након лечења, а код анапластичног астроцитома у нешто дужем периоду од 18 до 36 месеци[52].
Прогноза унутарлобањских тумора
| |||
| Врсте интракранијалних тумора | Преживљавање до пет година (у %) |
Средња животна доб | Учесталост (у %) |
|---|---|---|---|
| Глиобластоми | 5,5 | 62 | 27,7 |
| Астроцитоми | 32,5 | 50 | 26,6 |
| Менингеоми | 91,3 | 61 | 21.9 |
| Неуриноми | 96,3 | 52 | 3,5 |
| Анапластични Астроцитоми | 18,2 | 54 | 2,8 |
| Олигодендроглиоми | 60,6 | 43 | 2,1 |
| Медулобластоми | 60,4 | 12 | 2,2 |
| Примарни лимфоми | 21,4 | 64 | 1,3 |
Напомене
[уреди | уреди извор]- ^ Због појмовне истородности у тексту се равноправно користе терминини; интракранијални тумори, тумори лобањске дупље, тумори мозга, тумори ЦНС.
- ^ Тенториј је дупликатуре тврде мождане опне смештена у попречној равнини (равни која при усправном ставу сече тело у хоризонталном смеру), а налази се изнад малог мозга. Он дели лобањску шупљину на горњи и доњи део, односно простор великог мозга и простор малог мозга.
- ^ Систем вена у кичменом стубу)
Извори
[уреди | уреди извор]- ^ а б * Павлиша, Горан (2008). „Карактеризација интракранијских тумора дифузијски мјереним снимкама магнетне резонанције и квантификацијом појавног дифузијског коефицијента : Докторска дисертација” (ПДФ) (на језику: (језик: хрватски)). Свеучилиште у Загребу. Архивирано из оригинала (ПДФ) 18. 07. 2013. г. Приступљено 4. 5. 2012.
- ^ а б в г д ђ е ж Натионал Цанцер Институте. „Трендс ин СЕЕР инциденце анд У.С. морталитy усинг тхе јоинпоинт регрессион програм 1975–2000 wитх уп то тхрее јоинпоинтс бy раце анд сеx.”. Недостаје или је празан параметар
|титле=(помоћ). Ин: Риес ЛАГ, Еиснер МП, Косарy CL, Ханкеy БФ, Миллер БА, Цлегг L, Едwардс БК, уредници. СЕЕР Цанцер Статистицс Ревиеw, 1975–2000. Бетхесда, MD: Натионал Цанцер Институте, 2003, Сецтион 3: Браин анд Отхер Нервоус Сyстем Цанцер (Инвасиве), Табле III-1. - ^ а б в Лоуис ДН, Охгаки Х, Wиестлер ОД, Цавенее WК, уредници (2007). Wорлд Хеалтх Организатион Цлассифицатион оф тумоурс оф тхе централ нервоус сyстем. ИАРЦ Пресс. Лyон, Франце.
- ^ Сwансон, К. Р.; Алворд Јр, Е. C.; Мурраy, Ј. D. (2002). „Виртуал браин тумоурс (Глиомас) енханце тхе реалитy оф медицал имагинг анд хигхлигхт инадеqуациес оф цуррент тхерапy”. Бритисх Јоурнал оф Цанцер. 86 (1): 14—8. ПМЦ 2746525
 . ПМИД 11857005. дои:10.1038/сј.бјц.6600021..
. ПМИД 11857005. дои:10.1038/сј.бјц.6600021..
- ^ Александар Костић и сар. Однос преоперативне величине тумора и преживљавања код оболелих од астроцитома мозга Ацта Медица Медианае 2007,Вол.46. стр. 17.
- ^ Wоод, Ј. Р.; Греен, С. Б.; Схапиро, W. Р. (1988). „Тхе прогностиц импортанце оф тумор сизе ин малигнант глиомас: А цомпутед томограпхиц сцан студy бy тхе Браин Тумор Цооперативе Гроуп”. Јоурнал оф Цлиницал Онцологy. 6 (2): 338—43. ПМИД 3339397. дои:10.1200/ЈЦО.1988.6.2.338..
- ^ а б Јанићијевић M. Тумори мозга. пп. 15-16. Београд; Завод за уџбенике и наставна средстава: 1994.
- ^ а б в Аннегерс, Ј. Ф.; Сцхоенберг, Б. С.; Оказаки, Х.; Курланд, L. Т. (1981). „Епидемиологиц студy оф примарy интрацраниал неопласмс”. Арцх Неурол. 38 (4): 217—219. ПМИД 7213145. дои:10.1001/арцхнеур.1981.00510040043006..
- ^ Левин ВА, Леибел СА, Гутин ПХ. Неопласмс оф тхе централ нервоус сyстем. Ин: Працтице оф Онцологy. 6тх ед. Пхиладелпхиа, ПА: Липпинцотт Wиллиамс & Wилкинс, (2001). стр. 2100—2160.
- ^ Патцхелл, Р. А. (2003). „Тхе манагемент оф браин метастасес”. Цанцер Треат Рев. 29 (6): 533—540. ПМИД 14585263. дои:10.1016/С0305-7372(03)00105-1..
- ^ Буцкнер, Ј. C.; Броwн, П. D.; О'Неилл, Б. П.; Меyер, Ф. Б.; Wетморе, C. Ј.; Ухм, Ј. Х. (октобар 2007). „Централ нервоус сyстем туморс”. Маyо Цлин Проц. 82 (10): 1271—86. ПМИД 17908533. дои:10.4065/82.10.1271.
- ^ Сутхерланд, Г. Р.; Флорелл, Р.; Лоуw, D.; Цхои, Н. W.; Сима, А. А. (1987). „Епидемиологy оф примарy интрацраниал неопласмс ин Манитоба, Цанада”. Цан Јоурнал оф тхе Неурологицал Сциенцес. 14 (4): 586—592. ПМИД 3500769..
- ^ а б в Куттесцх ЈФ, Атер ЈЛ. Браин Туморс ин Цхилдхоод. Ин: Клиегман БМ, Бехрман РЕ, Јенсон ХБ, Стантон БФ, едиторс. Нелсон Теxтбоок оф Педиатрицс. 18тх ед. Пхиладелпхиа: Саундерс Елсевиер; (2007). стр. 2128-2137.
- ^ Гурнеy ЈГ, Смитх МА, Бунин ГР. ЦНС анд мисцелланеоус интрацраниал анд интраспинал неопласмс. Бетхесда, Марyланд (УСА): Натионал Цанцер Институте, СЕЕР Педиатриц Монограпх; 1999.
- ^ МцЛендон, Рогер Е.; Робинсон, Јое С.; Цхамберс, Деббие Б.; Груфферман, Сеyмоур; Бургер, Петер C. (1985). „Тхе глиобластома мултиформе ин Георгиа, 1977–1981”. Цанцер. 56 (4): 894—897. ПМИД 2990658. С2ЦИД 23901722. дои:10.1002/1097-0142(19850815)56:4<894::АИД-ЦНЦР2820560432>3.0.ЦО;2-#..
- ^ Цоле, Гиллиан C.; Wилкинс, Петер Р.; Wест, Роберт Р. (1989). „Ан Епидемиологицал Сурвеy оф Примарy Тумоурс оф тхе Браин анд Спинал Цорд ин Соутх Еаст Wалес”. Бритисх Јоурнал оф Неуросургерy. 3 (4): 487—493. ПМИД 2803596. дои:10.3109/02688698909002835..
- ^ Лоуис, D. Н.; Охгаки, Х.; Wиестлер, О. D.; Цавенее, W. К.; Бургер, П. C.; Јоувет, А.; Сцхеитхауер, Б. W.; Клеихуес, П. (2007). „Тхе 2007 WХО Цлассифицатион оф Тумоурс оф тхе Централ Нервоус Сyстем”. Ацта Неуропатхологица. 114 (2): 97—109. ПМЦ 1929165
 . ПМИД 17618441. дои:10.1007/с00401-007-0243-4.[мртва веза]
. ПМИД 17618441. дои:10.1007/с00401-007-0243-4.[мртва веза]
- ^ Лоуис ДН, Охгаки Х, Wиестлер ОД, Цавенее WК (едс) . Wорлд Хеалтх Организатион Цлассифицатион оф Тумоурс оф тхе Централ Нервоус Сyстем. ИАРЦ, Лyон. WХО Цлассифицатион оф Тумоурс оф тхе Централ Нервоус Сyстем. Интернатионал Агенцy фор Ресеарцх он Цанцер. 2007. ИСБН 978-92-832-2430-3.
Тхис ис тхе ласт (2007) WХО цлассифицатион. Он тхе Интернет ат тхе УРЛ:аре тхе превиоус WХО цлассифицатионс. Архивирано на сајту Wayback Machine (13. јануар 2011) - ^ Оффице фор Натионал Статистицс (www.статистицс.гов.ук Архивирано на сајту Wayback Machine (26. април 2012)); анд Цанцер Ресеарцх УК (www.цанцерресеарцхук.орг)
- ^ Лоуис, D. Н.; Охгаки, Х.; Wиестлер, О. D.; Цавенее, W. К.; Бургер, П. C.; Јоувет, А.; Сцхеитхауер, Б. W.; Клеихуес, П. (2007). „WХО цлассифицатион оф Тумоурс оф тхе Централ Нервоус Сyстем.”. Ацта Неуропатхологица. 114 (2): 97—109. ПМЦ 1929165
 . ПМИД 17618441. дои:10.1007/с00401-007-0243-4.
. ПМИД 17618441. дои:10.1007/с00401-007-0243-4.
- ^ Јаребински M, Павловић M, Пекмезовић Т (1999). „Епидемиолошка истраживања малигних тумора у деце и адолесцената.”. Војносанитетски Преглед. 56 (1): 75.
- ^ Муеллер, Б. А.; Гурнеy, Ј. Г. (1992). „Епидемиологy оф педиатриц браин туморс.”. Неуросург Цлин Н Ам. 3 (4): 717. ПМИД 1392571. дои:10.1016/С1042-3680(18)30622-3.
- ^ Павловић M. Епидемиолошко-клиничка студија тумора мозга у деце и адолесцената. Магистарска теза. Медицински факултет, Београд 2000.
- ^ Сцхоенберг, Б. С. Епидемиологy оф примарy интрацраниал неопласмс: Дисеасе дистрибутион анд риск фацторс. У Салеман M, Неуробиологy оф Браин Туморс, Цонцептс ин Неуросургерy, вол 4. Балтиморе, УСА: Wиллиамс & Wилкинс, (1991). стр. 3-18.
- ^ Wренсцх M, Минн Y, Цхеw Т, Бондy M, Бергер, МС (2002). „Епидемиологy оф примарy браин туморс: Цуррент цонцептс анд ревиеw оф тхе литературе.”. НеуроОнцологy. 4: 278—299..
- ^ Фисхер, Ј. L.; Сцхwартзбаум, Ј. А.; Wренсцх, M.; Wиемелс, Ј. L. (2007). „Епидемиологy оф браин туморс”. Неурол Цлин. 25 (4): 867—90. ПМИД 17964019. дои:10.1016/ј.нцл.2007.07.002..
- ^ Бондy, M.; Лигон, Б. L. (1996). „Епидемиологy анд етиологy оф интрацраниал менингиомас: А ревиеw”. Ј Неуроонцол. 29 (3): 197—205. ПМИД 8858525. С2ЦИД 35272336. дои:10.1007/БФ00165649..
- ^ а б Соо ЕW, Галиндо ЕГ, Левин ВА. Браин Туморс. Медицал Онцологy: А Цомпрехенсиве Ревиеw. Доступно са УРЛ: [1]
- ^ Јамес CD, Царлбом Е, Норденскјолд M, Цоллинс ВП, Цавенее WК (1989). „Митотиц рецомбинатион оф цхромосоме 17 ин астроцyтомас”. Проц Натл Ацад Сци УСА. 86 (8): 2858—2862. Бибцоде:1989ПНАС...86.2858Ј. ПМЦ 287018
 . ПМИД 2565039. дои:10.1073/пнас.86.8.2858
. ПМИД 2565039. дои:10.1073/пнас.86.8.2858  ..
..
- ^ Ланг, Ф. Ф.; Миллер, D. C.; Кослоw, M.; Неwцомб, Е. W. (1994). „Патхwаyс леадинг то глиобластома мултиформе: А молецулар аналyсис оф генетиц алтератионс ин 65 хистоцyтиц туморс”. Јоурнал оф Неуросургерy. 81 (3): 427—436. ПМИД 8057151. дои:10.3171/јнс.1994.81.3.0427..
- ^ Ланг, Ф. Ф.; Миллер, D. C.; Кослоw, M.; Неwцомб, Е. W. (1994). „Патхwаyс леадинг то глиобластома мултиформе: А молецулар аналyсис оф генетиц алтератионс ин 65 астроцyтиц туморс”. Јоурнал оф Неуросургерy. 81 (3): 427—436. ПМИД 8057151. дои:10.3171/јнс.1994.81.3.0427..
- ^ Брунер, Ј. M. (1994). „Неуропатхологy оф малигнант глиомас”. Семин Онцол. 21 (2): 126—138. ПМИД 8153659..
- ^ Сидранскy, D.; Миккелсен, Т.; Сцхwецххеимер, К.; Росенблум, M. L.; Цаванее, W.; Вогелстеин, Б. (1992). „Цлонал еxпансион оф п53 мутант целлс ис ассоциатед wитх браин тумоур прогрессион”. Натуре. 355 (6363): 846—847. Бибцоде:1992Натур.355..846С. ПМИД 1311419. С2ЦИД 4318673. дои:10.1038/355846а0..
- ^ Дунн, Иан Ф.; Хеесе, Оливер; Блацк, Петер МцЛ. (2000). „Гроwтх фацторс ин глиома ангиогенесис: ФГФС, ПДГФ, ЕГФ, анд ТГФС”. Ј Неуроонцол. 50 (1–2): 121—137. ПМИД 11245272. С2ЦИД 11369909. дои:10.1023/А:1006436624862..
- ^ Сцхлегел, Ј.; Сцхертхан, Х.; Аренс, Н.; Стумм, Г.; Цремер, Т.; Киесслинг, M. (1994). „Детецтион оф амплифиед ДНА сеqуенцес бy цомпаративе геномиц ин ситу хyбридизатион wитх хуман глиома тумор ДНА ас пробе”. Верх Дтсцх Гес Патхол. 78: 204—207. ПМИД 7533987..
- ^ Росзман, Т.; Еллиотт, L.; Броокс, W. (1991). „Модулатион оф Т-целл фунцтион бy глиомас”. Иммунол Тодаy. 12 (10): 370—374. ПМИД 1958290. дои:10.1016/0167-5699(91)90068-5..
- ^ Диx, А. Р.; Броокс, W. Х.; Росзман, Т. L.; Морфорд, L. А. (1999). „Иммуне дефецтс обсервед ин патиентс wитх примарy малигнант браин туморс”. Јоурнал оф Неуроиммунологy. 100 (1–2): 216—232. ПМИД 10695732. С2ЦИД 44257217. дои:10.1016/С0165-5728(99)00203-9..
- ^ Краус ЈА, Ламсзус К, Глесманн Н, Бецк M, Wолтер M, Сабел M, Креx D, Клоцкгетхер Т, Реифенбергер Г, Сцхлегел У. Краус, Ј. А.; Ламсзус, К.; Глесманн, Н.; Бецк, M.; Wолтер, M.; Сабел, M.; Креx, D.; Клоцкгетхер, Т.; Реифенбергер, Г.; Сцхлегел, У. (2001). „Молецулар генетиц алтератионс ин глиобластомас wитх олигодендроглиал цомпонент.”. Ацта Неуропатхол (Берл). 101 (4): 311—320. ПМИД 11355302. дои:10.1007/с004010000258.
- ^ Леонард, Ј. Р.; Цаи, D. X.; Ривет, D. Ј.; Кауфман, Б. А.; Парк, Т. С.; Левy БК, Перрy А (2001). „Ларге целл/анапластиц медуллобластомас анд медулломyобластомас: цлиницопатхологицал анд генетиц феатурес”. Јоурнал оф Неуросургерy. 95 (1): 82—88. ПМИД 11453402. дои:10.3171/јнс.2001.95.1.0082.
- ^ Лüббе, Ј.; вон Аммон, К.; Wатанабе, К.; Хеги, M. Е.; Клеихуес, П. (1995). „Фамилиал браин тумоур сyндроме ассоциатед wитх а п53 гермлине делетион оф цодон 236”. Браин Патхол. 5 (1): 15—23. ПМИД 7767487. С2ЦИД 19892022. дои:10.1111/ј.1750-3639.1995.тб00572.x..
- ^ Деан, Малцолм (2003). „Леакед публиц сервице репорт ембаррассес УК говернмент”. Ланцет. 361 (9354): 322—331. С2ЦИД 54364069. дои:10.1016/С0140-6736(03)12374-4..
- ^ Никитовић, M. Р.; Голубицић, I. V.; Боројевић, Н. D.; Пекмезовић, Т. D.; Грујицић, D. M.; Плесинац-Карапандзић, V. С. (2009). „Педиатриц браин туморс--диагностиц анд треатмент”. Ацта Цхирургица Иугославица. 56 (4): 19—24. ПМИД 20419991. дои:10.2298/АЦИ0904019Н..
- ^ Мојсиловиц, А.; Рогоwитз, Б.; Гомес, Ј.; Деисбоецк, Т. С. (2002). „Аналyсис анд 3Д рецонструцтион оф хетерогенеитy ин малигнант браин туморс: Ан интердисциплинарy цасе студy усинг а новел цомпутатионал висуализатион аппроацх”. АQЦХ. 24 (3): 125—33. ПМИД 12102123..
- ^ Ђорђевић M, Тофовић П, Секуловић Н. Интракранијумска хипертензија. Београд – Загреб: Медицинска Књига; 1990.
- ^ Yамада, С.; Такаи, Y.; Немото, К.; Огаwа, Y.; Какуто, Y.; Хосхи, А.; Сакамото, К. (1993). „Прогностиц сигнифицанце оф ЦТ сцан ин малигнант глиома”. Тохоку Јоурнал оф Еxпериментал Медицине. 170 (1): 35—43. ПМИД 8278987. дои:10.1620/тјем.170.35..
- ^ Глантз, M. Ј. Централ нервоус сyстем цомплицатионс оф радиатион. МедЛинкНеуробасе тхирд 2000 едитион
- ^ Стефановић I. Утицај соматостатина на високомалигне астроцитоме: Докторска дисертација. Медицински факултет; Унив. Ниш; 1998.
- ^ Пиззо А, Поплацк ДГ, едиторс. Принциплес анд працтице оф педиатриц онцологy. 5тх ед. Пхиладелпхиа: Липпинцот Wиллиамс & Wилкинс; 2005.
- ^ .Јајић Ђ,Момчиловић А.: ЦТ-стереотаксичне биопсије дубоких можданих тумора. I симпозијум ВМА о малигним туморима ендокранијума,Београд 1990,Зборник радова пп. 46-50.
- ^ а б Леглер, Ј. M.; Риес, L. А.; Смитх, M. А.; Wаррен, Ј. L.; Хеинеман, Е. Ф.; Каплан, Р. С.; Линет, M. С. (1999). „Цанцер сурвеилланце сериес цоррецтед: Браин анд отхер централ нервоус сyстем цанцерс: Рецент трендс ин инциденце анд морталитy”. Ј Натл Цанцер Инст. 91 (16): 1382—1390. ПМИД 10451443. дои:10.1093/јнци/91.16.1382..
- ^ Ступп, Р.; Масон, W. П.; Ван Ден Бент, M. Ј.; Wеллер, M.; Фисхер, Б.; Тапхоорн, M. Ј.; Белангер, К.; Брандес, А. А.; Мароси, C.; Богдахн, У.; Цурсцхманн, Ј.; Јанзер, Р. C.; Лудwин, С. К.; Горлиа, Т.; Аллгеиер, А.; Лацомбе, D.; Цаирнцросс, Ј. Г.; Еисенхауер, Е.; Мириманофф, Р. О.; Еуропеан Органисатион фор Ресеарцх анд Треатмент оф Цанцер Браин Тумор анд Радиотхерапy Гроупс; Натионал Цанцер Институте оф Цанада Цлиницал Триалс Гроуп (2005). „Радиотхерапy плус цонцомитант анд адјувант темозоломиде фор глиобластома”. Неw Енгланд Јоурнал оф Медицине. 352 (10): 987—996. ПМИД 15758009. С2ЦИД 41340212. дои:10.1056/НЕЈМоа043330..
- ^ Цастро, M. Г.; Цоwен, Р.; Wиллиамсон, I. К.; Давид, А.; Јименез-Далмарони, M. Ј.; Yуан, X.; Биглиари, А.; Wиллиамс, Ј. C.; Ху, Ј.; Лоwенстеин, П. Р. (2003). „Цуррент анд футуре стратегиес фор тхе треатмент оф малигнант браин туморс”. Пхармацол Тхер. 98 (1): 71—108. ПМИД 12667889. дои:10.1016/С0163-7258(03)00014-7..
Литература
[уреди | уреди извор]- Кернохан ЈW, Саyре ГП. Туморс оф тхе централ нервоус сyстем, Ин: Атлас оф Тумор Патхологy, сецтион 10, фасцицле 35. Wасхингтон, DC, УСА: Армед Форцес Институте оф Патхологy, 1982.
- Yамада, К.; Касама, M; Кондо, Т.; Схиноура, Н; Yосхиока, M. (1994). „Цхромосоме студиес ин 70 браин туморс wитх специал аттентион то сеx цхромосоме лосс анд сингле аутосомал трисомy”. Цанцер Генет Цyтогенет. 73 (1): 46—52. ПМИД 8174073. дои:10.1016/0165-4608(94)90180-5..
- Саwyер, Ј. Р.; Саммартино, Г; Хусаин, M.; Бооп, Ф. А.; Цхаддуцк, W. M. (1994). „Цхромосоме аберратионс ин фоур епендyмомас”. Цанцер Генет Цyтогенет. 74 (2): 132—138. ПМИД 8019957. дои:10.1016/0165-4608(94)90011-6..
- Рогатто, С. Р.; Цасартелли, C; Раинхо, C. А.; Барбиери-Нето, Ј. (1993). „Цхромосомес ин тхе генесис анд прогрессион оф епендyмомас”. Цанцер Генет Цyтогенет. 69 (2): 146—152. ПМИД 8402555. дои:10.1016/0165-4608(93)90093-2..
- Даумас-Дупорт C (1993). „Дyсембриопластиц неуроепитхелиал туморс”. Браин Патхол. 3 (3): 283—295. ПМИД 8293188. С2ЦИД 34050982. дои:10.1111/ј.1750-3639.1993.тб00755.x..
Спољашње везе
[уреди | уреди извор]| Класификација | |
|---|---|
| Спољашњи ресурси |
- WебМД: Браин Цанцер Хеалтх Центер
- МаyоЦлиниц: Патиент Царе & Хеалтх Информатион Дисеасес & Цондитионс; Браин тумор
- Браин Тумор: Дефинитионс Неуросургерy УЦЛА
- Медлине Плус: Браин тумоур
- Цанцер.Нет: Браин тумор