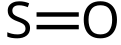Sumpor-monoksid
Appearance
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Sumpor monoksid
| |||
| Sistemski IUPAC naziv
Oksidosumpor[1] | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 7577656 | ||
| ChEBI | |||
| ChemSpider | |||
| Gmelin Referenca | 666 | ||
| MeSH | sulfur+monoxide | ||
| |||
| |||
| Svojstva | |||
| SO | |||
| Molarna masa | 48,064 g mol-1 | ||
| Agregatno stanje | Bezbojni gas | ||
| Reaktivan je | |||
| log P | 0.155 | ||
| Termohemija | |||
Standardna molarna
entropija (S |
221.94 J K-1 mol-1 | ||
Standardna entalpija
stvaranja (ΔfH |
5.01 kJ mol-1 | ||
| Opasnosti | |||
| NFPA 704 | |||
| Srodna jedinjenja | |||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Sumpor-monoksid (sumpor(II)-oksid) je neorgansko hemijsko jedinjenje hemijske formule SO.
Hemijska formula
[uredi | uredi izvor]-
Strukturna formula sumpor-monoksida
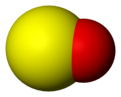
-
Model molekula sumpor-monoksida
-
Strukturna formula disulfid-dioksida
-
Model molekula disulfid-dioksida
Istorijat i dobijanje
[uredi | uredi izvor]Šenk je 1935. dobio sumpor-monoksid pomešan sa sumpor-dioksidom sagorevanjem sumpora pod određenim uslovima. Tvrdio je i da ga je dobio 1932. dejstvom električnog pražnjenja na smešu sumpor-dioksida i sumpora na niskim pritiscima.[4]
Fizičko-hemijske osobine
[uredi | uredi izvor]Ovo je bezbojan gas koji se vrlo lako raspada, posebno u prisustvu vode i organskih materijala. Jedini se sa kiseonikom uz propuštanje varnice i tada daje sumpor-dioksid, a sa metalima gradi sulfide.[4]
Izvori
[uredi | uredi izvor]- ^ „sulfur monoxide (CHEBI:45822)”. Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. Arhivirano iz originala 07. 07. 2013. g. Pristupljeno 22. 12. 2011.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b Parkes, G.D. & Phil, D. 1973. Melorova moderna neorganska hemija. Naučna knjiga. Beograd.