Aluminijum hidrid
| |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv
Aluminijum hidrid | |
| Sistemski IUPAC naziv
Aluman | |
| Drugi nazivi
Alan
Aluminijum(III) hidrid | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.139 |
| Gmelin Referenca | 245 |
| |
| Svojstva | |
| AlH3 | |
| Molarna masa | 29,99 g/mol |
| Agregatno stanje | bela kristalina supstanca, neisparljiva, visoko polimerizovana, iglasti kristali |
| Gustina | 1,486 g/cm3, (čvrsto stanje) |
| Tačka topljenja | 150 °C |
| Tačka ključanja | razlaže se |
| reaktivan | |
| Srodna jedinjenja | |
Srodna jedinjenja
|
Litijum aluminijum hidrid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Aluminijum hidrid je neorgansko jedinjenje sa formulom AlH3. On je bezbojni čvrsti materijal koji je piroforan. Mada se retko sreće van laboratorije, alan i njegovi derivati su korisni kao redukujući agensi u organskoj sintezi.[3]
Struktura
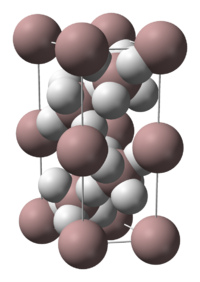
[uredi | uredi izvor]Alan je polimer. Njegova formula je nekad prikazuje kao (AlH3)n. Aluminijum hidrid formira brojne polimorfe, koji se nazivaju α-alan, α’-alan, β-alan, δ-alan, ε-alan, θ-alan, i γ-alan. α-Alan ima kubnu ili romboedrsku morfologiju, dok α’-alan formira iglama slične kristale i γ-alan formira snopove spojenih igli. Alan je rastvoran u THF-u i etru, i njegova brzina precipitacije iz etra zavisi od metoda pripreme.[4]
Struktura α-alana je određena. Ona se sastoji od atoma aluminijuma okruženih sa 6 atoma vodonika koji su mostovi sa 6 drugih atoma aluminijuma. Al-H rastojanja su međusobno ekvivalentna (172 pm) i Al-H-Al ugao je 141°.[5]
 |
 |
 |
α-Alan je termički najstabilniji polimorf. β-alan i γ-alan se formiraju zajedno, i konvertuju do α-alana nakon zagrevanja. δ, ε, i θ-alan se formiraju u različitim kristalizacionim uslovima. Mada su oni manje termički stabilni, oni se ne konvertuju u α-alan nakon zagrevanja.[4]
Literatura
[uredi | uredi izvor]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Brown, H. C.; Krishnamurthy, S. Tetrahedron 1979, 35, 567.
- ^ a b Lund, Gary K., Hanks, Jami M., Johnston, Harold E., US Patent and Trade Office, 2007, Pat. Application # 20070066839
- ^ Turley J W,. Rinn H W (1969). „The crystal structure of aluminum hydride”. Inorganic Chemistry. 8 (1): 18—22. doi:10.1021/ic50071a005.
