Kvaternarni amonijum katjon
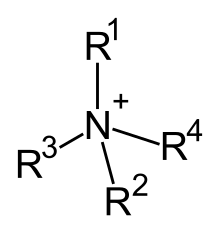
Kvaternarni amonijum katjoni su pozitivno naelektrisani poliatomski joni sa strukturom NR+
4, pri čemu je R alkil ili aril grupa.[1] Za razliku od amonijum jona (NH+
4) i primarnih, sekundarnih, ili tercijarnih amonijum katjona, kvaternarni amonijum katjoni su permanentno naelektrisani, nezavisno od pH njihovog rastvora. Kvaternarne amonijum soli ili kvaternarna amonijum jedinjenja (zvana kvaternarni amini u žargonu naftnih polja) su soli kvaternarnih amonijum katjona.
Sinteza
[уреди | уреди извор]Kvaternarni amonijum katjoni se pripremaju alkilacijom tercijarnih amina sa halougljenikom.[2] U starijoj literaturi to se obično naziva Menšutkinovom reakcijom, dok se u modernim izvorima jednostavno naziva kvaternizacijom.[3] Ova reakcija se može koristiti za formiranje jedinjenja sa nejednakim dužinama alkilnih lanaca; na primer pri pravljenju katjonskih surfaktanata jedna od alkil grupa amina je obično duža od drugih.[4] Tipična sinteza benzalkonijum hlorida se izvodi koristeći dugolančani alkildimetilamin i benzil hlorid:
- CH3(CH2)nN(CH3)2 + ClCH2C6H5 → [CH3(CH2)nN(CH3)2CH2C6H5]+Cl−
Reakcije
[уреди | уреди извор]Kvaternarni amonijum katjoni nisu reaktivni prema jakim elektrofilima, oksidansima, i kiselinama. Oni su isto tako stabilni prema većini nukleofila. Ovo zadnje svojstvo se na primer ispoljava u vidu stabilnosti hidroksidnih soli kao što su tetrametilamonijum hidroksid i tetrabutilamonijum hidroksid. Zbog njihove otpornosti, mnogi neobični anjoni su bili izolovani kao kvarternarne amonijum soli. Primeri obuhvataju tetrametilamonijum pentafluoroksenat, koji sadrži visoko reaktivni pentafluoroksenatni (XeF−
5) jon. Permanganat se može rastvoriti u organskim rastvaračima, kad se koristi njegova NBu+
4 so.[5][6]
Sa izuzetno jakim bazama, kvaternarni katjoni se degradiraju. Oni podležu Somalet-Hauserom[7] i Stivensovom rearanžmanu,[8] kao i dealkilaciji pod oštrim uslovima. Kvaternarni amonijum katjoni koji sadrže N–C–C–H jedinice mogu da podlegnu Hofmanovoj eliminaciji i Emdeovoj degradaciji.


Vidi još
[уреди | уреди извор]- Benzalkonijum hlorid, benzetonijum hlorid, metilbenzetonijum hlorid, ketalkonijum hlorid, cetilpiridinijum hlorid, cetrimonijum, cetrimid, dofanijum hlorid, tetraetilamonijum bromid, i domifen bromid – antimikrobni su ingredijenti prisutni u raznim produktima na slobodno
- Dikvat - dikvaternarno amonijum jedinjenje koje se koristi kao kontaktni herbicid
- Karnitin
- Cetrimonijum bromid (CTAB), stearalkonijum hlorid – katjonski surfaktanti sa širokim opsegom kozmetičkih primena
- Holin
- Kokamidopropil betain (CAPB), čest cviterjonski surfaktant u kozmetičkim primenama
- Denatonijum, najgorčije poznato jedinjenje
- Dimetildioktadecilamonijum hlorid
- Parakvat, herbicid
- Polikvaternijum, polimeri koji sadrže kvarterne amonijeve soli, koji se koriste za proizvode za ličnu negu
- Kvaternarno amonijumski mišićni relaksanti
- Silicijumski kvaternarni amin
- Tetra-n-butilamonijum bromid i Alikvat 336, česti katalizatori faznog transfera
- Tetrametilamonijum hlorid
- Tetrametilamonijum hidroksid
- Tetrametilamonijum pentafluoroksenat, sadrži neobični pentagonalni pentafluoroksenatni (XeF5−) jon
- Triazen
Reference
[уреди | уреди извор]- ^ IUPAC. „quaternary ammonium compounds”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Brasen, C. R.; Hauser (1954). „o-Methylethylbenzyl Alcohol”. Org. Synth. 34: 58. doi:10.15227/orgsyn.034.0058.
- ^ Smith, Michael B.; March, Jerry (2001). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5th изд.). New York, NY: Wiley-Interscience. ISBN 978-0-471-58589-3.
- ^ „Surfactants”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. doi:10.1002/14356007.a25_747.
- ^ Herriott, Arthur W. (1977). „Purple benzene: Solubilization of anions in organic solvents”. J. Chem. Educ. 54 (4): 229. Bibcode:1977JChEd..54Q.229H. doi:10.1021/ed054p229.1.
- ^ Doheny, Anthony J., Jr.; Ganem, Bruce (1980). „Purple benzene revisited”. J. Chem. Educ. 57 (4): 308. Bibcode:1980JChEd..57..308D. doi:10.1021/ed057p308.1.
- ^ Brasen, W. R.; Hauser, C. R. (1963). „2-Methylbenzyldimethylamine”. Org. Synth.; Coll. Vol., 4, стр. 585
- ^ Pine, Stanley H. (2011). „The Base-Promoted Rearrangements of Quaternary Ammonium Salts”. Organic Reactions. ISBN 978-0-471-26418-7. doi:10.1002/0471264180.or018.04.
Literatura
[уреди | уреди извор]- Pine, Stanley H. (2011). „The Base-Promoted Rearrangements of Quaternary Ammonium Salts”. Organic Reactions. ISBN 978-0-471-26418-7. doi:10.1002/0471264180.or018.04.
- Smith, Michael B.; March, Jerry (2001). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5th изд.). New York, NY: Wiley-Interscience. ISBN 978-0-471-58589-3.
Spoljašnje veze
[уреди | уреди извор]- Toxicities of quaternary ammonium
- Zhang, Chang; Cui, Fang; Zeng, Guang-ming; Jiang, Min; Yang, Zhong-zhu; Yu, Zhi-gang; Zhu, Meng-ying; Shen, Liu-qing (15. 6. 2015). „Quaternary ammonium compounds (QACs): A review on occurrence, fate and toxicity in the environment”. Sci. Total Env. 518–519: 352—362. doi:10.1016/j.scitotenv.2015.03.007.
