Srebro fulminat

| |
| Identifikacija | |
|---|---|
3D model (Jmol)
|
|
| |
| Svojstva | |
| CAgNO | |
| Molarna masa | 149,885 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Srebro fulminat je organsko jedinjenje, opšta formula Ag(CNO), koje sadrži 1 atom ugljenika i ima molekulsku masu od 149,885 Da.
Srebrni fulminat je primarni eksploziv, ali kao takav ima ograničenu upotrebu zbog svoje ekstremne osetljivosti na udarce, toplotu, pritisak i elektricitet. Jedinjenje postaje progresivno osetljivo kako se agregira, čak i u malim količinama; dodir pera koje pada, udar jedne kapljice vode ili malo statičko pražnjenje su sposobni da eksplozivno detoniraju neograničenu gomilu srebrnog fulminata veličine manje od novčića i težine nekoliko miligrama. Agregiranje većih količina je nemoguće, zbog tendencije jedinjenja da samoinicijativno detonira pod sopstvenom težinom.
Veoma je osetljiv na udarce i trenje, pa je opasan za rukovanje (dugo je bio izvor nezgoda u apotekama i hemijskim ili fizičkim eksperimentima u laboratorijama koje su ga proučavale ili koristile[3], kao i u fotografskim studijima[4]).
Srebrni fulminat se može pripremiti na sličan način kao i živin fulminat, ali ova so je još nestabilnija od živinog fulminata, može čak i da eksplodira pod vodom. To je izomer srebrnog cijanata.
Koristi se za pravljenje određenih petardi, u veoma malim količinama.
Srebrni fulminat je prvi pripremio Edvard Čarls Hauard 1800. godine u svom istraživačkom projektu za pripremu velikog broja raznovrsnih fulminata. Zajedno sa živinim fulminatom, to je jedini fulminat koji je dovoljno stabilan za komercijalnu upotrebu. Detonatori koji koriste srebrni fulminat korišćeni su za iniciranje pikrinske kiseline 1885. godine, ali ih je od tada koristila samo italijanska mornarica.[5] Trenutna komercijalna upotreba je u proizvodnji neštetnih zvučnih efekata kod dečijih igračaka.
Istorija
[уреди | уреди извор]Osamdesetih godina 17. veka, Klod-Luj Bertole je proučavao formu „fulminirajućeg srebra“.[6] On daje formulu i opisuje njena svojstva u Zapažanjima o fizici Abbe Rozier-a u junu 1788. godine.[6] Konkretno, dok se drugi fulminanti moraju zapaliti ili zagrejati da bi detonirali, on primećuje veliku nestabilnost fulminantnog srebra („dodir sa hladnim telom je dovoljan da detonira“).
Oko 1800. godine , neposredno nakon fulminata žive, Descostils, Cruicksanks i Brugnatelli[6] su to opisali preciznije.
Justus Liebig i Gai-Lussac su 1824. objavili metodu za analizu ove supstance.[7]
Kalmels je 1884. proučavao reakciju primarnih jodida alkohola sa srebrnim fulminatom.[8]
Tokom 1930-ih Muraour je proučavao vakuumsku detonaciju fulminata kao osnovnog eksploziva i predložio rad sa srebrnim azidom.
Godine 1978. ponovo je procenjen kao potencijalni pirotehnički detonator, uprkos svojoj opasnosti,[9] a ponekad se koristi za proučavanje detonacionih i deflagracionih talasa.[10]
Osobine
[уреди | уреди извор]| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 1 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 0 |
| Particioni koeficijent[11] (ALogP) | -0,8 |
| Rastvorljivost[12] (logS, log(mol/L)) | 1,5 |
| Polarna površina[13] (PSA, Å2) | 90,5 |
Struktura
[уреди | уреди извор]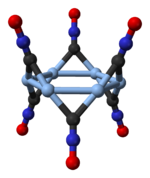
Srebrni fulminat se javlja u dva polimorfna oblika, ortorombičnom i trigonalnom sa romboedarskom rešetkom.[14] Trigonalni polimorf se sastoji od cikličnih heksamera, (AgCNO)6.[15]

Svojstva
[уреди | уреди извор]Fulminati su toksični, otprilike isto kao i cijanidi.[5] Kada je čist, srebrni fulminat je hemijski stabilan i ne raspada se nakon godina skladištenja. Kao i mnoge srebrne soli, potamni pri izlaganju svetlosti. Slabo je rastvorljiv u hladnoj vodi i može se rekristalisati korišćenjem vrele vode.[5][16] Takođe se može rekristalisati iz 20% rastvora amonijum acetata.[5] Nije higroskopan i može eksplodirati kada je vlažan ili pod vodom; prijavljeno je da je ostao eksplozivan nakon 37 godina pod vodom.[5] Eksplodira u kontaktu sa koncentrovanom sumpornom kiselinom ili hlorom ili bromom, ali ne i u kontaktu sa jodom.[5] Nerastvorljiv je u azotnoj kiselini, ali se rastvara u amonijaku , alkalnim hloridima, alkalnim cijanidima, anilinu, piridinu i kalijum-jodidu formirajući komplekse.[5] Koncentrovana hlorovodonična kiselina ga neeksplozivno razlaže uz šištanje; tiosulfat ga takođe neeksplozivno razlaže i može se koristiti za odlaganje.[5]
Priprema
[уреди | уреди извор]Ovo jedinjenje se može pripremiti sipanjem rastvora srebrnog nitrata u azotnoj kiselini u etanol, pod pažljivom kontrolom reakcionih uslova, kako bi se izbegla eksplozija.[17] Reakcija se obično vrši na 80—90 °C (176—194 °F; 353—363 K); na 30 °C (86 °F; 303 K), talog se možda neće formirati.[5] Samo male količine srebrnog fulminata treba pripremiti odjednom, jer čak i težina kristala može izazvati njihovu samodetonaciju. Drugi način da se dobije srebrni fulminat je reakcija srebrnog karbonata sa amonijakom u rastvoru.
Srebrni fulminat se takođe formira kada se gasni azot oksid propušta kroz rastvor srebrovog nitrata u etanolu.[5]
Srebrni fulminat se može pripremiti nenamerno, kada kiseli rastvor srebrovog nitrata dođe u kontakt sa alkoholom.[17] Ovo predstavlja opasnost u nekim formulacijama hemijski posrebrenih ogledala.
Noviteti eksploziva
[уреди | уреди извор]Srebrni fulminat, često u kombinaciji sa kalijum hloratom, koristi se u trikovima koji stvaraju buku poznatim kao "odbacivanje", "krekeri", "snaperi", "bičevi", "pop-its" ili "bang snaps", a popularna vrsta noviteta vatrometa. Sadrže približno 200 miligrama sitnog šljunka prekrivenog malom količinom (približno 80 mikrograma)[18] srebrnog fulminata. Kada se baci na tvrdu površinu, udarac je dovoljan da detonira sićušnu količinu eksploziva, stvarajući mali pozdrav od supersonične detonacije. Snaps je dizajniran tako da ne može da izazove štetu (čak i kada detoniraju na koži) zbog efekta prigušenja koji obezbeđuje mnogo veća masa šljunkovite sredine. To je takođe hemikalija pronađena u božićnim krekerima[19] koju je u tu svrhu prvi upotrebio Tom Smit 1860. Hemikalija je nanesena na jednoj od dve uske trake kartona, a na drugoj je abraziv. Kada se kreker povuče, abraziv detonira srebrni fulminat.
Mešavina fulminata sa 10-20% kalijum hlorata je jeftinija i sjajnija od samog fulminata.[5]
Aplikacije
[уреди | уреди извор]U praksi, srebrni fulminat nema nikakvu primenu, čak ni kao eksploziv. Zbog svoje visoke osetljivosti, nikada se ne koristi u vatrometu, jer se mešavine kalijum hlorata ili crvenog fosfora uvek koriste za paljenje trenjem.
Vidi još
[уреди | уреди извор]- Primarni eksploziv
- Srebro cijanat
- Fulminska kiselina
- Kalijum fulminat
- Živa(II) fulminate
- Izomer (hemijski)
Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Viel C (2005). Des accidents dans les laboratoires de chimie au XIXe siècle. Revue d'histoire de la pharmacie, 93(346), 175-186.
- ^ Lefebvre, T., & Raynal, C. (2001). Les accidents du travail chez les photographes du XIXe siècle. Revue d'histoire de la pharmacie, 89(329), 121-124.
- ^ а б в г д ђ е ж з и ј Matyas, Robert; Pachman, Jiri (12. 3. 2013). Primary Explosives. Springer Science & Business Media, 338 pages.
- ^ а б в Lemay, P. (1961). Berthollet invente des explosifs. Revue d'histoire de la pharmacie, 49(169), 53-57.(résumé)
- ^ Liebig J & Gay-Lussac J.L (1824) Analyse du fulminate d’argent. Ann. Chim. et Phys, 25, 285œ311.
- ^ Compt. rend, 99, 794.
- ^ En Collins, P. H., & Holloway, K. J. (1978). A reappraisal of silver fulminate as a detonant. Propellants, Explosives, Pyrotechnics, 3(6), 159-162 (résumé)
- ^ Manson N (1987) [Manson, N. (1987). Historique de la découverte de l'onde de détonation. Le Journal de Physique Colloques, 48(C4), C4-7. Historique de la découverte de l'onde de détonation]. Le Journal de Physique Colloques, 48(C4), C4-7.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Britton, D.; Dunitz, J. D. (1965). „The Crystal Structure of Silver Fulminate”. Acta Crystallographica. 19 (4): 662—668. doi:10.1107/S0365110X6500405X.
- ^ Britton, D. (1991). „A Redetermination of the Trigonal Silver Fulminate Structure”. Acta Crystallographica C. 47 (12): 2646—2647. doi:10.1107/S0108270191008855.
- ^ 0.0075 gm at 13 °C, 0.018 gm at 30 °C, and 0.25 gm per 100 gm H2O at 100 °C
- ^ а б Collins, P. H.; Holloway, K. J. (1978). „A Reappraisal of silver fulminate as a detonant”. Propellants, Explosives, Pyrotechnics. 3 (6): 159—162. doi:10.1002/prep.19780030603.
- ^ package disclosure of Alexron Co. Ltd, Hong Kong, Phantom Brand Bang Snaps, (c)2013
- ^ Spectrum. „Comment #70”. Old Firework Factory Locations. UK Pyrotechnics Society. Приступљено 20. 12. 2011.
Literatura
[уреди | уреди извор]- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
Dodatna literatura
[уреди | уреди извор]- Singh, K. (1959). „Crystal structure of silver fulminate”. Acta Crystallographica. 12 (12): 1053. doi:10.1107/S0365110X5900295X
 .
. - Matyas, Robert; Pachman, Jiri (Mar 12, 2013). Primary Explosives. Springer Science & Business Media, 338 pages
