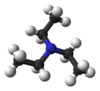
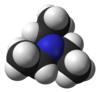
Trietilamin
Изглед

| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Trietilamin
| |||
Drugi nazivi
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Abrevijacija | TEA[1] | ||
| Bajlštajn | 605283 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.064 | ||
| EC broj | 204-469-4 | ||
| KEGG[2] | |||
| MeSH | triethylamine | ||
| RTECS | YE0175000 | ||
| UNII | |||
| UN broj | 1296 | ||
| |||
| Svojstva | |||
| C6H15N | |||
| Molarna masa | 101,19 g·mol−1 | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Miris | Miris ribe, amonijaka | ||
| Gustina | 0,7255 g mL−1 | ||
| Tačka topljenja | 15.572 °C; 28.061 °F; 15.845 K | ||
| log P | 1.647 | ||
| Napon pare | 6,899–8,506 kPa | ||
| kH | 66 μmol Pa−1 kg−1 | ||
| Indeks refrakcije (nD) | 1,401 | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 216,43 J K−1 mol−1 | ||
Std entalpija
formiranja (ΔfH⦵298) |
−169 kJ mol−1 | ||
| Std entalpija sagorevanja ΔcH |
−4,37763–−4,37655 MJ mol−1 | ||
| Opasnosti | |||
| GHS grafikoni |   
| ||
| GHS signalna reč | DANGER | ||
| H225, H302, H312, H314, H332 | |||
| P210, P280, P305+351+338, P310 | |||
EU klasifikacija (DSD)
|
|||
| R-oznake | R11, R20/21/22, R35 | ||
| S-oznake | (S1/2), S3, S16, S26, S29, S36/37/39 | ||
| NFPA 704 | |||
| Tačka paljenja | -15 °C | ||
| 312 °C (594 °F; 585 K) | |||
| Eksplozivni limiti | 1,2–8% | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
| ||
| Srodna jedinjenja | |||
Srodne supstance
|
|||
Srodna jedinjenja
|
|||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Trietilamin je hemijsko jedinjenje sa formulom N(CH2CH3)3. On se obično obeležava sa Et3N. Skraćenica TEA se takođe koristi.
Properties
[уреди | уреди извор]Trietilamin se često sreće u organskoj sintezi, verovatno zato što je on najjednostavniji simetrično trisupstituisani amin, i.e. tercijarni amin, koji je tečan na sobnoj temperaturi. On ima jak miris ribe koji podsećan na amonijak.[6]
Hidrohloridna so, trietilamin hidrohlorid (trietilamonijum hlorid), je bezbojan, bezmirisan i higroskopan prah koji se razlaže zagrevanjem do 261 °C.
Reference
[уреди | уреди извор]- ^ X. Bories-Azeau, S. P. Armes, and H. J. W. van den Haak, Macromolecules 2004, 37, 2348 PDF
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (11th изд.). Merck Publishing. 1989. ISBN 091191028X. </noinclude>
- ^ The Hawthorn, BBC