Алкан

Алкани су засићени угљоводоници, тј. они не поседују вишеструке везе између атома угљеника. Разлика између метана и етана је само у једној CH2 групи. Разлика између сваког следећег алкана је такође у једној CH2 групи. Такав тип хемијских једињења чији се суседни чланови разликују за поједину групу (у овом случају за CH2 групу) назива се хомологи ред.[1]
Називају се још и парафини (од латинског parum affinis - недовољно афинитета) што је последица чињенице да алкани немају функционалну групу као центар реактивности молекула и да су генерално веома постојана хемијска једињења.
Представници и номенклатура
[уреди | уреди извор]У прошлости, док је био познат мали број органских једињења, свако је имало своје име. Међутим како је број познатих органских једињења растао, постало је јасно да је потребан нови систем по коме ће име органских једињења да показује састав и структуру тог органског једињења. Такав систем је усвојен 1892. године у Женеви. Од тог времена он се непрестано допуњава на састанцима комисије за номенклатуру Интернационалне уније за чисту и примењену хемију (IUPAC). Одлуке IUPAC-а поштују све земље света. Правила IUPAC-а су веома проста, име органског једињења је у ствари опис његове структуре: један део имена описује угљеников скелет, а други функционалне групе које су за тај скелет везане.
Прва четири члана хомологог низа носе називе метан, етан, пропан и бутан. Од алкана са пет угљеникових атома, имена се добијају када се на грчки број који означава број угљеникових атома дода наставак ан.

Алкани нормалног (опруженог) низа, n-алкани, су припадници хомологог низа. Рачвасти низови су са друге стране структурни изомери нормалног низа па их IUPAC-ова номенклатура тако и третира. Пре стандардизације номенклатуре, рачвасти алкани су добијали префиксе (изо-, нео-, terc-...) док је основни назив потицао од укупног броја угљеника у молекулу.
| Нормалан | Разгранат |
|---|---|
 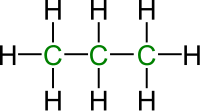 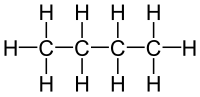 |
 |
IUPAC даје неколико основних правила за именовање свих алкана:
- Наћи најдужи низ
- најдужи низ постаје основни алкан док су све бочне групе супституенти тог основног низа
- Низ са више супституената има предност
- другачије речено, онај низ који има простије супституенте има приоритет
- Посматрај супституенте и именуј их
- уколико је бочни низ рачваст, име добија тако што се тражи најдужи низ почевши од угљеника код којег је дошло до рачвања, а затим се именују његови супституенти. Целокупан назив се ставља у заграду, а ако их је више, уместо традиционалних префикса ди-, три-, тетра-, за сложене супституенте користе се бис-, трис-, тетракис-.
- ради поједностављивања именовања бочних рачвастих низова, IUPAC дозвољава следеће тривијалне називе: изопропил, изобутил, sec-бутил, terc-бутил, неопентил.
- Нумерација почиње од оног краја коме је најближи супституент
- када су оба краја подједнако близу супституенту, нумерација се врши према првом месту разликовања односно тако да су позиције супституената означене што мањим бројевима
- Ређање назива супституената се врши по абецедном редоследу (а не нумерички)
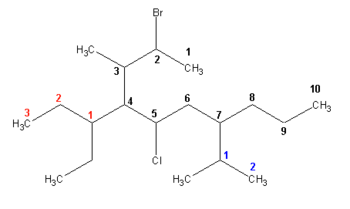
2-бром-4-(1-етилпропил)-5-хлор-3-метил-7-(1-метилетил)декан
Геометрија молекула
[уреди | уреди извор]Молекуларна геометрија алкана директно утиче на њихове физико-хемијске особине. Специфична геометрија је производ стварања ковалентне сигма везе између атома угљеника која је предусловљена хибридизацијом једне s и три p орбитале угљеника, који је увек четворовалентан у органским једињењима. sp3 хибридизација присутна је у свим алканима и она условљава тетраедарско просторно распоређивање хибридизованих атомских орбитала.
Дужина и угао између веза
[уреди | уреди извор]Дужина веза код алкана је релативно константна и износи за C-C везу: 1,54 А° а за C-H везу: 1,1 А°. Атомске орбитале су распоређење у замишљеном тетраедру тако да угао између C-H веза износи 109°28'. Сигма веза је релативно еластична и дозвољава ротирање око ње, а настаје чеоним коаксијалним преклапањем хибридних орбитала.
Конформације
[уреди | уреди извор]
Природа сигма веза између sp3 хибридизованих C атома у низу је таква да је могуће условно слободно ротирање молекула око осе те везе. Ово се дешава у циљу максималног смањења електростатичких одбојних сила између електронских облака орбитала. У шематски приказаним случајевима везе између угљеника и водоника налазе се постављене паралелно једна наспрам друге. Оваква конформација се назива заклоњена или еклипсна, и одликује је висок степен нестабилности због торзионог (еклипсног) напона који се јавља и тежи да искриви везу. Зато се, ротирањем око сигма везе, успоставља далеко стабилнија степеничаста конформација где су електронски облаци фазно померени а степен интеракције између супротних наелектрисања сведен на минимум. Овакви различити просторни облици називају се ротомери, а облици са најмањим садржајем енергије конформери. Резултујућа количина енергије је заправо резултанта више интеракција: торзионог напона, угаоног напона, ван дер Валсовог напона и напона услед деформације везе. Конформације етана су веома једноставне док оне виших алкана, а посебно циклоалкана имају далеко већу сложеност.
Налажење и лабораторијско добијање
[уреди | уреди извор]Алкани се у великим количинама могу наћи у нафти (чији највећи део чине) и у природном гасу (метан, етан, пропан, бутан). Метан настаје услед труљења органских материја и може се наћи у мочварама, а има га и у рудницима. Метан у рудницима представља веома велику опасност јер када се наиђе на његове залихе може да изазове експлозију јер при већим концентрацијама може и спонтано да се запали.
Листови карфиола, купуса, као и кора јабуке у себи садрже алкан C29H60 који служи као заштита од губитка влаге, док већина других биљака као заштиту користи биљне воскове који су по саставу естри.
Алкани се могу добити из разних једињења редукцијом. У лабораторији се метан добија загревањем натријум-ацетата са натријум хидроксидом:
- CH3COOH-Na + NaOH → CH4 + Na2CO3
Друге методе укључују:
- Каталитичку хидрогенизацију алкана на паладијумовој (или платине/никла) решетки
- R-CH2-CH=CH-R + H2 → R-CH2-CH2-CH2-R
- Редукцију алкил-халогенида у киселој средини
- RX + Zn + H+ → RH + Zn+ + X-
- Реакцијом Грињаревог реагенса (магнезијума у „сувом“ етру) и хидролизом добијеног производа
- RX + Mg → RMgX + H2O → RH + MgX(OH)
Физичке особине
[уреди | уреди извор]Физичке особине алкана зависе од неколико фактора. Први и најважнији је број угљеникових атома. Други је структура низа.
- Под нормалним условима алкани који садрже од 1 до 4 угљеникових атома су у гасовитом агрегатном стању, алкани који садрже од 5 до 17 угљеникових атома су у течном агрегатном стању, а са преко 18 су у чврстом.
- Сваки следећи представник хомологог низа има температуру кључања за 20-30 °C вишу од претходног. Ово се објашњава чињеницом да између молекула владају Лондонове силе а да се дипол далеко лакше индукује код већих молекула, па су код њих мећумолекулске силе веће.
- Рачвањем низа се увек смањује температура кључања. Ово се објашњава смањењем додирних површина молекула, што смањује дисперзионе силе.
Алкани се као и већина неорганских једињења растварају у неполарним растварачима, а у поларним (нпр. вода) се не растварају.
Хемијске особине - реакције
[уреди | уреди извор]Алкани су слабо реактивна хемијска једињења, под нормалним условима не реагују са јаким киселинама као што су сулфатна киселина и хлоридна киселина а ни са јаким базама као што су натријум хидроксид и калијум хидроксид. Алкани не реагују ни са оксидационим средствима као што су калијум перманганат или калијум дихромат, али је њихова оксидација могућа. Алкани су нереактивни јер су изграђени од сигма C-C-C веза. Ове везе се тешко раскидају јер је потребно уложити велику енергију за тај процес. Зато алкани реагују само на посебним условима.
Оксидација
[уреди | уреди извор]Оксидација је процес сагоревања угљоводика. При потпуном сагоревању било ког угљоводоника настаје угљеник(IV)-оксид(угљендиоксид) и вода.
- CH4 + 2O2 ---------> CO2 + 2H2O
Халогеновање
[уреди | уреди извор]За алкане је карактеристична реакција супституције халогеним елементима при чему настају деривати алкана - алкил халогениди. У механизам реакције укључени су слободни радикали, сама реакција је веома егзотермна и одвија се под специфичним условима. Одвија се у три фазе:
- Иницијација - у којој долази до хомолитичког раскидања ковалентне везе у молекулу халогена нпр. хлора. Да би се ово десило потребно је присуство сунчеве светлости односно ултравиолетног зрачења. Притом настају слободни радикали са по једним неспареним електроном који су иницијатори реакције.
- Cl2 → 2 Cl·
- Пропагација - у којој долази до реакције између слободних радикала и алкана. Најчешће је двостепена при чему је производ моносупституисан али у зависности од концентрације хлора, може доћи и до супституисања већег броја водоника.
- CH4 + Cl· → CH3· + HCl
- CH3· + Cl2 → CH3Cl + Cl·
- у вишку хлора, може даље да настаје:
- CH3Cl + Cl· → CH2Cl· + HCl
- CH2Cl· + Cl2 → CH2Cl2 + Cl·
- ...
- Терминација - након супституисања већег броја водоника, повећава се шанса судара и реакције слободних радикала међусобно односно њихове рекомбинације до неутралних молекула. Овиме нестају иницијатори реакције и она се постепено гаси. Производ реакције је услед тога увек смеша различитих продуката реакције чије се удео може претпоставити преко њихове статистичке дистрибуције.
- Cl· + Cl· → Cl2
- CH3· + CH3· → C2H6
- CH3· + Cl· → CH3Cl
Региоселективност халогена у реакцији са алканима
[уреди | уреди извор]У случају нижих алкана, као што су метан и етан, релативно је лако предвидети процентуалну дистрибуцију производа. Сама реактивност халогена, пак, такође варира са флуором као најреактивнијим, код кога је најтеже предвидети производе, и хлором и јодом са знатно мањом реактивношћу. Такође, присуство бочних група усложњава предвиђања јер постоји могућност супституисања како водоника из основног низа тако и оних са бочних група. У том случају за процену дистрибуције, користи се особина региоселективности коју показују халогени, а која се огледа у већем афинитету супституисања водоника са што секундарнијих угљеника. Не претерано велику улогу игра и позитиван индуктивни ефекат алкил група.
Познавање реактивности халогена као и њихове региоселективности посебно је важно у индустријским поступцима добијања алкил халогенида где се услови реакције подешавају тако да се добије највећи проценат жељеног производа.
| алкан | F (25 °C) | Cl (25 °C) | Br (150 °C) |
| H3C-H | 0,5 | 0,004 | 0,002 |
| RH2C-H | 1 | 1 | 1 |
| R2HC-H | 1,2 | 4 | 80 |
| R3C-H | 1,4 | 5 | 1700 |
Стабилност алкил-радикала
[уреди | уреди извор]
Приликом слободнорадикалског халогеновања алкана настају алкил-радикали који у зависности од почетног реактанта могу да буду примарни, секундарни или терцијарни. То су sp2 хибридизоване, планарне честице. Стабилност овако добијених алкил-радикала варира и објашњава се појавом хиперконјугације. Наиме, радикалске p орбитале се преклапају са сигма орбиталама C-C веза стабилизујући радикал. Самим тим, што се више бочних група налази на радикалском угљенику, радикал је стабилнији и већа је вероватноћа његовог настанка. Дужи низови, у циљу настајања што стабилнијег радикала, подлежу и скелетном премештању чиме се често добијају наизглед неочекивани производи. С тим треба напоменути и да је метил-радикал веома нестабилна честица.
Краковање (пиролиза)
[уреди | уреди извор]Краковање или пиролиза је процес разлагања угљоводоника на угљеник и водоник или неки други угљоводоник и водоник. Процес се обавља на врло високим температурама(преко 500 °C) и без ваздуха. Овај процес је веома битан у индустрији нафте.
- CH4 --> C + 2H2, и
- C2H6 --> C2H4 + H2
Примена алкана
[уреди | уреди извор]Алкани се употребљавају као гориво. Користе се и за производњу великог броја органских супстанција у хемијској индустрији.
Хазарди
[уреди | уреди извор]Метан је запаљив, експлозиван и опасан за удисање; пошто је то гас без боје и мириса, посебан опрез се мора водити око метана.[2] Етан је такође изузетно запаљив, експлозиван и опасан за удисање.[3] И једно и друго може изазвати гушење.[2][3] Пропан је такође запаљив и експлозиван,[4] и може изазвати поспаност или несвест ако се удише.[4] Бутан представља исте опасности као и пропан.[5]
Алкани такође представљају претњу по животну средину. Разгранати алкани имају мању биоразградљивост од неразгранатих алкана.[6] Метан се сматра гасом стаклене баште који је најопаснији по животну средину,[7] иако је количина метана у атмосфери релативно мала.[7] Према подацима из априла 2022, концентрације метана у атмосфери биле су око 1910 ppb.[8]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ а б „CDC - METHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Приступљено 19. 9. 2017.
- ^ а б „CDC - ETHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Приступљено 19. 9. 2017.
- ^ а б „CDC - PROPANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Архивирано из оригинала 23. 11. 2017. г. Приступљено 19. 9. 2017.
- ^ „CDC - BUTANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov. Приступљено 19. 9. 2017.
- ^ Woodside, Gayle; Kocurek, Dianna (26. 5. 1997). Environmental, Safety, and Health Engineering. John Wiley & Sons. ISBN 9780471109327.
- ^ а б „Pollutant Fact Sheet”. apps.sepa.org.uk. Архивирано из оригинала 28. 01. 2020. г. Приступљено 19. 9. 2017.
- ^ „Increase in atmospheric methane set another record during 2021”. www.noaa.gov. 7. 4. 2022. Приступљено 2023-02-17.
