Ковалентна веза

Ковалентна веза се образује између атома неметала, стварањем заједничких електронских парова.[1][2] Ковалентна веза може бити поларна, неполарна и координантна (у зависности од тога атоми којих хемијских елемената ступају у везу).[3]
- Неполарна ковалентна веза подразумева да се електронски парови једнако привлаче језгру атома у молекулу (O2,N2,CH4, ...)
- Поларна ковалентна веза подразумева да електронски пар привлачи више једно језгро атома од другог. (HCl, HF, HBr, ...)
- Координантна веза подразумева да електронски пар даје само један атом (донор), други атом се назива акцептор (NO, SO2, SO3, ...)
Ковалентна веза је својствена по уједначеном учешћу два атома за разлику од јонске везе. Најпростија ковалентна веза је код атома водоника, система са два протона и два електрона. Како појединачни атоми прилазе један другом, таласне функције електрона постају деформисане и концентрисане у региону између два протона. Укупно привлачење електрона сваком протону је јаче од одбијања два протона или два електрона. Привлачна сила је добијена од пара електрона, по једног из сваког атома, са наелектрисањем које је концентрисано у региону између два атома. Енергија ковалентне везе у молекулу водоника H2 је -4.48 eV.[4]
Принцип искључења дозвољава да се два електрона налазе у истом делу простору (тј. да буду у истом просторном квантном стању) само кад имају супротне спинове. Када су спинови паралелни, принцип искључења не дозвољава молекуларно стање које би било најповољније из аспеката енергије (са оба електрона у региону између атома). Супротни спинови су основни услов за ковалентну везу, и не могу више од два електрона да учествују у таквој вези. Ипак, атом са више електрона у својој спољној љусци може да формира неколико ковалентних веза. Спајање атома водоника и угљеника, од централне важности у органској хемији, је пример. У молекулу метана (CH4) атом угљеника је у центру правилног тетраедра, са атомом водоника у сваком углу. Атом угљеника има четири електрона у L љусци, и сваки од ових четири електрона формира ковалентну везу са једним од четири атома водоника. Слични облици се појављују у још комплекснијим органским молекулима.[4]
Због улоге принципа искључења, ковалентне везе су веома дирекционе. У таласној функцији молекула метана сваки од угљеникових четири валентних електрона је у комбинацији 2s и 2p таласних функција што се назива хибридна таласна функција. Вероватноћа налажења електрона је највећа у теменима тетраедра. Ова симетрична расподела умањује преклапања таласних функција за сваки пар електрона, а тиме смањује одбојну потенцијалну енергију.[4]
Јонске и ковалентне везе представљају два екстрема у молекуларном везивању, али не постоји оштра граница између ова два типа. Често се налази парцијални трансфер једног или више електрона из једног атома у други. Као резултат, многи молекули са различитим атомима, имају моменте електричног дипола, што је у ствари премоћ позитивног наелектрисања на једном крају и негативног на другом. Такви молекули су названи поларни молекули. Молекули воде имају велике моменте дипола; и то је разлог за изузетно велику диелектричну константу течне воде.[4]
Настанак хемијских веза
[уреди | уреди извор]
У природи све тежи минималној енергији. Тако је и енергија неког хемијског једињења мања од збира енергија појединачних елемената (види дијаграм). Повезивањем атома хемијским везама у једињења настаје стање минималне енергије. Хемијска веза је заправо сила која повезује атоме у неком молекулу или структури. Хемијских веза има више врста, а која ће хемијска веза повезати атоме зависи од грађе самих атома и њихових својстава. Постоје два основна начина повезивања атома. Увек се ради о томе да се електрони атома прегрупишу. Атом може потпуно предати или примити један или више електрона (јонска веза), алтернативно, два атома могу делити електроне (ковалентна веза).
Гилберт Њутн Луис је предложио приказ настајања хемијске везе симболом атома и тачкама које представљају спољашње или валентне електроне. Луис је претпоставио да сваки атом тежи октетној електронској конфигурацији, по узору на племените гасове, осим хелијума који има дублетну конфигурацију. Таква конфигурација истовремено има најмању енергију.[5]
Ковалентна веза између истоврсних атома
[уреди | уреди извор]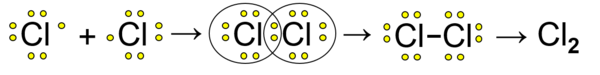



Ковалентна веза повезује атоме неметала. Атоми неметала имају велику енергију јонизације и имају велик електронски афинитет, тешко губе електрон, зато се такви атоми повезују преко заједничких електронских парова. Пример је настанак молекула хлора, Cl2:
Сваки атом хлора има по седам електрона, а један од електрона атом даје у везни и заједнички електронски пар. Поделом заједничког електронског пара оба су атома постигла стабилну електронску конфигурацију племенитог гаса аргона, дељењем електрона сваки атом их има по осам.
Приближавањем два атома хлора њихове атомске орбитале се преклапају и настаје процесом хибридизације заједничка молекулска орбитала која садржи везни електронски пар, тако је настала једнострука ковалентна веза. У молекулу хлора сваки атом има такође по три невезана електронска пара (цртеж).
Кисеоник је постигао октетну конфигурацију са два везана електронска пара и настала је двострука ковалентна веза. Азот постиже октетну конфигурацију с три везана електронска пара и настала је трострука ковалентна веза. Ковалентне хемијске везе између истоврсних атома још се називају хомонуклеарне и оне су такође неполарне.[5]
Атоми имају електронску конфигурацију спољашње валентне љуске која се може прочитати у Периодном систему елемената. Приближавањем атома њихове спољашње љуске се почну преклапати. Заједнички електронски пар ковалентне везе настане у заједничкој молекулској орбитали, која је настала од појединачних атомских орбитала. Експериментална потврда да су парови подељени најјасније проистиче из дифракције рендгенских зрака. Слика уз текст приказује распоред густине електрона око два језгра атома водоника у молекулу водоника. Криве повезују подручја исте густине електрона. Највећа густина је око самих језгара, а посебно је густина електрона велика између два атомска језгра. Електронски пар се налази између два позитивно набијена језгра, он привлачи оба језгра и делује као нека врста „електростатичког лепка”. То је основни разлог јачине ковалентних веза и стабилности молекула.[6]
Ковалентна веза између разноврсних атома
[уреди | уреди извор]
Погледајмо како настају једињења хлора, кисеоника, азота и угљеника са водоником.
- Сви халогени елементи с водоником формирају халогеноводике, молекуле у којима је увек везан један атом халогеног елемента са атомом водоника једноструком везом. Атом хлора у овом примеру удружује један електрон, атом водоника такође удружује један електрон у заједнички везни пар.
- Атом кисеоника из 16. групе елемената периодног система има у валентној љусци шест електрона, зато мора да са два атомима водоника формира два везна електронска пара, и тако настају две једноструке везе. Тиме је атом кисеоника остварио октет, атоми водоника су остварили дублет, а заједно три атома имају најнижу могућу енергију.
- Атом азота има у валентној љусци пет електрона и зато мора с три атома водоника да формира три везна електронска пара, и стога настају три једноструке везе. Тиме је атом азота остварио октет, атоми водоника су остварили дублет, а заједно четири атома имају најнижу могућу енергију.
- Атом угљеника има у валентној љусци четири електрона и зато мора с четири атома водоника да формира четири везна електронска пара, и тако настају четири једноструке везе. Тиме је атом угљеника остварио октет, атоми водоника су остварили дублет, а заједно пет атома имају најнижу могућу енергију.
Ковалентне хемијске везе између разноврсних атома још се називају хетеронуклеарне. Оне су исто тако поларне.[5]
Усмереност ковалентне везе у простору
[уреди | уреди извор]
Средишњи атом неког молекула најчешће је окружен са укупно четири електронска пара чиме тај атом постиже октетну конфигурацију. Угљеник у молекулу метана везан је са четири атомима водоника са четири везна електронска пара. Азот у молекулу амонијака је везан са три везна пара, а има и један електронски пар који не учествује у стварању хемијске везе. Кисеоник је у молекулу воде везан са два везна електронска пара, а има и два електронска пара који не учествују у хемијској вези.
Од броја атома у молекулу, као и од броја везних и невезних електронских парова око средишњег атома, зависе и међусобни положаји атома у простору и углови између ковалентних веза.
У молекулу метана сва су четири електронска пара подељена. Због истоврсног набоја они се настоје међусобно што више удаљити. На тај начин чине највећи могући угао у простору, који је једнак између све четири ковалентне веза и износи 109,5°. Тај угао је тетраедарски па и молекул метана има облик тетраедра. У молекулу амонијака угао је нешто мањи, износи 107° јер се невезни електронски парови јаче одбијају од везних. Молекул амонијака има облик ниске тростране пирамиде. У молекулу воде угао је још мањи из истог разлога, а молекул има V-облик. Ковалентна веза је дакле усмерена у простору.[5]
Карактеристике ковалентне везе
[уреди | уреди извор]
Значајне особине ковалентне везе су:
- Ковалентна веза повезује атоме неметала
- Веза настаје формирањем заједничких електронских парова између два атома
- Повезивањем атома настају нове сложене честице молекула
- Веза може бити једнострука, двострука и трострука
- Ковалентна веза је просторно усмерена
- Снага ковалентне везе лежи у електростатичкој сили привлачења између заједничких парова (-) и оба језгара (+) у вези.
Одступања од правила октета
[уреди | уреди извор]
Ако број парова електрона око средишњег атома одступа од броја четири (осам електрона) говори се о одступању од правила октета.
Берилијум хлорид (BeCl2) је ковалентан молекул иако је берилијум метал. Око берилијума се налазе се два везна електронска пара која се одбијају и атоми у молекулу су максимално удаљени, угао између ковалентних веза је 180°. Молекул је линеаран.
Бор хлорид (BCl3) има три ковалентне везе. Три електронска пара су највише удаљена ако су углови 120° међу ковалентним везама. Молекул бор хлорида је планаран.
Фосфор хлорид (PCl5) има пет ковалентних веза. Пет електронских парова садржано је у пет ковалентних веза које затварају углове од 90° и 120°, а молекул има облик тригоналне бипирамиде.
Сумпор флуорид (SF6) има шест ковалентних веза. Шест ковалентних веза са шест електронских парова затварају углове 90°и 180° и везе су усмерене према врховима октаедра.
Више од четири парова електрона могу имати само средишњи атоми који могу попуњавати d-орбитале.
Луисов приказ хемијске везе је један од теоријских модела који не може да објасни грађу сложенијих молекула. То тумаче новије теорије као што је VESPR - енгл. Valence shell electron pair repulsion (одбијање електронских парова валентне љуске).[5]
Дужина и енергија ковалентне везе
[уреди | уреди извор]

Молекул етена (H2C=CH2) је једноставни пример молекула са двоструком везом. Истраживања грађе молекуле етена показала су да је тај молекул планаран, тј. сви атоми леже у једној равни. Ковалентне везе међусобно затварају угао од 120°. Када се атоми вежу двоструком везом, у вези учествују два пара електрона. Једна веза остварује се преклапањем електронских облака уздуж осе молекула. Друга веза, односно електронски облак који припада другом пару електрона, распростире се изнад и испод равни коју чине угљеникови и водоникови атоми. Електронски облак тог другог пара електрона је мање густине (више је удаљен од језгара) па је двострука веза слабија од две једноструке. Зато угљоводоници са двоструким везама лакше ступају у хемијске реакције од оних са једноструким везама. Такође је утврђено да делови молекула око двоструке ковалентне везе не могу да ротирају док за ротацију делова молекула око једноструке везе нема препрека.
Молекул етина (H−C≡C−H) је пример једињења са троструком ковалентном везом. Енергија троструке везе је такође мања од три једноструке. Енергија једноструке везе C−C је 335 kJ/mol, двоструке C=C везе је 610 kJ/mol, а троструке C≡C вете 836 kJ/mol. Зато су угљеникова једињења с троструком везом још реактивнија од једињења са двоструким везама.[7]
Код настајања ковалентне везе атомске орбитале два атома улазе једна у другу, стога је удаљеност између језгара повезаних атома увек мања од збира полупречника атома. Удаљеност између језгара атома у молекулу назива се дужином ковалентне везе. Дужина једноструке C−C ковалентне везе је 154 pm, двоструке C=C 135 pm, а троструке C≡C 120 pm. Веза је то јача што је дужина везе мања, а енергија везе већа. Свака хемијска веза је одређена дужином и енергијом везе.[5]
Поларност ковалентне везе
[уреди | уреди извор]
Електронегативност атомa је његова способности да привуче електронски пар који унутар молекула дели с другим атомом у ковалентној вези.[8]
Ковалентна веза зато може бити неполарна и поларна. У неполарној вези између два једнака атома (H2, O2, N2) нема прерасподеле набоја и атоми су електрично неутрални. Веза постаје поларна када стварање везе оставља делимичне набоје на атомима. Молекул хлороводоника има поларну ковалентну везу, јер долази до малог помака електрона према атому хлора и настаје: (δ је ознака мале вредности). То се догађа зато што атоми хлора и водоник имају различиту електронегативност, способност привлачења заједничког електронског пара. Сличан помак догађа се и у молекулу воде:. Поларност везе значи да веза није чисто ковалентна већ има део јонског карактера.
Мера за електронегативности атома је коефицијент електронегативности, χ (грчко хи), који може имати вредност до 4,0. Вредности коефицијента електронегативности израчунавају се из енергије јонизације и електронског афинитета неког атома.
| Електронегативност неких атома | ||||||
|---|---|---|---|---|---|---|
| H: 2,20 | ||||||
| Li: 0,98 | Be: 1,57 | B: 2,04 | C: 2,55 | N: 3,04 | O: 3,44 | F: 3,98 |
| Na: 0,93 | Mg: 1,31 | Al: 1,61 | Si: 1,90 | P: 2,19 | S:2,58 | Cl: 3,16 |
Електронегативности атома омогућавају предвиђање ступња поларности веза. Разлика електронегативности кисеоника и водоника доводи до помака електрона према кисеонику, тежишта позитивног и негативног набоја у молекулу нису на истом месту, молекул је поларан и понаша се као дипол (види слику). Зато је вода изразито поларан растварач. Мера поларности неког молекула је величина названа диполни момент.[6] Поларност молекула изразито утиче на цели низ својстава материје: тачку топљења, тачку кључања, агрегатно стање, густину, својство растворљивости, хидратацију.
Референце
[уреди | уреди извор]- ^ Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- ^ Sears, Francis Weston; Young, Hugh D.; Freedman, Roger A.; Ford, A. G. (2004). Sears and Zemansky's university physics: with modern physics. San Francisco: Pearson Addison Wesley. ISBN 978-0-8053-8684-4.
- ^ а б в г Young & Freedman,. University Physics (11th изд.). ISBN 978-0-8053-8684-4.
- ^ а б в г д ђ Habuš, Tomašić, Liber: Opća kemija 1, 1. izd., Profil. . Zagreb. 2014. pp. 102. ISBN 978-953-12-1434-6..
- ^ а б P. W. Atkins, M. J. Clugston: Načela fizikalne kemije, Školska knjiga. . Zagreb. 1996. pp. 34-43. ISBN 978-953-0-30908-1.
- ^ Sikirica, Korpar, Čolig: Kemija s vježbama 1, Školska knjiga. . Zagreb. 2000. pp. 122-124. ISBN 978-953-0-20540-6.
- ^ [1] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija, mrežno izdanje: Elektronegativnost, Pristupljeno 31.3.2017.
Литература
[уреди | уреди извор]- „Covalent bonding – Single bonds”. chemguide. 2000. Приступљено 5. 2. 2012.
- „Electron Sharing and Covalent Bonds”. Department of Chemistry University of Oxford. Приступљено 5. 2. 2012.
- „Chemical Bonds”. Department of Physics and Astronomy, Georgia State University. Приступљено 5. 2. 2012.
Спољашње везе
[уреди | уреди извор]- Covalent Bonds and Molecular Structure Архивирано на сајту Wayback Machine (10. фебруар 2009)
- Structure and Bonding in Chemistry—Covalent Bonds


