Родијум
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општа својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | родијум, Rh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрнасто бео металичан | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| У периодноме систему | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број (Z) | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група, периода | група 9, периода 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | прелазни метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 102,90550(2)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 16, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка топљења | 2237 K (1964 °C, 3567 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка кључања | 3968 K (3695 °C, 6683 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина при с.т. | 12,41 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| течно ст., на т.т. | 10,7 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота фузије | 26,59 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота испаравања | 493 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 24,98 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Напон паре
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | 2,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 719,7 kJ/mol 2: 1740 kJ/mol 3: 2997 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски радијус | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентни радијус | 142±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Остало | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | постраничноцентр. кубична (FCC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина звука танак штап | 4700 m/s (на 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. ширење | 8,2 µm/(m·K) (на 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. водљивост | 150 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електроотпорност | 43,3 nΩ·m (на 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетни распоред | парамагнетичан[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | +111,0·10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Јангов модул | 380 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул смицања | 150 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул стишљивости | 275 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов коефицијент | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдоћа | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Викерсова тврдоћа | 1100–8000 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдоћа | 980–1350 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS број | 7440-16-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриће и прва изолација | Вилијам Хајд Воластон (1804) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Родијум (Rh, грч. rhodium) метал је VIIIB групе са атомским бројем 45. Има 34 изотопа чије се атомске масе налазе измађу 94—112. Постојан је само изотоп 103 који представља 100% природног састава изотопа родијума.[4] Родијум је добио име по грчкој речи rhodon што значи ружа. Откривен је 1803. године од стране В.Х. Воластона у Лондону. У земљиној кори је заступљен у веома малој количини од 10−4 ppm (енгл. parts per million). Добија се из неких руда бакра и никла у којима се налази око 0,1% родијума.[5]
У чистом облику је сјајан, сребрносив метал. Не реагује са водом, ваздухом и киселинама, али реагује са јаким базама. У чистом облику се не користи због његове веома високе цене. Цена родијума је око 6100 америчких долара за 1 фину унцу.[6]
Историја
[уреди | уреди извор]Родијум је открио Вилијам Хајд Воластон 1803. у узорку руде сирове платине из Јужне Америке. У истој руди, Воластон и Смитсон Тенант открили су још три друга платинска метала: паладијум, осмијум и иридијум. Прво су руду растворили у „царској води” (aqua regia). Раздвојио се растворљиви део и црни нерастворљиви остатак, у којем је Тенант пронашао осмијум и иридијум. Воластон је успео из раствора царске воде да исталожи родијум те неке друге састојке са цинком у праху.
Након одвајања бакра и олова разблаженом азотном киселином те поновним растварањем у царској води и додавању натријум хлорида настао је Na3[RhCl6] · n H2O, да би након испаравања течности преостала ружичасто-црвена со. Из ње је Воластон екстракцијом са етанолом и редукцијом са цинком успео да добије елементарни родијум. Изабрао је име по старогрчкој речи ῥόδεος rhodeos („ružičasto-crven”), пошто многа једињења родијума показују управо ту боју.[7]
Од 1820. међу првим начинима употребе нових метала била је израда врхова налив-пера, за шта се употребљавала легура родијума и калаја. Међутим, она је касније замењена тврђим легурама осмијума и иридијума.[7]
Особине
[уреди | уреди извор]
Физичке
[уреди | уреди извор]Родијум је сребрено-светли, тешко топиви, тврди племенити метал. Родијум је доста тврђи од злата или платине, али и поред тога се лако извлачи у жице и може се ковати. По многим особинама може се упоредити са другим платинским елементима. Тако на пример тачка топљења родијума износи 1966 °C што је између оне код платине (1772 °C) и рутенијума (2334 °C). Густина елемента од 12,41 g/cm3 такође се може поредити са „суседним” елементима из периодног система рутенијумом и паладијумом. Родијум има највишу проводљивост топлоте и електричне струје од свих платинских метала. На температури испод 0,9 K родијум постаје суперпроводник.[8]
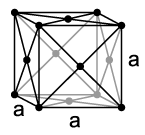
Родијум се кристализује попут кобалта и иридијума у кугластом кубичном кристалном систему (тип бакра) са просторном групом Fm3m (бр. 225) и са параметром решетке a = 380,4 pm као и четири формулске јединице по елементарној ћелији.[9]
Хемијске
[уреди | уреди извор]Као типични племенити метал, родијум је веома хемијски инертан. Након иридијума је најмање реактивни платински метал. Он реагује са кисеоником и хлором тек при температури од 600 до 700 °C градећи родијум(III) оксид односно родијум(III) хлорид. Такође са најреактивнијим халогеном флуором реагује тек при високој температури дајући родијум(VI) флуорид. Минералне киселине не нападају овај метал. Једини изузетак чини фино иситњени родијум, који се врло споро раствара у царској води и концентрованој сумпорној киселини.
Метал реагује са неким истопљеним солима те се на тај начин може одвојити из смесе. Соли, са којима је то могуће, су натријум хидрогенсулфат, калијум дисулфат, цијанид и натријум карбонат. Кисеоник се раствара у течном родијуму. При његовом хлађењу и очвршћивању, кисеоник се из њега поновно ослобађа.
Изотопи
[уреди | уреди извор]Позната су укупно 33 изотопа као и 20 нуклеарних изомера родијума.[10] Природни родијум се у потпуности састоји из једног изотопа 103Rh те стога спада међу 22 позната једноизотопна елемента. Вештачки изотопи са најдужим временом полураспада су 101Rh који се распада на 101Ru за 3,3 године (t1/2) путем електронског захвата. Незнатним делом његов распад иде преко метастабилног језгра изомерним прелазом у 102Rh.[10] Краткоживеће језгро изотопа 105Rh са временом полураспада од 35,88 сати нашло је примену у медицини као трејсер.
Распрострањеност
[уреди | уреди извор]Родијум је, заједно са рутенијумом и иридијумом, а после ренијума, један од најређих нерадиоактивних метала у континенталном делу Земљине коре. Његов удео на Земљи износи приближно 1 ppb (један грам на 1.000 тона).[11] У природи, родијум се може јављати и у самородном облику, па је због тога признат и као минерал. Међу најважније типске локалитете родијума убрају се округ Стилвотер у Монтани те залив Гудњуз на Аљаски. На тим локалитетима, родијум прати, између осталих, друге платинске метале и злато.[12]
Поред елементарног родијума, познати су и неки његови минерали као што су бовијет, генкинит или мијасит. Међутим, и они су као и елементарни родијум веома ретки те за његово добијање не играју важнију улогу. Најважнија налазишта елемента налазе се у сулфидним никл-бакарним рудама, којих највише има у Јужноафричкој Републици, Канади (Садбери) и Сибиру. У депозитима злата у Мексику такође се јавља родијум у значајнијим количинама. При преради ових руда, родијум се таложи заједно са другим платинским металима те се на крају обраде мора издвојити из њих.
Добијање
[уреди | уреди извор]
Добијање металног родијума је као и добијање других платинских метала веома захтевно. То се односи првенствено на сличност с њима и слабу реактивност те групе елемената, због чега се они изузетно тешко одвајају један од других. Полазна сировина за добијање родијума је анодни муљ који се таложи као споредни производи при електролизи у производњи бакра и никла. Најпре се муљ раствара у царској води. Прво се раствара злато, платина и паладијум, док рутенијум, осмијум, родијум и иридијум као и сребро у виду сребро хлорида преостаје нерастворено. Сребро хлорид се загрејавањем са олово карбонатом и нитратном киселином преводи у растворљиви сребро нитрат и тако уклања.
Да би се родијум одвојио од других елемената, нерастворљиви остатак се топи заједно са натријум бисулфатом. Настаје родијум сулфат (Rh2(SO4)3) који је растворљив у води, који се може исталожити с водом. Растворени родијум се најпре таложи са натријум хидроксидом у виду родијум-хидроксида Rh(OH)3. Следеће фазе процеса производње су растварање у хлороводичној киселини чиме настаје H3[RhCl6] те таложење са натријум нитритом и амонијум хлоридом у облику (NH4)3[Rh(NO2)6]. Да би се дошло до елементарног родијума, то једињење се мацерира хлороводоничном киселином чиме настаје растворљиви комплекс (NH4)3[RhCl6]. Након што се испаравањем уклони вода, помоћу водоника се може редуковати до прашкастог родијума.
-
- Реакција амонијум-хексахлорородата са водоником даје родијум
Изотопи родијума настају као споредни производи при цепању језгра уранијума 235U те се могу екстраховати из потрошених горивих елемената. Због радиоактивности до данас не постоји нити једна комерцијална употреба тако добијеног родијума.[8]
Родијум се производи у врло ограниченом обиму, тако да је светска производња у 2005. износила само 23,5 тоне. Од укупне производње око 83,2% се односи на Јужноафричку Републику. Други највећи произвођач је била Русија (11,9%) након које следе Канада и Зимбабве.
Употреба
[уреди | уреди извор]
Као и други платински метали, родијум у многим процесима делује каталитички. Не само да метални родијум делује тако, него и његова једињења и легуре са другим платинским металима, те се стога у те сврхе и они користе. Осим каталитичких, постоје и могућности употребе родијума у друге сврхе, али су начини употребе врло ограничени због његове високе цене.
Најважнија област у којој се користи родијум су катализатори у возилима. Он у њима служи да омогући и убрза редукцију азот-моноксида до елементарног азота. Ако се уместо родијума користи платина или паладијум, долази до прекомерног настанка амонијака и диазот-моноксида.[13] Део родијума се користи за катализаторе у индустрији азотне киселине. У такозваном Оствалдовом процесу за каталитичко сагоревање амонијака до азот-моноксида употребљавају се мрежице, које се састоје од легуре платине са родијумом где је његов удео 10%. Кориштењем родијума повећава се постојаност и принос реакције у односу на кориштење чисте платине.[14] Такође и у Андрусовом процесу за производњу цијановодичне киселине као катализатори се користе легуре платине и родијума.[8]
Референце
[уреди | уреди извор]- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Lide, D. R., ур. (2005). „Magnetic susceptibility of the elements and inorganic compounds”. CRC Handbook of Chemistry and Physics (PDF) (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Архивирано из оригинала 03. 03. 2011. г. Приступљено 15. 01. 2021.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ „Price History Charts”. Архивирано из оригинала 15. 09. 2010. г. Приступљено 20. 06. 2010.
- ^ а б W. P. Griffith (2003). „Bicentenary of Four Platinum Group Metals, Part I Rhodium und Palladium”. Platinum Metals Review. 47 (4): 175—183.
- ^ а б в Hermann Renner; et al. (2001). „Platinum Group Metals and Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 9783527303854. doi:10.1002/14356007.a21_075.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica, 1974, B30, str. 193–204.
- ^ а б G. Audi; O. Bersillon; J. Blachot; A. H. Wapstra (2003). „The NUBASE evaluation of nuclear and decay properties” (PDF). Nuclear Physics. A 729 (1): 3—128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. Архивирано из оригинала 15. 12. 2013. г. Приступљено 15. 01. 2021.
- ^ David R. Lide (2003). „Properties of the Elements and Inorganic Compounds”. CRC Handbook of Chemistry and Physics (84 изд.). Boca Raton, Florida: CRC Press.
- ^ Anthony; et al. (1990). „Rhodium”. Handbook of Mineralogy (PDF) (1 изд.). стр. 101.
- ^ Votsmeier, Martin; Kreuzer, Thomas; Lepperhoff, Gerhard (2003). „Automobile Exhaust Control”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a03_189.
- ^ A. F. Holleman; E. Wiberg; N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 изд.). Berlin: de Gruyter. стр. 1697. ISBN 978-3-11-017770-1.
Спољашње везе
[уреди | уреди извор]- Rhodium at The Periodic Table of Videos (University of Nottingham)
- Rhodium Technical and Safety Data Архивирано на сајту Wayback Machine (11. октобар 2007)
- CDC - NIOSH Pocket Guide to Chemical Hazards



![{\displaystyle \mathrm {2\ {(NH_{4})}_{3}{[RhCl_{6}]+3\ H_{2}}\longrightarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6e9d6fecceb9096043e2cfc8462d519c2a33609)
