Течност



Течности су материје течног агрегатног стања.[5] Такве материје немају сталан облик, али имају сталну запремину, јер су привлачне силе међу њиховим честицама слабије па се могу слободније кретати. Течности, према томе, лако мењају облик односно заузимају облик посуде у којој се налазе. У хемији се материје течног агрегатног стања означавају малим словом L (енгл. liquid — „течност“). У периодном систему елемената најмање је течних елемената,[6] док су молекуларне течности врло распрострањене у природи.
Течност је скоро некомпресибилан флуид[7][8] који задржава (скоро) константну запремину независно од притиска. Као таква, течност је једно од четири фундаментална стања материје (при чему су друга: чврсто стање, гас, и плазма), и она је једино стање са одређеном запремином без фиксног облика. Течност је сачињена од малих вибрирајућих честица материје, као што су атоми, који су повезани интермолекуларним везама.[9][10] Вода је далеко најраспрострањенија течност на Земљи. Попут гасова, течност има способност протицања и заузима облик суда. Вежина течности је отпорна на компресију, мада се неке могу компримовати. За разлику од гасова, течност се не шири да би заузела сваки део простора у суду, и одржава релативно константну густину. Дистинктно својство течног стања је површински напон,[3][4] који доводи до феномена влажења.[11][12]
Густина течности је обично близу густине чврсте материје, и знатно је већа од гаса. Стога су течне и чврсте материје назвање кондензованим материјама.[13] С друге стране, течности и гасови имају заједничку способност течења, и називају се флуидима.[14] Мада је течна вода изобилна на Земљи, то стање материје је у ствари најмање заступљено у познатом свемиру, пошто је за постојање течности неопходан релативно узак опсег температуре/притиска. Већина познате материје у свемиру је у гасовитој форми (са траговима детектабилне чврсте материје) као интерстеларни облаци или облику плазме у звездама.
Увод
[уреди | уреди извор]
Течност је једно од четири примарна стања материја, док су остала чврсто стање, гас и плазма. Течност је флуид. За разлику од чврсте материје, молекули течности имају знатно већи број степена слободе кретања. Силе које држе молекуле течности заједно у чврстој материји су само привремене у течности, што омогућава течности да тече, док чврсте материје остају круте.
Течност, попут гаса, испољава својства флуида. Течност може да тече, заузима облик суда, и ако се стави у затворени суд равномерно распоређује примењени притисак на све површине суда. Ако се течност стави у кесу, њој се може дати било који жељени облик. За разлику од гаса, течности се са лакоћом увек не мешају са другим течностима, не попуњавају увек у потпуности доступни простор у суду, оне формирају своју сопствену површину, и не подлежу у знатној мери компримовању, изузев под екстремно високим притисцима. Та својства чине течност подесном за примене у хидраулици.[15][16]
Честице течности су чврсто везане, али оне нису круте. Оне имају способност слободног кретања једна око друге, што производи ограничене степене мобилности честица. са повећањем температуре, појачане вибрације молекула узрокују повећање растојања између молекула. Кад течност достигне своју тачку кључања,[17] кохезивне силе које блиско везују молекуле заједно пуцају, и течност прелази у гасовито стање (осим случаја суперзагревања[18]). Ако се температура смањује, растојање између молекула постаје мање. Кад течност достигне своју тачку смрзавања молекули се обично фиксирају у веома специфичном уређењу,[19] тј. долази до кристализације, и везе између њих постају круће, чиме течност прелази у чврсто стање (осим у случају суперхлађења[20][21]).
Примери
[уреди | уреди извор]Једина два елемента која су течна под стандардним условима температуре и притиска су: жива и бром. Четири додатна елемента имају тачке топљења незнатно изнад собне температуре: францијум, цезијум, галијум и рубидијум.[22] Металне легуре које су течне на собној температури су NaK, натријум-калијумска метална легура, галинстан, топљива течна легура, и неки амалгами (легуре живе).
Чисте супстанце које су течне под нормалним условима обухватају воду, етанол и многе друге органске раствараче. Течна вода је од виталног значаја у хемији и биологији; сматра се да је неопходна за постојање живота.
Неорганске течности обухватају воду, магму, неорганске неводене раствараче и многе киселине.
Међу важним течностима у свакодневној употреби су течни раствори као што су кућни избељивачи, и смеше разних супстанци као што су минерална уља и бензин, емулзије као што су преливи или мајонез, суспензије попут крви, и колоиди као што су боје и млеко.
Многи гасови се могу превести у течно стање хлађењем, чиме настају течности као што су течни кисеоник, течни азот, течни водоник и течни хелијум. Сви гасови се не могу превести у течност на атмосферском притиску, на пример угљен-диоксид се може превести у течност само на притиску изнад 5,1 atm.
Неки материјали се не могу класификовати у оквиру три класична стања материје; они поседују својства слична чврстој материји и течностима. Примери таквих материјала су течни кристали, који се користе за израду ЛЦД дисплеја, и биолошке мембране.
Вода
[уреди | уреди извор]Најраспрострањенија, најпознатија, најважнија и најнеопходнија текућина за човјека је вода. Она чини око 70% површине наше планете а и око 65% нашег организма тако да без ње не би било ни живота...

Примене
[уреди | уреди извор]Течности имају мноштво употреба, као лубриканти, растварачи, и расхладне течности. У хидрауличким системима, течности се користе за пренос снаге.
У трибологији, течности се изучавају због њихових својстава као лубриканти. Лубриканти као што су уља се бирају због њихове вискозности и проточних карактеристика које су подесне широм опсега операционе температуре дате компоненте. Уља се често користе у моторима, трансмисијама, обради метала, и хидрауличким системима због њихових добрих лубрикационих својстава.[23]
Многе течности се користе као растварачи, за растварање других течности и чврстих материја. Раствори налазе примену у мноштву различитих апликација, укључујући боје, заптивне смесе, и лепкове. Нафта и ацетон се често користе у индустрији за чишћење уља, мазива, и катрана са делова и машинерије. Телесни флуиди су раствори базирани на води.
Сурфаканти су обично присутни у сапунима и детерџентима. Растварачи попут алкохола се често користе као антимикробни агенси. Они налазе примену у козметици, мастилима, и течним обојеним ласерима. Они се користе у прехрамбеној индустрији, у процесима као што су екстракција биљног уља.[24]
Течности обично имају бољу термалну проводност од гасова, и способност течења их чини подесним за уклањање сувишне топлоте из механичких компоненти. Топлота се може уклонити провођењем течности кроз топлотне размењиваче, као што су радијатори, или до уклањања топлоте може доћи путем испаравања.[25] Водени или гликолни расхлађивачи се користе за спречавање прегревања мотора.[26] Расхлађивачи који се користе у нуклеарним реакторима обухватају воду и течне метале, као што су натријум или бизмут.[27] Течни пропелантни филмови се користе за хлађење потисних комора ракета.[28] У машинству, се користе вода и уље за уклањање сувишне топлоте, која може брзо да оштети обрађивани део и алат. Током перспирације, зној уклања топлоту из људског тела путем испаравања. У индустрији загревања, вентилације, и климатизације (ХВАЦ), течности као што је вода се користе за трансфер топлоте са једне области на другу.[29]
Течност је примарна компонента хидрауличних система, који функционишу на принципу Паскаловог закона и пружају снагу течности. Уређаји као што су пумпе и водени точкови су кориштени за преображај кретања течности у механички рад од древних времена. Уља пролазе кроз хидрауличне пумпе, које трансмитују ту силу до хидрауличких цилиндара. Хидраулички уређаји имају мноштво примена, као што су аутомобилске кочнице и трансмисије, тешка опрема, и контролни системи авиона. Разне хидрауличке пресе се екстензивно користе за поправку и производњу, за подизање и пресовање, стезање и формирање.[30]
Течности се понекад користе у мерним уређајима. Термометри[31] често користе термалну експанзију течности, као што је жива, у комбинацији са њеном способности да тече, за индицирање температуре.[32] Манометар користи тежину течности као индикатор ваздушног притиска.[33]
Механичка својства
[уреди | уреди извор]Запремина
[уреди | уреди извор]Количина течности се обично мери у јединицама запремине. Оне обухватају СИ јединицу кубни метар (m³) и његове делове, а посебно кубни дециметар, који се најчешће назива литром (1 dm³ = 1 L = 0.001 m³), и кубни центиметар, који се назива милилитром (1 cm³ = 1 mL = 0.001 L = 10−6 m³).
Запремина дате количине течности је фиксна на датој температури и притиску. Течности се генерално шире при загревању, и сакупљају при хлађењу. Вода између 0 °C и 4 °C је приметни изузетак.
Течности имају малу компресибилност. Вода се, на пример, може компримовати за само 46,4 дела по милиону за сваку јединицу повећања атмосферског притиска (бар).[34] На око 4000 бара (58.000 psi) притиска, на собној температури, вода испољава само 11% смањења запремина.[35] При изучавању динамике флуида, течности се често третирају као некомпресибилне, а то је посебно случај у студијама некомпресибилног протока. Та некомпресибилна природа чини течности подесним за пренос хидрауличке снаге, пошто се веома мало енергије губи у облику компресије.[35] Међутим, незнатна компресибилност доводи до других феномена. Липање цеви, звано водени удар, се јавља кад се вентил нагло затвори, креирајући огромно повишење притиска на вентилу које путује назад широм система. Још један феноменон узрокован нестишљивошћу течности је кавитација, при чему течност у области ниског притиска испарава и формира мехуре, који затим колапсирају при уласку у области високог притиска. То узрокује попуњавање празнина на којима су постојали мехури течношћу са огромном, локализованом силом, еродирајући било коју суседну чврсту површину.[36]
Притисак и потисак
[уреди | уреди извор]У гравитационом пољу, течности врше притисак на зидове суда као и на предмете у самој течности. Тај притисак се преноси у свим правцима и повећава се са дубином. Ако је течност у миру у униформном гравитационом пољу, притисак, p, на било којој дубини, z, је дат са
где:
- означава густину течности (претпостављеног садржаја)
- је гравитационо убрзање.
Ова формула претпоставља да је притисак на слободној површини једнак нули, и да су ефекти површинског напона занемарљиви.
Објекти уроњени у течности су подложни феномену потиска.[37] (Потисак је приметан у свим флуидима, мада је посебно јак у течностима због њихове велике густине.)
Површине
[уреди | уреди извор]
Осом ако запремина течности прецизно одговара запремини суда, приметна је једна или више површина. Површина течности се понаша као еластична мембрана на којој се јавља површински напон, који омогућава формирање капи и мехура. Површински таласи, капиларних појава, влажење, и капиларни таласи су друге консеквенце површинског напона.
Слободна површина
[уреди | уреди извор]Слободна површина је површина флуида која је подложна нултом нормалном стресу и паралелном смицању, као граница између, нпр., течне воде и ваздуха Земљине атмосфере.
Ниво
[уреди | уреди извор]Ниво течности (нпр. ниво воде) је висина асоцирана са слободном површином течности, посебно кад је то највиши део њене површине. Он се може мерити помоћу сензора нивоа.[38]
Проток
[уреди | уреди извор]Вискозитет мери отпор течности која се деформише путем смицања или екстензионалног стреса.[39]
Кад је течност суперохлађена до температуре остакљавања, вискозитет се драматично повећава. Течност онда постаје вискоеластични медијум, који показује еластичност чврсте материје и флуидност течности, у зависности од временске скале опажања или фреквенције пертурбације.
Пропагација звука
[уреди | уреди извор]Брзина звука у течности је дата са , где K означава модул стишљивости флуида, а ρ густину. Типична вредности за свежу воду је c=1497 m/s на 25 °C.
Термодинамика
[уреди | уреди извор]Фазни прелази
[уреди | уреди извор]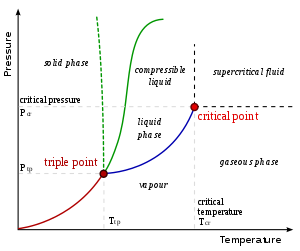
На температури испод тачке кључања, било која материја у течној форми ће испаравати док кондензација гаса изнад ње не достигне равнотежу. У тој тачки гас се кондензује истом брзином којом течност испарава. Стога, течност не може перманентно да постоји, ако се испарена течност константно уклања. Течност на њеној тачки кључања ће испаравати брже него што се гас кондензује на датом притиску. Течност на или изнад њене тачке кључања нормално кључа, мада суперзагрејавање може то да спречи у појединим околностима.
На температури испод тачке смрзавања, течност се кристализује, прелазећи у своје чврсто стање. За разлику од прелаза у гас, не постоји равнотежа у овој транзицији под константним притиском, тако да осим ако дође до суперхлађења, течност ће коначно потпуно кристалисати. До тога једино долази при константном притиску, тако да на пример вода и лед у затвореном, јаком суду могу да достигну равнотежу, где обе фазе постоје. Промена у супротном смеру из чврсте материје у течност се назива топљење.
Течност у свемиру
[уреди | уреди извор]Фазни дијаграм објашњава зашто течности не постоје у свемиру или у неком другом вакууму. Пошто је притисак једнак нули (изузев на површинама или унутрашњости планета или месеца) вода и друге течности изложене свемиру ће одмах прокључати или ће се смрзнути у зависности од температуре. У регионима простора у близини Земље, вода се смрзава ако је Сунце директно не обасјава и испарава (сублимира) чим на њу падну сунчеви зраци. Ако вода постоји као лед на Месецу, она може једино да постоји у засенченим рупама где сунце никад не досеже и где се околне стене сувише не загревају. У појединим тачкама у близини орбите Сатурна, Сунчева светлост је сувише слаба да би сублимирала лед до водене паре. То је евидентно по дуготрајности леда који сачињава Сатурнове прстенове.
Раствори
[уреди | уреди извор]Течности могу да манифестују немешљивост. Једна од познатих немешљивих смеша течности из свакодневног живота је смеша биљног уља и воде у преливу за салату. Познат пар течности које се мешају су вода и алкохол. Течне компоненте смеше често могу да буду одвојене једна од друге путем фракционе дестилације.
Микроскопска својства
[уреди | уреди извор]Статички структурни фактор
[уреди | уреди извор]
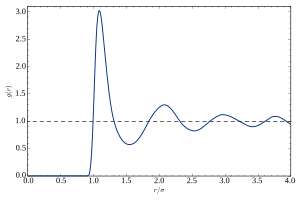
У течности, атоми не формирају кристалну решетку, нити они могу да испоље било коју форму реда на већим растојањима. То је евидентно по одсуству Брагових пикова у рендгенској и неутронској дифракцији. Под нормалним условима, дифракциони патерн има кружну симетрију, изражавајући изотропију течности. У радијалном правцу, дифракциони интензитет глатко осцилује. То се обично описује статичким структурним фактором S(q), са таласним бројем q=(4π/λ)sinθ датим таласном дужином λ сонде (фотона или неутрона) и Браговим углом θ. Осцилације S(q) изражавају блиски ред течности, тј. корелације између атома и неколико љуски најближих, других најближих, ... суседа.
Интуитивнији опис тих корелација је дат путем функције радијалне дистрибуције g(r), која је базично Фуријоева трансформација S(q). Она представља просторни просек темпоралног снимка пара корелација у течности.
Дисперзија звука и структурна релаксација
[уреди | уреди извор]Горњи израз за брзину звука садржи немешљивост K. Ако је K независна од фреквенције онда се течност понаша као линеарни медијум, тако да се звук шири без дисипације и без спрезања модова. У реалности, свака течност показује извесну дисперзију: са повећањем фреквенције, K прелази од ниске фреквенције, лимита сличног течности, до високе фреквенције, лимита сличном чврстом стању . У нормалним течностима, већина тих прелаза се догађа на фреквенцијама између GHz и THz, понекад званих хиперзвук.
На суб-GHz фреквенцијама, нормална течности не може да одржи С таласе: лимит нулте фреквенције модула смицања је . То се понекад сматра дефинишућим својством течности.[40][41] Међутим, попут модула стишљивости K, модуо смицања G је зависан од фреквенције, и на хиперзвучним фреквенцијама он показује сличан прелаз из лимита сличног течности у лимит сличан чврстом стању, не нулту вредност .
У складу са Крамерс-Крониговом релацијом, дисперзија брзине звука (представљена реалним делом K или G) иде уз максимум звучног пригушења (дисипација, представљена имагинарним делом K или G). Према теорији линеарног респонса, Фуријеова трансформација K или G описује начин на који се систем враћа у равнотежу након спољашње пертурбације; из тог разлога, дисперзиони корак у GHz..THz региону се исто тако назива структурном релаксацијом. Према флуктуационо-дисипационој теореми, релаксација према равнотежи је блиско повезана са флуктуацијама u равнотеже. Густина флуктуација везаних за звучне таласе се може експериментално уочити у виду Брилоуиновог расипања.
При суперхлађењу течности у близини стаклене транзиције, прелаз из течности сличног у чврстој материји сличан респонс одговара прелазу из GHz у MHz, kHz, Hz, ...; еквивалентно томе, карактеристично време структурне релаксације се повећава са ns na μs, ms, s, ... То је микроскопско објашњење за горе поменуто вискоеластично понашање течности које формирају стакло.
Ефекти асоцијације
[уреди | уреди извор]Механизми атомске/молекулске дифузије (или померања честица) у чврстој материји су блиско сродни са механизмима вискозног протока и солидификације течних материјала. Описи вискозитета у погледу молекуларног „слободног простора“ у течности[42] су модификовани по потреби да би се узеле у обзир течности за чије молекуле је познато су „асоцирани“ у течном стању на обичним температурама. Кад се различити молекули комбинују у групе асоцираних молекула, они формирају полукруте системе у датим просторним областима које су раније биле доступне као слободни простор за мобилне молекуле. То доводи до повећање вискозитета након хлађења услед тенденције већине супстанци да буду асоциране након хлађења.[43]
Слични аргументи се користе за описивање дејства притиска на вискозитет, при чему се може претпоставити да је вискозитет првенствено функција запремине за течности са коначном компресибилношћу. Очекује се повећање вискозитета са порастом притиска. Ако се запремина повећава топлотом и редукује притиском, вискозитет се не мења.
Локална тенденција да се молекули оријентишу у малим групама даје течности (као што је наведено раније) одређени степен асоцијације. Та асоцијација резултира у знатном „унутрашњем притиску“ течности, који је скоро потпуно узрокован тим молекулима који су услед својих привремено малих брзина (следствено Максвеловој дистрибуцији) груписани са другим молекулима. Унутрашњи притисак између неколико таквих молекула може да одговара притиску између група молекула у чврстој форми.
Референце
[уреди | уреди извор]- ^ Wahab 2005, стр. 1–3
- ^ Cutnell & Johnson 2006
- ^ а б Woodward, Roger P. Ph.D. „Surface Tension Measurements Using the Drop Shape Method” (PDF). First Ten Angstroms. Архивирано из оригинала (PDF) 17. 12. 2008. г. Приступљено 5. 11. 2008.
- ^ а б F.K.Hansen; Rodsrun, G. (1991). „Surface tension by pendant drop. A fast standard instrument using computer image analysis”. Colloid and Interface Science. 141: 1—12. doi:10.1016/0021-9797(91)90296-K.
- ^ Peter Atkins; Julio de Paula (2001). Physical Chemistry (7th изд.). W. H. Freeman. ISBN 0716735393.
- ^ Emsley 2011
- ^ Fine, Rana A.; Millero, F. J. (1973). „Compressibility of water as a function of temperature and pressure”. Journal of Chemical Physics. 59 (10): 5529—5536. Bibcode:1973JChPh..59.5529F. doi:10.1063/1.1679903.
- ^ Hugh D. Young; Roger A. Freedman. (2012). Sears and Zemansky's University Physics: With Modern Physics. Addison-Wesley. стр. 356. ISBN 978-0-321-69686-1.
- ^ Donald A. McQuarrie; John D. Simon (1997). Physical Chemistry: A Molecular Approach (1st изд.). University Science Books. ISBN 0935702997.
- ^ Volland, Dr. Walt. „"Intermolecular" Forces”. Архивирано из оригинала 3. 2. 2010. г. Приступљено 20. 9. 2009.
- ^ Dezellus, O. and N. Eustathopoulos (2010). "Fundamental issues of reactive wetting by liquid metals." Journal of Materials Science 45(16): 4256-4264.
- ^ Han Hu, Hai-Feng Ji, and Ying Sun, Phys. Chem. Chem. Phys., 15, (2013) 16557
- ^ Taylor 2002
- ^ Bird, Stewart & Lightfoot 2007, стр. 912.
- ^ Horst Beer: 100 Jahre Entwicklung und Einsatz der Hydraulik im Osten Deutschlands. Ein Beitrag zur Technik- und Industriegeschichte. GNN-Verlag, Schkeuditz. 2008. ISBN 978-3-89819-240-8.
- ^ H. Exner, R. Freitag, H. Geis, R. Lang. J. Oppolzer: Der Hydraulik Trainer. Band 1: Hydraulik – Grundlagen und Komponenten. . 3. überarbeitete Auflage. Herausgegeben von Bosch Rexroth AG. Mannesmann Rexroth, Lohr. 2002. ISBN 978-3-933698-30-8.
- ^ Goldberg 1988, стр. 321.
- ^ Atmosphere-ocean Interaction By Eric Bradshaw Kraus, Joost A. Businger Published by Oxford University Press US. 1994. ISBN 978-0-19-506618-0. стр. 60.
- ^ Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). CRC Press. ISBN 978-1-4398-5511-9.
- ^ Debenedetti & Stanley 2003, стр. 40–46.
- ^ Sciortino & Stanley 2004, стр. 047801.
- ^ Theodore Gray, The Elements. . A Visual Exploration of Every Known Atom in the Universe New York: Workman Publishing. 2009. pp. 127. ISBN 978-1-57912-814-2.
- ^ Mang; Dresel, Wilfried (2007). Lubricants and Lubrication. John Wiley & Sons. ISBN 978-3-527-61033-4.
- ^ Wypych 2001, стр. 847–881
- ^ N. B. Vargaftik ’’Handbook of thermal conductivity of liquids and gases’’ CRC Press. 1994. ISBN 978-0-8493-9345-7.
- ^ Erjavec 2005, стр. 309
- ^ Gerald Wendt ’’The prospects of nuclear power and technology’’ D. Van Nostrand Company 1957 p. 266
- ^ ’’Modern engineering for design of liquid-propellant rocket engines’’ by Dieter K. Huzel, David H. Huang – American Institute of Aeronautics and Astronautics. 1992. ISBN 978-1-56347-013-4. стр. 99.
- ^ Thomas E Mull ’’HVAC principles and applications manual’’. . McGraw-Hill. 1997. ISBN 978-0-07-044451-5.
- ^ Keith Mobley, R. (20. 12. 1999). Fluid power dynamics. Butterworth-Heinemann. стр. vii. ISBN 978-0-7506-7174-3.
- ^ Middleton, W.E.K. (1966). A history of the thermometer and its use in meteorology. Baltimore: Johns Hopkins Press. Reprinted ed. 2002. ISBN 978-0-8018-7153-5.
- ^ McGee 1988, стр. 3
- ^ Liptak 2018, стр. 807
- ^ Compressibility of Liquids
- ^ а б Intelligent Energy Field Manufacturing: Interdisciplinary Process Innovations By Wenwu Zhang -- CRC Press. 2011. стр. 144.
- ^ Fluid Mechanics and Hydraulic Machines by S. C. Gupta -- Dorling-Kindersley 2006 Page 85
- ^ „Floater clustering in a standing wave: Capillarity effects drive hydrophilic or hydrophobic particles to congregate at specific points on a wave” (PDF). 23. 6. 2005.
- ^ Deeter. „Float Level Sensors”. Приступљено 5. 5. 2009.
- ^ а б White 2003, стр. 4
- ^ Born, Max (1940). „On the stability of crystal lattices”. Mathematical Proceedings. Cambridge Philosophical Society. 36 (2): 160—172. S2CID 104272002. doi:10.1017/S0305004100017138.
- ^ Born, Max (1939). „Thermodynamics of Crystals and Melting”. Journal of Chemical Physics. 7 (8): 591—604. doi:10.1063/1.1750497. Архивирано из оригинала 15. 5. 2016. г.
- ^ Macleod, D. B. (1923). „On a relation between the viscosity of a liquid and its coefficient of expansion”. Trans. Farad. Soc. 19: 6. doi:10.1039/tf9231900006.
- ^ Stewart, G. W. (1930). „The Cybotactic (Molecular Group) Condition in Liquids; the Association of Molecules”. Phys. Rev. 35 (7): 726. Bibcode:1930PhRv...35..726S. doi:10.1103/PhysRev.35.726.
Литература
[уреди | уреди извор]- Erjavec, Jack (2005). Automotive Technology: A Systems Approach. Cengage Learning. стр. 309. ISBN 978-1-4018-4831-6.
- Wypych, George (2001). Handbook of Solvents. ChemTec Publishing. стр. 847—881. ISBN 978-1-895198-24-9.
- Mang; Dresel, Wilfried (2007). Lubricants and Lubrication. John Wiley & Sons. ISBN 978-3-527-61033-4.
- Liptak, Bela G. (2018). Instrument Engineers' Handbook, Volume Two: Process Control and Optimization. CRC Press. стр. 807. ISBN 978-1-4200-6400-1.
- McGee, T. D. (1988). Principles and Methods of Temperature Measurement. стр. 3. ISBN 978-0-471-62767-8.
- White, F. (2003). Fluid Mechanics. McGraw-Hill. стр. 4. ISBN 978-0-07-240217-9.
- Wahab, M. A. (2005). Solid State Physics: Structure and Properties of Materials. Alpha Science. стр. 1—3. ISBN 978-1-84265-218-3.
- Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). CRC Press. ISBN 978-1-4398-5511-9.
- Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (1st изд.). McGraw-Hill. section 17.43, p. 321. ISBN 978-0-07-023684-4.
- Cutnell, John D.; Johnson, Kenneth W. (2006). Essentials of Physics. Wiley Publishing.
- Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New изд.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- Taylor, Philip L. (2002). A Quantum Approach to Condensed Matter Physics. Cambridge University Press. ISBN 978-0-521-77103-0.
- J. P. Hansen, I. R. Mcdonald (2006). Theory of simple Liquids. Elsevier Academic Press. ISBN 978-0-12-370535-8.
- M. P. Allen, D.J. Tildesly (1989). Computer Simulation of Liquids. Oxford University Press. ISBN 978-0-19-855645-9.









