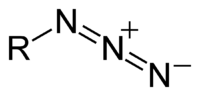Azid
Azid je anjon sa formulom N3−. On je konjugovana baza hidrazonske kiseline. N3− je linearni anjon koji je izoelektronski sa CO2 i N2O. Po teoriji valentne veze, azid se može opisati sa nekoliko rezonantnih struktura, među kojima je važna N−=N+=N−. Azid je isto tako funkcionalna grupa u organskoj hemiji, RN3.[1] Dominantna oblast primene azida su propelanti u vazdušnim jastucima.
Primene
[уреди | уреди извор]Oko 250 tona jedinjenja koja sadrže azide se proizvede godišnje. Glavni proizvod su azidi.[2]
Detonatori i propelanti
[уреди | уреди извор]Natrijum azid je propelant u automobilskim vazdušnim jastucima. On se razlaže pri zagrevanju proizvodeći gas azot, što se koristi za brzu ekspanziju vazdušnih jastuka:[2]
- 2 NaN3 → 2 Na + 3 N2
Soli teških metala, kao što je olovo azid, Pb(N3)2, detonatori su senzitivni na šok, koji se razlažu do olova i azota:[3]
- Pb(N3)2 → Pb + 3 N2
Soli srebra i barijuma se koriste na sličan način. Neki organski azidi su potencijalni raketni propelanti, npr. 2-dimetilaminoetilazid.
Reference
[уреди | уреди извор]- ^ S. Bräse, C. Gil, K. Knepper and V. Zimmermann (2005). „Organic Azides: An Exploding Diversity of a Unique Class of Compounds”. Angewandte Chemie International Edition. 44 (33): 5188—5240. PMID 16100733. doi:10.1002/anie.200400657.
- ^ а б Jobelius, Horst H.; Scharff, Hans-Dieter (2000). „Hydrazoic Acid and Azides”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3-527-30673-0. doi:10.1002/14356007.a13_193.
- ^ Shriver and Atkins. Inorganic Chemistry (Fifth Edition). W. H. Freeman and Company, New York, pp. 382.