Valentnost (hemija)
Valentnost ili valenc(ij)a je broj koji pokazuje sa koliko atoma vodonika se jedini neki hemijski element. Valencu nekog elementa određuje broj elektrona tog elementa koji učestvuju u stvaranju hemijske veze. Valence elemenata mogu imati vrednost od I do VIII, jer je 8 maksimalan broj elektrona u valentnom energetskom nivou. Valenca elemenata je uvek ceo broj. Ona može biti promenljiva i nepromenljiva. Valenca plemenitih gasova je nula.[1][2] Valence elemenata prve i sedme grupe su I, druge i šeste II, treće i pete III, a četvrte IV.
Opis
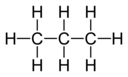
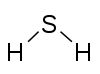
[уреди | уреди извор]Kapacitet kombinovanja, ili afinitet atoma datog elementa određuje se brojem atoma vodonika sa kojima se kombinuje. U metanu, ugljenik ima valencu 4; u amonijaku azot ima valencu 3; u vodi kiseonik ima valencu 2; a u hlorovodoniku hlor ima valencu od 1. Hlor, pošto ima valentnost od jedan, može biti zamenjen vodonikom. Fosfor ima valencu 5 u fosfor pentahloridu, PCl5. Valentni dijagrami jedinjenja predstavljaju povezanost elemenata, s linijama povučenim između dva elementa, koje se ponekad nazivaju i veze, što predstavlja zasićenu valenciju za svaki element.[3] Dve tabele u nastavku prikazuju neke primere različitih jedinjenja, njihove valentne dijagrame i valencije za svaki element jedinjenja.
| Jedinjenje | H2 Vodonik |
CH4 Metan |
C3H8 Propan |
C2H2 Acetilen |
|---|---|---|---|---|
| Dijagram | 
|
|
||
| Valencije |
|
|
|
|
| Jedinjenje | NH3 Amonijak |
NaCN Natrijum cijanid |
H2S Vodonik sulfid |
H2SO4 Sumporna kiselina |
Cl2O7 Dihlor heptoksid |
|---|---|---|---|---|---|
| Dijagram | 
|
|

|

| |
| Valencije |
|
|
|
|
|
Moderne definicije
[уреди | уреди извор]Valencija je definisana po IUPAC-u kao:[4]
- Maksimalan broj jednovalentnih atoma (izvorno atoma vodonika ili hlora) koji mogu da se kombinuju sa atomom elementa koji se razmatra, ili sa fragmentom, ili za koji atom ovog elementa može biti zamenjen.
Alternativni savremeni opis je:[5]
- Broj atoma vodonika koji se mogu kombinovati sa elementom u binarnom hidridu ili dvostruko veći broj atoma kiseonika koji se kombinuju sa elementom u njegovom oksidu ili oksidima.
Ova definicija se razlikuje od IUPAC definicije, jer se za element može reći da ima više od jedne valencije.
Veoma slična moderna definicija data u jednom nedavnom članku definiše valenciju određenog atoma u molekulu kao „broj elektrona koji atom koristi u vezivanju“, sa dve ekvivalentne formule za izračunavanje valencije:[6]
- valencija = broj elektrona u valentnoj ljusci slobodnog atoma - broj nevezujućih elektrona atomu u molekulu,
- i
- valencija = broj veza + formalni naboj.
Istorijski razvoj
[уреди | уреди извор]Etimologija reči valencija (množina valencije) i valenca (množina valence) može se pratiti unazad do 1425, sa značenjem „ekstrakt, priprema”, od latinskog valentia „jačina, kapacitet”, od ranijeg valor „vredi, vrednost”, a hemijsko značanje „moć kombinovanja elemenata” je zabeleženo od 1884, od nemačkog Valenz.[7]

Koncept valencije razvijen je u drugoj polovini 19. veka i pomogao je da se uspešno objasni molekularna struktura neorganskih i organskih jedinjenja.[3] Potraga za osnovnim uzrocima valencije dovela je do savremenih teorija hemijske veze, uključujući kubni atom (1902), Luisove strukture (1916), teoriju valentnih veza (1927), molekularne orbitale (1928), teoriju odbijanja elektronskih parova valentne ljuske (1958), i sve napredne metode kvantne hemije.
Godine 1789, Vilijam Higins objavio je stavove o onome što je nazvao kombinacijama „krajnjih“ čestica, što je nagoveštavalo koncept valentnih veza.[8] Ako bi, na primer, prema Higinsu, sila između krajnje čestice kiseonika i krajnje čestice azota bila 6, tada bi snaga sile bila podeljena u skladu s tim, a takođe i za ostale kombinacije krajnjih čestica (pogledajte ilustraciju).
Tačan početak, međutim, teorije hemijskih valencija može se pratiti do članka Edvarda Franklanda iz 1852. godine u kojem je kombinovao stariju radikalnu teoriju sa razmišljanjima o hemijskom afinitetu da bi pokazao da određeni elementi imaju tendenciju da se kombinuju sa drugim elementima da formiraju jedinjenja koja sadrže 3, i.e. u grupama sa 3 atoma (npr. NO3, NH3, NI3, itd) ili 5, i.e. u grupama sa 5 atoma (npr. NO5, NH4O, PO5, itd), ekvivalenti od priloženih elemenata. Prema njegovim rečima, ovo je način na koji se njihovi afiniteti najbolje zadovoljavaju, i sledeći ove primere i postulate, izjavljuje koliko je očigledno da[9]
| „ | Tendencija ili zakon prevladava (ovde), i da, bez obzira na to kakvi da su karakteri ujedinjenih atoma, kombinaciona moć privlačnog elementa, ako mi se može dozvoliti taj izraz, uvek zadovoljava isti broj ovih atoma. | ” |
Ova „kombinujuća moć“ je kasnije nazvana kvantivalencija ili valencija.[8] Godine 1857, Avgust Kekule je predložio fiksne valencije za mnoge elemente, kao što je 4 za ugljenik, i koristio ih da predloži strukturne formule za mnoge organske molekule, koje su i danas prihvaćene.
Lotar Mejer je u svojoj knjizi iz 1864. godine, Die modernen Theorien der Chemie, predstavio jednu ranu verziju periodnog sistema koji sadrži 28 elemenata, po prvi put klasifikovanih elemenata u šest porodica prema njihovoj valentnosti. Radovi na organizovanju elemenata prema atomskoj težini, do tada su bili ometeni široko rasprostranjenom upotrebom ekvivalentnih težina za elemente, a ne atomskih težina.[10]
Većina hemičara iz 19. veka definisala je valenciju elementa kao broj njegovih veza bez razlikovanja različitih tipova valencije ili veze. Međutim, 1893. Alfred Verner je opisao koordinacione komplekse prelaznih metala kao što je [Co(NH
3)
6]Cl
3, u kome je razlikovao glavnu i pomoćnu valentnost (na nemačkom: 'Hauptvalenz' i 'Nebenvalenz'), što odgovara savremenim konceptima oksidacionog stanja i koordinacionog broja respektivno.
Za elemente glavne grupe, Ričard Abeg je 1904. godine razmatrao pozitivne i negativne valencije (maksimalna i minimalna oksidaciona stanja) i predložio Abegovo pravilo u smislu da je njihova razlika često 8.
Jedna alternativna definicija valencije, razvijena je tokom 1920-ih, i ima moderne zagovornike. Ona se razlikuje u slučajevima kada formalni naboj atoma nije nula. Ona definiše valenciju datog atoma u kovalentnom molekulu kao broj elektrona koje je atom koristio pri vezivanju:[11][12][13][14]
- valencija = broj elektrona u valentnoj ljusci slobodnog atoma − broj nevezujućih elektrona na atomu u molekulu,
ili ekvivalentno:
- valencija = broj veza + formalni naboj.
U ovoj konvenciji, azot u amonijum jonu [NH
4]+
vezuje se za četiri atoma vodonika, ali se smatra da je petovalentan, jer svih pet valentnih elektrona azota učestvuje u vezi.[11]
Elektroni i valencija
[уреди | уреди извор]Raderfordov model nuklearnog atoma (1911) pokazao je da je spoljašnjost atoma zauzeta elektronima, što sugeriše da su elektroni odgovorni za interakciju atoma i formiranje hemijskih veza. Godine 1916, Gilbert N. Luis je objasnio valencu i hemijsku vezu u smislu tendencije atoma (glavne grupe) da postignu stabilan oktet od 8 elektrona valentne ljuske. Prema Luisu, kovalentno vezivanje dovodi do okteta deljenjem elektrona, a jonsko vezivanje dovodi do okteta prenosom elektrona sa jednog atoma na drugi. Termin kovalentnost se pripisuje Irvingu Langmjuru, koji je 1919. godine izjavio da se „broj parova elektrona koji bilo koji dati atom deli sa susednim atomima naziva kovalencom tog atoma“.[15] Prefiks ko- znači „zajedno”, tako da kovalentna veza znači da atomi dele valenciju. Nakon toga, češće se govorilo o kovalentnim vezama, a ne o valentnosti, koja je u radu višeg nivoa izašla iz upotrebe zbog napretka u teoriji hemijskog vezivanja, ali se još uvek široko koristi u elementarnim studijama, gde pruža heuristički uvod u predmet.
Tridesetih godina prošlog veka, Lajnus Poling je predložio da postoje i polarne kovalentne veze, koje su posredne između kovalentne i jonske, i da stepen jonskog karaktera zavisi od razlike elektronegativnosti dva vezana atoma.
Poling je takođe razmatrao hipervalentne molekule, u kojima elementi glavne grupe imaju prividne valence veće od maksimalnih 4 koje dozvoljava pravilo okteta. Na primer, u molekulu sumpor heksafluorida (SF
6), Poling je smatrao da sumpor formira 6 pravih dvoelektronskih veza koristeći sp3d2 hibridne atomske orbitale, koje kombinuju jednu s, tri p i dve d orbitale. Međutim, u skorije vreme, kvantno-mehanički proračuni na ovom i sličnim molekulima su pokazali da je uloga d orbitala u vezivanju minimalna i da se SF
6 molekul treba opisati kao da ima 6 polarnih kovalentnih (delimično jonskih) veza napravljenih od samo četiri orbitale na sumporu (jedna s i tri p) u skladu sa pravilom okteta, zajedno sa šest orbitala na fluorima.[16] Slični proračuni na molekulima prelaznog metala pokazuju da je uloga p orbitala minorna, tako da su jedna s i pet d orbitala na metalu dovoljne da se opiše veza.[17]
Maksimalne valencije elemenata
[уреди | уреди извор]Maksimalne valencije za elemente zasnovane su na podacima sa liste oksidacionih stanja elemenata.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa → | |||||||||||||||||||||
| ↓ Perioda | |||||||||||||||||||||
| 1 | 1 H |
2 He | |||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |||
| 6 | 55 Cs |
56 Ba |
57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |||
| 7 | 87 Fr |
88 Ra |
89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |||
| 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||||||
| 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||||||
| Maksimalne valencije za elemente zasnovane su na podacima sa liste oksidacionih stanja elemenata. | |||||||||||||||||||||
|
0 1 2 3 4 5 6 7 8 9 Nepoznato Boja pozadine pokazuje maksimalnu valentnost hemijskog elementa
1 (crvena) = gasovito 3 (crna) = čvrsto 80 (zelena) = tečno 109 (siva) = nepoznato Boja atomskog broja pokazuje agregatno stanje (na 0 °C i 1 atm)
| |||||||||||||||||||||
Reference
[уреди | уреди извор]- ^ Pure Appl. Chem. 66: 1175 (1994).
- ^ IUPAC. „valence”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ а б Partington, James Riddick (1921). A text-book of inorganic chemistry for university students (1st изд.). OL 7221486M.
- ^ IUPAC Gold Book definition: valence
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Parkin, Gerard (мај 2006). „Valence, Oxidation Number, and Formal Charge: Three Related but Fundamentally Different Concepts”. Journal of Chemical Education. 83 (5): 791. ISSN 0021-9584. doi:10.1021/ed083p791.
- ^ Harper, Douglas. „valence”. Online Etymology Dictionary.
- ^ а б Partington, J.R. (1989). A Short History of Chemistry
 . Dover Publications, Inc. ISBN 0-486-65977-1.
. Dover Publications, Inc. ISBN 0-486-65977-1.
- ^ Frankland, E. (1852). „On a New Series of Organic Bodies Containing Metals”. Philosophical Transactions of the Royal Society of London. 142: 417—444. S2CID 186210604. doi:10.1098/rstl.1852.0020.
- ^ Alan J. Rocke (1984). Chemical Atomism in the Nineteenth Century: From Dalton to Cannizzaro. Ohio State University Press.
- ^ а б Parkin, Gerard (мај 2006). „Valence, Oxidation Number, and Formal Charge: Three Related but Fundamentally Different Concepts”. Journal of Chemical Education. 83 (5): 791. ISSN 0021-9584. doi:10.1021/ed083p791. „While the concepts and definitions of valence have been refined over the years, that described by Sidgwick remains the most useful and simple definition for covalent molecules: the valence of an atom in a covalent molecule is simply the number of electrons that an atom has used in bonding.”
- ^ Sidgwick, N. V. (1927). The electronic theory of valency. London: Oxford University Press (Clarendon Press). стр. 199. „On the whole the best definition of absolute valency seems to be that adopted by Grimm and Sommerfeld, that it is numerically equal to the number of electrons of the atom 'engaged' (beansprucht) in attaching the other atoms.”
- ^ Grimm, H.G.; Sommerfeld, A (1926). „Über den. Zusammenhang des Abschlusses der Elektronengruppen im Atom mit den chemischen Valenzzahlen”. Zeitschrift für Physik. 36 (1): 36—59. Bibcode:1926ZPhy...36...36G. S2CID 120248399. doi:10.1007/bf01383924.
- ^ Smith, Derek W. (2005). „Valence, Covalence, Hypervalence, Oxidation State, and Coordination Number”. Journal of Chemical Education. 82 (8): 1202. ISSN 0021-9584. doi:10.1021/ed082p1202.
- ^ Langmuir, Irving (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002.
- ^ Magnusson, Eric (1990). „Hypercoordinate molecules of second-row elements: d functions or d orbitals?”. J. Am. Chem. Soc. 112 (22): 7940—7951. doi:10.1021/ja00178a014.
- ^ Frenking, Gernot; Shaik, Sason, ур. (мај 2014). „Chapter 7: Chemical bonding in Transition Metal Compounds”. The Chemical Bond: Chemical Bonding Across the Periodic Table. Wiley – VCH. ISBN 978-3-527-33315-8.
