Dužina hemijske veze
Dužina hemijske veze ili distanca veze u molekulskoj geometriji je prosečno (fizičko) rastojanje između jezgara dva vezana atoma u molekulu. Ona je prenosivi svojstvo veze između povezanih atoma, koje je relativno nezavisno od ostatka molekula.
Opis
[уреди | уреди извор]Dužina veze se odnosi na red veze: kada u njenom formiranju sudeluje više elektrona, ona je kraća. Dužina veze je takođe obrnuto proporcionalna snazi veze i energiji disocijacije veza: ako je sve ostalo jednako, a jače veze su kraće. U vezi između dva identična atoma, polovina njene dužine jednaka je kovalentnom radijusu.
Dužine veze se mere u čvrstoj fazi pomoću difrakcije X-zraka, ili u gasovitoj fazi približno se procenjuju pomoću mikrotalasne spektroskopije. Veza između određenog para atoma može se razlikovati između različitih molekula. Na primer, ugljenik u vodoničnoj vezi metana je drugačiji od onog u metil hloridu. Međutim, kada je struktura ista, moguće je napraviti i određena uopštenja.
Dužina veze ugljenika s drugim elementima
[уреди | уреди извор]Sledi tabela sa eksperimentalnim jednostrukim vezama ugljenika i drugih elemenata. Dužine veza su date u pikometrima (pm). Pri aproksimaciji dužine veza između dva različita atoma uzet je zbir pojedinačnih kovalentnih radijusa (navedeni su članci za svaki hemijski element). Kao opšti trend, dužina veze pada preko reda u periodnom sistemu i povećava se ispod grupa u sistemu. Ovaj trend je identičan onom kod atomskog radijusa.
| Vezani elementi | Dužina veze (pm) |
Grupa |
| H | 106 - 112 | Grupa 1 |
| Be | 193 | Grupa 2 |
| Mg | 207 | Grupa 2 |
| B | 156 | Grupa13 |
| Al | 224 | Grupa 13 |
| In | 216 | Grupa 13 |
| C | 120 - 154 | Grupa 14 |
| Si | 186 | Grupa 14 |
| Sn | 214 | Grupa 14 |
| Pb | 229 | Grupa 14 |
| N | 147 - 210 | Grupa 15 |
| P | 187 | Grupa 15 |
| As | 198 | Grupa 15 |
| Sb | 220 | Grupa 15 |
| Bi | 230 | Grupa 15 |
| O | 143 - 215 | Grupa 16 |
| S | 181 - 255 | Grupa 16 |
| Cr | 192 | Grupa 16 |
| Se | 198 - 271 | Grupa 16 |
| Te | 205 | Grupa 16 |
| Mo | 208 | Grupa 16 |
| W | 206 | Grupa 16 |
| F | 134 | Grupa 17 |
| Cl | 176 | Grupa 17 |
| Br | 193 | Grupa 17 |
| I | 213 | Grupa 17 |
Dužine veze organskih jedinjenja
[уреди | уреди извор]Dužina vezu između dva atoma u molekulu ne zavisi samo od atoma, već i faktora kao što su orbitalna hibridizacija i elektronska i sterna priroda supstituenta. U vezi ugljenik–ugljenik (C-C) dužina u dijamantu je 154 pm, što je ujedno i najveća dužina veze koja postoji za obične ugljenikove kovalentne veze.
Postoje i neuobičajeno duge veze. U jedinjenju triciklobutabenzenu, dužina veze 160 pm. Sadašnji rekorder je još jedan ciklobutabenzen, dužine 174 pm, na osnovu kristalografije X-zracima. U ovoj vrsti jedinjenja sa ciklobutanskim prstenom, veličina uglova od 90° na atomu ugljenika, povezana je sa benzenskim prstenom, gde obično imaju uglove od 120°.[2] U ovom tipu jedinjenja ciklobutanski prsten uslovljava uglove od 90° na ugljeničnim atomima vezanim za benzenski prsten gde su uglovi obično 120°.
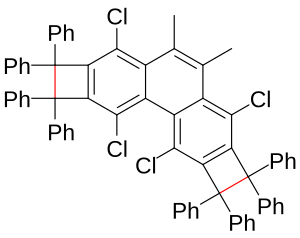
Smatra se da se veće dužine veze C-C veza, do 290 pm, javljaju u dimeru dva tetracijanoetilenska dianjona, što se odnosi i na veze 2-elektron-4-centra.[3][4] Ovaj način vezanja je takođe uočen u dimeru neutralnog fenalena. Dužina takvih veza[5] je do oko 305 pm.
Moguće su i potprosečne dužine C-C veze: alkeni i alkini imaju dužine veza od 133 pm i 120 pm, zbog povećanog s-karaktera sigma veza. U benzenu, sve veze imaju iste dužine: 139 pm. U centralnoj jednostrukoj ugljenik–ugljenik vezi, takođe je značajan porast s-karaktera diacetilena (137 pm), kao i kod određenih tetrahedranskih dimera (144 pm).
U propionitrilu, cijano grupa povlači elektrone, što rezultira smanjenjem dužine veza (144 pm). Najmanja teorijska dužina jednostruke C-C veze za tetraedranske derivate u ovom istraživanju je bila 131 pm. Postoji neobično organsko jedinjenje pod nazivom ln-metilciklofan, sa metil grupom koja je smeštena između tripticena i fenil grupe, a vrlo malom dužinom veza, od 147 pm.[6] U in silico eksperimentima, nađene dužine hemijskih veza su 136 pm, procenjene za neopentan koji je zatvoren u fulerenu[7] U istim istraživanjima, procenjeno je da istezanje ili sabijanje C-C veze u molekulu etana za 5 pm odgovara 2,8 ili 3, 5 kJ/mola, a procena za 15 pm iznosi 21,9 ili 37,7 kJ/mol.
| C–H | Dužina (pm) |
C–C | Dužina (pm) |
Višestruke veze | Dužina (pm) |
| sp3–H | 110 | sp3–sp3 | 154 | Benzen | 140 |
| sp2–H | 109 | sp3–sp2 | 150 | Alken | 134 |
| sp–H | 108 | sp2–sp2 | 147 | Alkin | 120 |
| sp3–sp | 146 | Alen | 130 | ||
| sp2–sp | 143 | ||||
| sp–sp | 137 |
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Handbook of Chemistry & Physics (65th изд.). CRC Press. 1984. ISBN 978-0-8493-0465-1.
- ^ Toda, Fumio (april 2000). „Naphthocyclobutenes and Benzodicyclobutadienes: Synthesis in the Solid State and Anomalies in the Bond Lengths”. European Journal of Organic Chemistry. 2000 (8): 1377—1386. doi:10.1002/(SICI)1099-0690(200004)2000:8<1377::AID-EJOC1377>3.0.CO;2-I. Архивирано из оригинала 29. 06. 2012. г. Приступљено 01. 03. 2018.
- ^ Novoa JJ, Lafuente P, Del Sesto RE, Miller JS (2. 7. 2001). „Exceptionally Long (2.9 Å) C-C Bonds between [TCNE]- Ions: Two-Electron, Four-Center *-* C-C Bonding in -[TCNE]22-”. Angewandte Chemie International Edition. 40 (13): 2540—2545. doi:10.1002/1521-3773(20010702)40:13<2540::AID-ANIE2540>3.0.CO;2-O. Архивирано из оригинала 29. 06. 2012. г. Приступљено 01. 03. 2018.
- ^ Lü JM, Rosokha SV, Kochi JK (2003). „Stable (Long-Bonded) Dimers via the Quantitative Self-Association of Different Cationic, Anionic, and Uncharged -Radicals: Structures, Energetics, and Optical Transitions”. J. Am. Chem. Soc. 125 (40): 12161—12171. doi:10.1021/ja0364928.
- ^ Suzuki S, Morita Y, Fukui K, Sato K, Shiomi D, Takui T, Nakasuji K (2006). „Aromaticity on the Pancake-Bonded Dimer of Neutral Phenalenyl Radical as Studied by MS and NMR Spectroscopies and NICS Analysis”. J. Am. Chem. Soc. 128 (8): 2530—2531. doi:10.1021/ja058387z.
- ^ Huntley DR, Markopoulos G, Donovan PM, Scott LT, Hoffmann R (2005). „Squeezing CC Bonds”. Angewandte Chemie International Edition. 44 (46): 7549—7553. PMID 16259033. doi:10.1002/anie.200502721.
- ^ Martinez-Guajardo G, Donald KJ, Wittmaack BK, Vazquez MA, Merino G (2010). „Shorter Still: Compresing C-C Single Bonds”. Organic Letters, ASAP. 12 (18): 4058. doi:10.1021/ol101671m.
- ^ Fox MA, Whitesell JK (1995). Organische Chemie: Grundlagen, Mechanismen, Bioorganische Anwendungen. Springer. ISBN 978-3-86025-249-9.
- ^ Prof Chao-Jun Li, Ph.D. in lecture, March 2009}}
Literatura
[уреди | уреди извор]- Fox MA, Whitesell JK (1995). Organische Chemie: Grundlagen, Mechanismen, Bioorganische Anwendungen. Springer. ISBN 978-3-86025-249-9.
- Handbook of Chemistry & Physics (65th изд.). CRC Press. 1984. ISBN 978-0-8493-0465-1.
