Keto-enolni tautomerizam
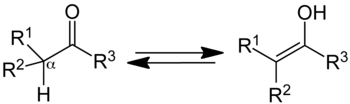
Levo je keto forma; desno je enolna.
U organskoj hemiji, keto-enolni tautomerizam se odnosi na hemijski ekvilibrijum između keto forme (ketona ili aldehida) i enola (alkohola). Enolna i keto forma su tautomeri. Prelaz iz jedne forme u drugu je praćen kretanjem protona i premeštanjem vezujućih elektrona.
Jedinjenje koje sadrži karbonilnu grupu (C=O) je normalno u ravnoteži sa enolnim tautomerom, koji sadrži par dvostruko vezanih atoma ugljenika pored hidroksilne (−OH) grupe, C=C-OH. Keto forma je predominatna u ravnoteži za većinu ketona. Međutim, enolna forma je važna za pojedine reakcije. Deprotonisani intermedijar u interkonverziji dve forme, enolatni anjon, je značajan u karbonilnoj hemiji, zato što je jak nukleofil.
Normalno je keto-enolna tautomerizaciona ravnoteža u znatnoj meri uslovljena termodinamičkim faktorima, i na sobnoj temperaturi ona je pomerena ka keto formi. Klasični primer preferentnog formiranja keto forme se može videti u ravnoteži između vinil alkohola i acetaldehida (K = [enol]/[keto] ≈ 3 x10−7). Međutim, poznato je da u slučaju vinil alkohola, formiranje stabilizovane enolne forme moguće uz kontrolu koncentracije vode u sistemu i upotrebu kinetički povoljnog deuterijuma(kH+/kD+ = 4.75, kH2O/kD2O = 12). Deuterijumska stabilizacija se može ostvariti putem hidrolize ketenskog prekurzora u prisustvu malog stoihiometrijskog viška teške vode (D2O). Studije su pokazale da je proces tautomerizacije znatno inhibiran na sobnoj temperaturi (kt ≈ 10−6 M/s), i da se poluživot enolne forme može lako produžiti do t1/2 = 42 minuta za hidrolize prvog kinetičkog reda.[1]
