Volumetrijske metode analize

Volumetrijska analiza predstavlja jednu od najčešće primenjivanih klasičnih analitičkih postupaka. Zbog svoje jednostavnosti ima široku primenu, najčešće pri kontrolisanju hemijskog procesa, pa se koristi u laboratoriji, fabrici, na terenu i sl. Suština volumetrijske analize sastoji se u tome da poznatoj zapremini ispitivane supstance, čija je koncentracija nepoznata-titrovani rastvor (engl. titrand) dodaje rastvor poznate koncentracije kojim se vrši određivanje-titracioni rastvor (енгл. titrant). Rastvor se dodaje iz birete, do postizanja završne tačke titracije, odnosno, do stehiometrijskog završetka reakcije. Ova operacija se naziva titracija (енгл. titration), pa se ovaj postupak kvantitativnog određivanja naziva i titrimetrijska analiza.[1]
Uslovi volumetrijske analize
[уреди | уреди извор]Da bi neka hemijska reakcija mogla da se koristi za volumetrijsku analizu mora da ispunjava sledeće uslove
- Reakcija mora da bude stehiometrijska, nije dozvoljeno da se odigravaju druge reakcije.
- Reakcija mora da bude brza. Povratne reakcije se ne koriste u volumetrijskim analizama.
- U rastvoru ne smeju da se odigravaju druge reakcije koje na bilo kakav način ometaju reakcije između titranda i titranta.
- Momenat završetka hemijske reakcije (ekvivalentna tačka engl. equivalence point) mora pažljivo da se odredi.
- Reakcija mora da bude kvantitativna.
Tipovi titracija
[уреди | уреди извор]Zavisno od vrste i osobina supstance koje se određuje primenjuje se više tipova titracija.[2]
Direktna titracija – Pri direktnoj titraciji rastvoru supstance koja se određuje dodaje se iz birete standardni rastvor reagensa do postizanja ekvivalentne tačke, odnosno završne tačke titracije. Ovo je najjednostavniji i najčešće primenjivani tip titracije.
Obrnuta titracija – U slučaju obrnute titracije titriše se tačno izmerena zapremina standardnog rastvora, uz pogodan indikator, rastvorom supstance koja se određuje dok se ne postigne ekvivalentna tačka, odnosno završna tačka titracije. Ovaj postupak se najčešće primenjuje u slučaju kada je supstanca koja se određuje nestabilna.
Retitracija – Retitracija ili povratna titracija se sastoji u tome da se rastvor ispitivane supstance doda poznata zapremina osnovnog standardnog rastvora u višku. Višak tog standardnog rastvora, koji nije izreagovao sa ispitivanom supstancom određuje se retitracijom, tj. direktnom titracijom sa drugim pogodnim standardnim rastvorom uz izabrani indikator. Indirektno određivanje. – Indirektno određivanje se primenjuje kada supstanca koja se određuje ne reaguje neposredno sa standardnim rastvorom, ili sa standardnim rastvorom ne gradi dovoljno stabilno jedinjenje, ili kada reakcija sa supstancom u standardnom rastvoru teče stehiometrijski prema jednačini hemijske reakcije.
Posuđe i operacije u volumetrijskoj analizi
[уреди | уреди извор]
U volumetrijskim analizama za tačno odmeravanje zapremine upotrebljavaju se staklene kalibrisane posude: merni balon, pipete i birete, a u toku rada koriste se i čaše, erlenmajeri, sahatno staklo, štapići itd.
Bireta je merni sud u kojem se meri utrošena zapremina standardnog rastvora pri titraciji. Pored toga služi za tačno odmeravanje različitih zapremina titrovanog rastvora pri standardizaciji rastvora. Bireta je duga graduisana cilindrična staklena cev. Na donjem delu ima brušenu (šlifovanu) staklenu slavinu koja se završava kapilarom, ili gumenu cev sa staklenim kapilarom koja je stegnuta metalnom štipaljkom. Za rastvore baza koriste se birete sa gumenom cevi i kapaljkom jer baze nagrizaju staklo i slavina se lako ’’zapeče’’.
Često se u analitičkim laboratorijama koristi tzv. automatska bireta. Bireta je povezana sa bocom u kojoj se nalazi rastvor kojim se puni bireta. Bireta se puni automatski, pomoću gumene pumpice kroz usku cev za punjenje do momenta kada počinje da se puni kruškasti deo pri vrhu birete. Prestankom pumpanja višak rastvora se vraća kroz cev za punjenje nazad u bocu. Bireta se automatski napuni zaustavljanjem nivoa na nuli skale bez podešavanja.Upotrebom automatske birete postiže se ekonomičnost u radu. Štedi se vreme koje bi bilo utrošeno za ponovno punjenje birete, zatim pražnjenje i pranje birete.Kao savremeni aparati za manipulaciju tečnosti koriste se različiti tipovi titratora koji mogu biti manje ili više automatizovani, a titracija se izvodi brzo, precizno i bez gubitaka reagensa.
Metode zasnovane na razmeni jona
[уреди | уреди извор]U zavisnosti od vrste hemijske reakcije postoje više vrsta volumetrijskih metoda:
Metode zasnovane na kiselo-baznim reakcijama
[уреди | уреди извор]- Preusmereno na Kiselo-bazna titracija
Metode kiselo-bazne titracije ili metode neutraliacije (енгл. acid-baze titrations) su zasnovane na uzajamnom dejstvu kiselina i baza, pri čemu se završna tačka određuje primenom indikatora koji menja boju sa promenom pH vrednosti rastvora. Ovim metodama se mogu odrediti kiseline i kisele soli (alkalimetrija) i baze (acidimetrija).[3]

Metode zasnovane na reakcijama taloženja
[уреди | уреди извор]- Preusmereno na Taložne titracije
Metode taloženja ili metode precipitacije se koriste za određivanje anjona halogenih elemenata, pri čemu se kao titrant koristi standardni rastvor srebro-nitrata, pa se metoda taloženja još i naziva argentometrijska metoda.
Metode zasnovane na reakcijama građenja kompleksa
[уреди | уреди извор]Metode kompleksometrije (енгл. complexation titrations) omogućavaju određivanje čitavog niza katjona i anjona. Kao titrant najčešće se upotrebljava dinatrijumova so EDTA, mada primenu nalazi čitav niz jedinjenja koja grade komplekse: etilendiamin,8-hidroksihinolin (oksin) i dr. Volumetrijska metoda kod koje kompleksirajući agens stvara kompleks sa metalnim jonom. U farmaceutskoj analizi se koristi za određivanje jona Al3+, Bi3+, Ca2+, Cu2+, Zn2+. Kompleksirajući agensi su elektrondonori joni ili molekuli koji mogu da nagrade jednu ili više kovalentnih veza sa metalnim jonom. Kompleksi su jedinjenja koja nastaju kombinacijom metalnog jona sa molekulom koji je sposoban da privuče elektrone. Najznačajniji kompleksirajući agens koji stvara rastvorljive komplekse u vodi je etilendiaminotetrasirćetna kiselina (EDTA).
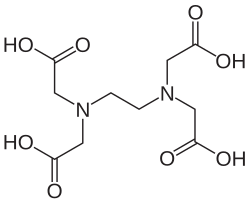
Ovom metodom se vrši i jedna od najvažnijih analitičkih analiza- tvrdoća vode
Metode zasnovane na razmeni elektrona
[уреди | уреди извор]Ove metode su zasnovane na reakcijama oksidacije i redukcije- oksido-redukcione metode ili redoks metode (енгл. oxidation-reducation titrations). Kod ovih metoda kao titrant se koriste rastvori različitih oksidacionih supstanci(KMnO4,I2,K2Cr2O7 i dr.) ili rastvori redukcionih supstanci (Na2S2O3,TiCl3 i dr.). Ove metode se dele na:
- Permanganometriju (oksidaciono sredstvo KMnO4). Primenjuje se za određivanje sadržaja supstanci sa redukcionim sposobnostima kao što su Fe2+,Sb3+,As3+, Sn2+, S2- ,Br – itd. Permanganat ima visok redoks potencijal što omogućava određivanje velikog broja supstanci bez indikatora. Sam rastvor KMnO4 bojenjem titracionog rastvora bledoružičasto pokazuje završnu tačku titracije. Oksidaciono dejstvo KMnO4 menja se u zavisnosti od pH rastvora:
Pri pH ≈ 1: MnO4- + 8H+ + 5e → Mn2+ + 4H2O
Između pH = 5 – 9: MnO4- + 4H+ + 3e → MnO2xH2O + H2O
Pri pH ≈ 14: MnO4- + 1e → MnO42-
Prednost ove titracije je:
- Velik broj razmenjenih elektrona;
- Velik redoks potencijal (E0= +1,52 V);
- Lako uočavanje završne tačke titracije.
KMnO4 nije primarna supstanca.Zato se uvek priprema rastvor približne željene koncentracije, pa se vrši njegova standardizacija primarnim rastvorom tačne koncentracije kao što je na pr.Na2C2O4[4]
- Jodimetriju (oksidaciono sredstvo I2 ili redukciono Na2S2O3). Jodimetrija je jedna od najvažnijih redoks titracija. Jod reaguje direktno i brzo sa mnogo organskih i neorganskih jedinjenja. Oksido-redukciono svojstvo joda može se prikazati sledećom reakciji: 2I- ↔ I2 + 2e
Postoje dve vrste jodimetrije:
- Direktna gde se standardni rastvor joda direktno koristi za titraciju supstanci koje se mogu lako oksidovati.
- Indirektna gde se oksidacionoj supstanci doda jodid-jon u višku koji se retitriše standardnim rastvorom tiosulfata po reakciji: 2S2O32- + I2 → S4O62- + 2I-
Metoda jodimetrije se primenjuje u slabo kiselim uslovima, sa niskom pH. Tosulfat je nestabilan u prisustvu kiselina, a jodid jon se može oksidovati kiseonikom iz vazduha.[5]
- Dihrometriju ili bihrometriju (oksidaciono sredstvo K2Cr2O7)
- Bromatometriju (oksidaciono sredstvo KBrO3)
- Titanometriju (redukciono sredstvo TiCl3 ili Ti2(SO4)3)
- Cerimetriju (oksidaciono sredstvo Ce(SO4)2)i dr.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Prof. dr Miloš B. Rajković:Uvod u Analitičku hemiju, 2007. god. ISBN 978-86-7834-088-8. стр. 181-183.
- ^ Tipovi titracija
- ^ dr Rajković B Miloš, mr Ivana Sredović: Praktikum iz analitičke hemije. 2009. ISBN 978-86-7834-079-6. стр. 114.
- ^ http://www.hpscoka.edu.rs/sites/default/files/x036.ppt Архивирано на сајту Wayback Machine (17. новембар 2015) 21:13,16.11.2015.
- ^ http://www.titrations.info/iodometric-titration 21:28,17.11.2015.god
