Dinitrometan

| |

| |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv
Dinitromethane | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChemSpider | |
| |
| Svojstva | |
| CH2N2O4 | |
| Molarna masa | 106,04 g·mol−1 |
| Tačka ključanja | 39 to 40 °C (102 to 104 °F; 312 to 313 K) (at 2 mmHg) [3] |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Dinitrometan je organsko jedinjenje sa hemijskom formulom CH2(NO2)2, [4] koje sadrži 1 atom ugljenika i ima molekulsku masu od 106,038 Da. Pročišćeni dinitrometan je bezbojna tečnost sa slabim prijatnim mirisom. Relativno je stabilan na sobnoj temperaturi i može se bezbedno čuvati mesecima na 0 °C (32 °F; 273 K). [3]
Istorija
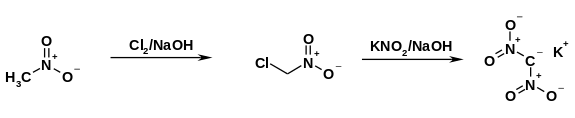
[уреди | уреди извор]Prvi, nesiguran izvor proizvodnje dinitrometana potiče iz 1878. godine, kada je dinitrometan navodno nastao u burnoj reakciji acetona i koncentrisane azotne kiseline. [5][6]Prve sinteze kalijumove soli postigli su A. Vilje 1884. godine [7] i Paul Duden 1893. godine [6] sa niskim prinosima iz bromdinitrometana, koji je dobijen zagrevanjem 2,4,6-tribromoanilina sa koncentrisanom azotnom kiselinom. Dvostepena varijanta sinteze, koju su 1951. godine objavili Feuer i saradnici, [8] polazi od nitrometana koji se prvo hloruje u hloronitrometan. Kroz nukleofilnu supstituciju pomoću kalijum-nitrita u baznom medijumu nastaje kalijumova so. Međutim, prinos ove varijante iznosi samo 23%.
Delovanje koncentrisanih ili umereno razblaženih kiselina na kalijumovu so dovodilo je na sobnoj temperaturi do razlaganja uz intenzivno stvaranje azotastih gasova. Oslobađanje dinitrometana uspeva samo u hladnom okruženju u etarskom rastvoru kroz pažljivo, postepeno dodavanje razblažene sumporne kiseline. [6]
Priprema i dobijanje
[уреди | уреди извор]Jedna sinteza polazi od monometil estera malonske kiseline, koji se oksidativnim nitriranjem uz dekarboksilaciju pretvara u 2,2-dinitrosirćetnu kiselinu metil ester. Drugi korak dekarboksilacije odvija se tokom bazne hidrolize ovog estera pomoću natrijum-hidroksida, pri čemu najpre nastaje natrijumova so dinitrometana. [9]
Novija sinteza počinje nitriranjem barbiturne kiseline pod blagim uslovima. Rezultujuća 5,5-dinitrobarbiturna kiselina može se već hidrolizovati nukleofilnim dejstvom vode, pri čemu se, uz oslobađanje ugljen-dioksida, formira 2,2-dinitroacetilurea. Ovaj spoj se može termički razložiti sa kalijum-hidroksidom, čime nastaje kalijumova so dinitrometana i urea. Ukupan prinos ove varijante sinteze iznosi 80%. [10]
Dinitrometan je takođe nusproizvod sinteze diaminodinitroetilena. Sinteza počinje od 2,6-dihidroksi-4-metilpirimidina, koji se nitriranjem u nitrirajućoj kiselini pretvara u tetranitro međuprodukt. Ovo se zatim hidrolitički razlaže na dinitrometan, diaminodinitroetilen i ugljen-dioksid. [11]
Diaminodinitroetilen poseduje kisela svojstva. U prisustvu baza dolazi do deprotonacije. Reakcijom sa kalijum-hidroksidom na niskim temperaturama može se izolovati kalijumova so kao bela, kristalna čvrsta supstanca. Zagrevanje na 70 °C (158 °F; 343 K) sa kalijum-hidroksidom dovodi do bazne hidrolize, pri čemu se formiraju kalijumova so dinitrometana i urea. [12]
Oslobađanje dinitrometana iz kalijumove soli može se ostvariti pažljivim uvođenjem fluorovodonika u etarski rastvor soli na 0—5 °C (32—41 °F; 273—278 K). [13]
Osobine
[уреди | уреди извор]| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 4 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 2 |
| Particioni koeficijent[14] (ALogP) | 0,4 |
| Rastvorljivost[15] (logS, log(mol/L)) | -1,7 |
| Polarna površina[16] (PSA, Å2) | 91,6 |
Svojstva
[уреди | уреди извор]Dinitrometan je, u zavisnosti od čistoće, bezbojno do žućkasto ulje. [6][13] Spoj je nestabilan i polako se razlaže na sobnoj temperaturi. [6] Na 0 °C (32 °F; 273 K), spoj je stabilan tokom nekoliko meseci. [13] Destilacija je sprovedena u vakuumu pri 2 Torr sa tačkom ključanja na 39—40 °C (102—104 °F; 312—313 K), odnosno pri 4 Torr na 52—53 °C (126—127 °F; 325—326 K). [13] Međutim, zbog sposobnosti eksplozivnog raspada, to se ne preporučuje. Za spoj je procenjena toplota detonacije od 6814 kJ·mol−1. [17][18] Zbog –M-efekta nitro grupa, dinitrometan je C-H kiselina i sa pKₛ vrednošću od 3,57 predstavlja srednje jaku kiselinu. [19] Njegova kiselost je uporediva sa mravljom kiselinom (pKₛ 3,75). Za dinitrometan mogu se formulisati dve tautomerske strukture. Ravnoteža je na strani C-H-kisele strukture. Kvantnohemijski proračuni daju razliku slobodne entalpije od 19,6 kJ·mol−1 u odnosu na N-OH-kiselu strukturu. [20] ¹H-NMR spektar pokazuje samo jedan signal na 3,9 ppm za C-H funkciju. [21] Očekivano, ova vrednost leži između onih za nitrometan sa 5,72 ppm i trinitrometan sa 2,48 ppm. [21] Poređenje kvantnohemijski izračunatih i eksperimentalnih IR i Raman spektra potvrđuje C-H-kiselu strukturu. [22]
U jako kiselom medijumu, ravnoteža se može stabilizovati pomeranjem protolizne ravnoteže u smeru N-OH-kisele strukture. [23] Unošenjem kalijumove soli dinitrometana u koncentrisanu ili dimnu sumpornu kiselinu može se dobiti ciklodimerizacioni proizvod dinitrofuroksan. Formiranje ovog dimera odvija se preko intermedijera protonisane N-OH-kisele strukture dinitrometana i nitroformonitril oksida koji nastaje iz nje eliminacijom vode. [23]
Soli dinitrometana odlikuju se značajno većom stabilnošću u poređenju sa slobodnim jedinjenjem. Tako se kod kalijumove soli eksplozivno razlaganje primećuje tek iznad 200 °C (392 °F; 473 K). [8] Kao produkti razlaganja detektovani su kalijum-karbonat, voda, ugljen-dioksid, azot-monoksid i azot. [6] Soli organskih baza počinju da se razlažu oko 100 °C (212 °F; 373 K). Tako je za piperazinijumovu so zapaženo razlaganje od 90 °C (194 °F; 363 K), za formamidinijumovu so od 125 °C (257 °F; 398 K) i za guanidinijumovu so od 175 °C (347 °F; 448 K). [24]
U hemijskim reakcijama najčešće se polazi od kalijumove ili natrijumove soli dinitrometana. Anjon deluje kao dobar nukleofil. Tako reaguje sa formaldehidom dajući 2,2-dinitropropan-1,3-diol. [8]
Reakcija sa dialkil- ili diaril-sulfoxidima daje odgovarajuće sulfanylidendinitrometane. [25][26]
Sinteza
[уреди | уреди извор]Kalijumova so dinitrometanida, KCH(NO2)2, prvi put je pripremljena od strane Viljea 1884. godine redukcijom bromodinitrometana. [27] Vodonik fluorid i kalijumova so dinitrometana reaguju u dietil-eteru da formiraju dinitrometan. [3] Ranije se smatralo da je slobodni dinitrometan bledo žuto ulje koje se brzo razlaže na sobnim temperaturama. [28]
Dinitrometan ne treba mešati sa metilen-dinitratom (CH2(ONO2)2), koji se proizvodi kao nusproizvod u proizvodnji eksploziva RDX. [29]
Upotreba
[уреди | уреди извор]Uprkos svojim eksplozivnim svojstvima, jedinjenje se ne koristi kao eksploziv zbog teškog rukovanja. Soli dinitrometana mogu se koristiti kao građevni blokovi za sintezu heterocikličnih jedinjenja. Soli sa alkiliranim imidazolima mogu se koristiti kao jonske tečnosti. [30]
Bezbednost
[уреди | уреди извор]Transport dinitrometana je zabranjen od strane Ministarstva saobraćaja SAD-a. [31]
Povezano
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в Legin, G. Ya.; Okhlobystina, L. V.; Fainzilberg, A. A. (1965). „Preparation of pure dinitromethane and its physical properties”. Russian Chemical Bulletin. 14 (12): 2190—2191. doi:10.1007/BF00846018.
- ^ Linstrom, P. J.; Mallard, W. G. (ур.). „Dinitromethane”. NIST Chemistry WebBook, NIST Standard Reference Database Number 69. NIST.
- ^ Chancel: Compt. Rend. 86 (1878) 1405 und Jahresbericht für 1878, 694
- ^ а б в г д ђ Duden, P. (1893). „Ueber das Dinitromethan”. Berichte der Deutschen Chemischen Gesellschaft. 26 (3): 3003—3011. doi:10.1002/cber.189302603135.
- ^ A. Villiers: Bull. Soc. Chim. Fr. 41 (1884) 281 und 43 (1886) 322.
- ^ а б в Feuer, H.; Bachmann, G. B.; Kispersky, J. P. (1951). „A New Preparation of Potassium Dinitromethane and its Conversion to 2,2-Dinitro-1,3-propanediol”. Journal of the American Chemical Society. 73 (3): 1360. doi:10.1021/ja01147a511.
- ^ Grakauskas, V.; Guest, A. M. (1978). „Dinitromethane”. Journal of Organic Chemistry. 43 (18): 3485—3488. doi:10.1021/jo00412a014.
- ^ Langlet, A.; Latypov, N. V.; Wellmar, U.; Goede, P.; Bergman, J. (2000). „Synthesis and reactions of 5,5-dinitrobarbituric acid”. Tetrahedron Letters. 41 (12): 2011—2013. doi:10.1016/S0040-4039(00)00086-1.
- ^ Latypov, N. V.; Johansson, M.; Holmgren, E.; Sizova, E. V.; Sizov, V. V.; Bellamy, A. J. (2007). „On the Synthesis of 1,1-Diamino-2,2-dinitroethene (FOX-7) by Nitration of 4,6-Dihydroxy-2-methylpyrimidine”. Organic Process Research and Development. 11 (1): 56—59. doi:10.1021/op068010t.
- ^ Bellamy, A. J. (2007). „FOX-7 (1,1-Diamino-2,2-dinitroethene)”. Structure and Bonding. 125: 1—33. doi:10.1007/430_2006_054.
- ^ а б в г Legin, G. Ya.; Okhlobystina, L. V.; Fainzilberg, A. A. (1965). „Preparation of pure dinitromethane and its properties”. Russian Chemical Bulletin. 14 (12): 2190—2191. doi:10.1007/BF00846018.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Zeman, S. (1995). „New application of kinetic data of the low-temperature thermolysis of nitroparaffins”. Thermochimica Acta. 261: 195—207. doi:10.1016/0040-6031(95)02325-V.
- ^ Zeman, S. (2002). „Modified Evans-Polanyi-Semenow relationship in the study of chemical micromechanism governing detonation initiation of individual energetic materials”. Thermochimica Acta. 384 (1–2): 137—154. doi:10.1016/S0040-6031(01)00787-0.
- ^ Adolph, H. G.; Kamlet, M. J. (1966). „Fluoronitroaliphatics. I. The Effect of α Fluorine on the Acidities of Substituted Nitromethanes”. Journal of the American Chemical Society. 88 (20): 4761—4763. doi:10.1021/ja00972a065.
- ^ Brand, H.; Liebman, J. F.; Schulz, A. (2008). „Cyano-, Nitro- and Nitrosomethane Derivatives: Structures and Gas-Phase Acidities”. European Journal of Organic Chemistry. 2008 (27): 4665—4675. doi:10.1002/ejoc.200800583.
- ^ а б Hofmann, W.; Stefaniak, L.; Urbanski, T.; Witanowski, M. (1964). „Proton Magnetic Resonance Study of Nitroalkanes”. Journal of the American Chemical Society. 86 (4): 554—558. doi:10.1021/ja01058a005.
- ^ Tafipolsky, M. A.; Tokmakov, I. V.; Shlyapochnikov, V. A. (1999). „Structure and vibrational spectra of dinitromethane and trinitromethane”. Journal of Molecular Structure. 510 (1–3): 149—156. doi:10.1016/S0022-2860(99)00080-0.
- ^ а б Ovchinnikov, I. V.; Makhova, N. N.; Khmelnitskii, L. I. (1995). „Nitroformonitril oxide 2. Generation of nitroformonitrile oxide as an intermediate for the preparation of dinitrofuroxan”. Russian Chemical Bulletin. 44 (4): 702—706. doi:10.1007/BF00698507.
- ^ Jalový, Z.; Ottis, J.; Růžička, A.; Lyčka, A.; Latypov, N. V. (2009). „Organic salts of dinitromethane”. Tetrahedron. 65 (34): 7163—7170. doi:10.1016/j.tet.2009.06.014.
- ^ Shevelev, S.A. et al. in Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science (English Translation), 1976, Vol. 25, p. 1906–1909.
- ^ Shitov,O.P. et al. in Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science (English Translation), 1977, Vol. 26, p. 214–217.
- ^ Villiers, R. (1884). „Sur le bromure d'èthylène tétranitré”. Bulletin de la Société Chimique de France. 41: 281.
- ^ Duden, P. (1893). „Ueber das Dinitromethan”. Berichte der Deutschen Chemischen Gesellschaft. 26 (3): 3003—3011. doi:10.1002/cber.189302603135.
- ^ Luo, K.-M., Lin, S.-H., Chang, J.-G., Huang, T.-H. (2002). „Evaluations of kinetic parameters and critical runaway conditions in the reaction system of hexamine-nitric acid to produce RDX in a non-isothermal batch reactor”. Journal of Loss Prevention in the Process Industries. 15 (2): 119—127. doi:10.1016/S0950-4230(01)00027-4.
- ^ Brand, H.; Liebman, J. L.; Schulz, A.; Mayer, P.; Villinger, A. (2006). „Nonlinear, Resonance-Stabilized Pseudohalogenides: From Alkali Methanides to Ionic Liquids of Methanides”. European Journal of Inorganic Chemistry. 2006 (21): 4294—4308. doi:10.1002/ejic.200600668.
- ^ „DOT Hazardous Materials”. Архивирано из оригинала 2012-04-10. г. Приступљено 2012-03-01.
Literatura
[уреди | уреди извор]- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.