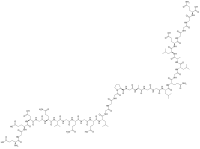
C-пептид
| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| ChemSpider | |
| |
| Својства | |
| C112H179N35O46 | |
| Моларна маса | 2751,827 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
C-пептид је органско једињење, које садржи 112 атома угљеника и има молекулску масу од 2751,827 Da.
Osobine
[уреди | уреди извор]| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 80 |
| Broj donora vodonika | 44 |
| Broj rotacionih veza | 95 |
| Particioni koeficijent[3] (ALogP) | -0,5 |
| Растворљивост[4] (logS, log(mol/L)) | -20,6 |
| Поларна површина[5] (PSA, Å2) | 1391,6 |
Улога у организму
[уреди | уреди извор]C-пептид је молекула сачињена од 31 аминокиселине, а настаје низом специфичних ензимских кидања молекула проинзулина. Проинзулин је битан прекурзор инзулина јер осигурава конформацију потребну за правилно стварање дисулфидних веза у његовом молекулу. Проинзулин се, почевши од аминотерминалног краја састоји редом од: Б-ланца, C-пептида, и А-ланца. А-ланац и Б-ланац су спојени дисулфидним везама, док C-пептид постаје засебни молекул. у Скалду са наведеним, из β-ћелија Лангерхансових острваца гуштераче, ослобађа се у количинама еквимоларнима инзулину.[6]
Годинама се сматрало како C-пептид нема биолошку активност, међутим, иако без изравног утицаја на концентрацију глукозе у крви, нове студије указују на његове бројне улоге у људском организму.
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Мурраy Рк, Бендер ДА, Ботхам КМ, Кеннеллy ПЈ, Родwелл ВW, Wеил ПА. Харпарова илустрирана биокемија. Ловрић Ј, Сертић Ј. 28тх Ед. Загреб, ЦроАтиА. Медицинска наклада; 2011
Литература
[уреди | уреди извор]- Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
Спољашње везе
[уреди | уреди извор]
