Органохлорид
|
| Два приказа органохлорида хлороформа. |
Органохлорид, органохлорно једињење, хлороугљеник, или хлоринисани угљоводоник је органско једињење које садржи бар један ковалентно везани атом хлора, који утиче на хемијска својства молекула. Хлороалканска класа (алкани са једним или више водоника замењених хлором) је добар пример таквих једињења. Широка структурна варијабилност и дивергентност хемијских својстава органохлорида доводи до њиховог широког опсега назива и примена. Органохлориди су веома корисна једињења у многим облицима примене, мада је присуство дела тих једињења узрок озбиљних проблема у животној средини.[1]
Физичка и хемијска својства
[уреди | уреди извор]Хлоринацијом се модификују физичка својства угљеноводоника на неколико начина. Једињења су типично гушћа од воде услед веће атоске тежине хлора у односу на водоник. Алифатични органохлориди су алкилациони агенси, зато што је хлорид добра одлазећа група.
Природна заступљеност
[уреди | уреди извор]Многа органохлорна једињења су изолована из природних извора који су у распону од бактерија до људи.[2][3] Хлоринисана органска једињења су присутна у скоро свакој класи биомолекула укључујући алкалоиде, терпене, аминокиселине, флавоноиде, стероиде, и масне киселинес.[2][4] Органохлориди, укључујући диоксине, се формирају на високим температурама током шумских пожара. Диоксинис су нађени у пепелу пожара изазваних громом који предатирају синтетичке диоксине.[5] Осим тога, мноштво једноставних хлоринисаних угљоводоника укључујући дихлорометан, хлороформ, и угљентетрахлорид су изоловани из морских алги.[6] Највећи део хлорометана у животној средини се формира природно путем биолошке декомпозиције, шумских пожара, и рада вулкана.[7]
Природни органохлорид епибатидин, алкалоид изолован из жаба, има потентно аналгетско дејство и стимулише истраживања нових лекова за третман бола. (Жабе добијају епибатидин путем исхране и затим га секвестрирају на кожу. Могући прехрамбени извори су бубе, мрави, гњиде, и муве.[8])
Припрема
[уреди | уреди извор]Полазећи од хлора
[уреди | уреди извор]Алкани и арилни алкани се могу хлоринисати користећи реакционе услове реакција слободних радикала, као што је УВ светло. Међутим, тешко је контролисати до које мере долази до хлоринације. Арилни хлориди се могу припремити путем Фридел-Крафтсове халогенације, користећи хлор и Луисову киселину као катализатор.[9]
Халоформна реакција, у којој се користе хлор и натријум хидроксид, исто тако може да произведе алкил халиде из метил кетона, и сродних једињења. Хлороформ се некад производио на тај начин.
Хлор се може додати у вишеструке везе алкена и алкина, чиме се формирају ди- или тетра-хлоро једињења.
Реакције са хлороводоником
[уреди | уреди извор]Алкени реагују са хлороводоником (ХЦл), чиме се формирају алкил хлориди. На пример, индустријска производња хлороетана се одвија путем реакције етилена са ХЦл:
- Х2C=ЦХ2 + ХЦл → ЦХ3ЦХ2Цл
У оксихлоринацији се користи хлороводоник уместо скупљег хлора за исту сврху:
- ЦХ2=ЦХ2 + 2 ХЦл + 1⁄2 О2 → ЦлЦХ2ЦХ2Цл + Х2О.
Секундарни и терцијарни алкохоли реагују са хлороводоником и формирају кореспондирајуће хлориде. У лабораторијским условима се користи сродна реакција у којој учествује цинк хлорид у концентрованој хлороводоничној киселини:
Ова смеша, која се назива Лукасовим реагенсом, је некад је коришћена у квалитативној органској анализи за класификацију алкохола.
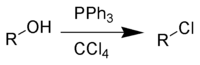
Други агенси за хлоринацију
[уреди | уреди извор]Алкил хлориди се најлакше припремају путем третирања алкохола са тионил хлоридом (СОЦл2) или фосфор пентахлоридом (ПЦл5), мада исто тако са сумпор хлоридом (СО2Цл2) и фосфор трихлоридом (ПЦл3):
- РОХ + СОЦл2 → РЦл + СО2 + ХЦл
- 3 РОХ + ПЦл3 → 3 РЦл + Х3ПО3
- РОХ + ПЦл5 → РЦл + ПОЦл3 + ХЦл
У лабораторијским условима, тионил хлорид је посебно подесан, зато што су његови нуспроизводи гасовити. Алтернативно се може користити Апелова реакција:
Реакције
[уреди | уреди извор]Алкил хлориди су свестрани градивни блокови у органској хемији. Док су алкил бромиди и јодиди реактивнији, алкил хлориди су обично јефтинији и доступнији. Алкил хлориди лако подлежу нападу нуклеофила.
Загревање алкил халида са натријум хидроксидом или водом даје алкохоле. Реакција са алкоксидима или ароксидима даје етре у Вилијамсоновој етарској синтези; реакција са тиолима даје тиоетре. Алкил хлориди лако реагују аминима и дају супституисане амине. Алкил хлориди бивају супституисани тежим халидима као што су јодиди у Финкелстановој реакцији. Реакције са другим псеудохалидима као што су азиди, цијаниди, и тиоцијанати су такође могуће. У присуству јаке базе, алкил хлориди подлежу дехидрохалогенацији чиме се формирају алкени или алкини.
Алкил хлориди реагују са магнезијумом и формирају се Григнардови реагенси, чиме се трансформише електрофилно у нуклеофилно једињење. Вуртзова реакција редуктивно спарује два алкил халида посредством натријума.
- 2Р–X + 2На → Р–Р + 2На+X−
Референце
[уреди | уреди извор]- ^ Метцалф, Роберт L. (2000). „Инсецт Цонтрол”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. ИСБН 978-3-527-30385-4. дои:10.1002/14356007.а14_263.
- ^ а б Гриббле, Гордон W. (1998). „Натураллy Оццурринг Органохалоген Цомпоундс”. Ацц. Цхем. Рес. 31 (3): 141—152. дои:10.1021/ар9701777.
- ^ Гриббле, Гордон W. (1999). „Тхе диверситy оф натураллy оццурринг органобромине цомпоундс”. Цхемицал Социетy Ревиеwс. 28 (5): 335—346. дои:10.1039/а900201д.
- ^ Енгвилд, Кјелд C. (1986). „Цхлорине-Цонтаининг Натурал Цомпоундс ин Хигхер Плантс”. Пхyтоцхемистрy. 25 (4): 7891—791. дои:10.1016/0031-9422(86)80002-4.
- ^ Гриббле, Г. W. (1994). „Тхе Натурал продуцтион оф цхлоринатед цомпоундс”. Енвиронментал Сциенце анд Тецхнологy. 28 (7): 310А—319А. ПМИД 22662801. дои:10.1021/ес00056а712.
- ^ Гриббле, Г. W. (1996). „Натураллy оццурринг органохалоген цомпоундс - А цомпрехенсиве сурвеy”. Прогресс ин тхе Цхемистрy оф Органиц Натурал Продуцтс. 68 (10): 1—423. ПМИД 8795309. дои:10.1021/нп50088а001.
- ^ Публиц Хеалтх Статемент - Цхлорометхане, Центерс фор Дисеасе Цонтрол, Агенцy фор Тоxиц Субстанцес анд Дисеасе Регистрy
- ^ Елизабетх Нортон Ласлеy (децембар 1999). „Хавинг Тхеир Тоxинс анд Еатинг Тхем Тоо Студy оф тхе натурал соурцес оф манy анималс' цхемицал дефенсес ис провидинг неw инсигхтс инто натуре'с медицине цхест”. БиоСциенце. Оxфорд Јоурналс. 45 (12): 945—950. Приступљено 06. 05. 2015.
- ^ M. Россберг ет ал. "Цхлоринатед Хyдроцарбонс" ин Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy 2006, Россберг, Манфред; Лендле, Wилхелм; Пфлеидерер, Герхард; Тöгел, Адолф; Дрехер, Еберхард-Лудwиг; Лангер, Ернст; Рассаертс, Хеинз; Клеинсцхмидт, Петер; Страцк, Хеинз; Цоок, Рицхард; Бецк, Уwе; Липпер, Карл-Аугуст; Торкелсон, Тхеодоре Р.; Лöсер, Ецкхард; Беутел, Клаус К.; Манн, Тревор (2006). „Цхлоринатед Хyдроцарбонс”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. ИСБН 3-527-30673-0. дои:10.1002/14356007.а06_233.пуб2.

![{\displaystyle {\ce {{R-OH}+HCl->[{\ce {ZnCl2}}][\Delta ]\overbrace {R-Cl} ^{alkyl\ halide}+\ {H2O}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/908c64d139abae8fff0d3b7d1f888b3fc9a877ae)