Тиазол
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
1,3-Thiazole
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.475 | ||
| УНИИ | |||
| |||
| Својства | |||
| C3H3NS | |||
| Моларна маса | 85,12 g·mol−1 | ||
| Тачка кључања | 116-118°C | ||
| Базност (пКб) | 2.5 | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Тиазол (1,3-тиазол) је хетероциклично једињење које садржи сумпор и азот. Термин „тиазол“ означава и велику фамилију деривата. Сам тиазол је бледо жута течност са мирисом сличним пиридину и молекулском формулом C3H3NS.[3][4][5] Тиазолни прстен је компонента витамина тиамина (Б1).
Молекулска и електронска структура
[уреди | уреди извор]Тиазоли су азолна хетероциклична једињења заједно са имидазолима и оксазолима. Код оксазола је сумпор замењен кисеоником, док је код имидазола замењен азотом. Тиазол је исто тако функционална група.
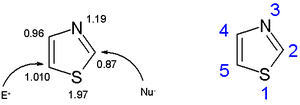
Тиазолни прстен је планаран и ароматичан. Код тиазола су пи-електрони делокализовани у већој мери него код оксазола, те су стога тиазоли ароматичнији. То својство се потврђује хемијским померањем протона прстена у протонској НМР спектроскопији (између 7.27 и 8.77 ppm), што јасно указује на јаку дијамагнетичку струју прстена. Прорачуни пи-електронске густине указују да је C5 примарно место за електрофилну супституцију, а C2 за нуклеофилну супституцију.
Распрострањеност тиазола и тиазолијум соли
[уреди | уреди извор]Тиазоли се налазе у мноштву специјализованих производа, често спојени са дериватима бензена, такозвани бензотиазоли (нпр. луциферин). Осим витамина Б1, тиазолни прстен је присутан у епотилону. Комерцијално значајни тиазоли су углавном боје и фунгициди.
Органска синтеза
[уреди | уреди извор]Постоји више лабораторијских метода за органску синтезу тиазола.
- Хантзчова синтеза тиазола (1889) је реакција између халокетона и тиоамида. На пример, 2,4-диметилтиазол се синтетише из ацетамида, фосфорног пентасулфида, и хлороацетона.[6] Још један пример[7] је приказан испод:
- У једној адаптацији Робинсон-Габриелове синтезе, 2-ациламино-кетони реагују са фосфор-пентасулфидом.
- У Кук-Хеилброновој синтези, α-аминонитрил реагује са угљен-дисулфидом.
- Поједини тиазоли се могу формирати применом Херзове реакције.
Биосинтеза
[уреди | уреди извор]Неколико биосинтетичких путева производи тиазолни прстен, који је неопходан за формирање тиамина.[8] Сумпор тиазола потиче од цистеина. Код анаеробних бактерија, CN група се изводи из дехидроглицина.
Реакције
[уреди | уреди извор]Реактивност тиазола се може приказати на следећи начин:
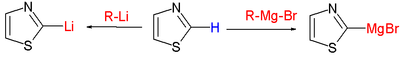
- Депротонација на C2: негативно наелектрисање на овој позицији је стабилизовано у облику илида; Григнардови реагенсис и органолитијумска једињења реагују на том месту, замењујући протон
- 2-(триметилсилиил)тиазол[9] (са триметилсилил групом у 2-позицији) је стабилна замена и реагује са низом електрофила као што су алдехиди, ацил халиди, и кетени
- Електрофилна ароматична супституција у C5 захтева активирајућу групу, као што је метил група у овој броминацији:
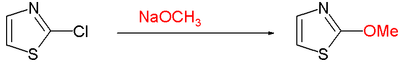
- Нуклеофилна ароматична супституција често захтева одлазећу групу која не задржава електронски пар, попут хлора
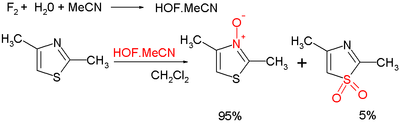
- Органска оксидација на азоту даје тиазолни N-оксид. Многи оксидујући агенси постоје, нпр. mCPBA, хипофлуорна киселина припремљена из флуора и воде у ацетонитрилу. У неким случајевима се оксидација одвија на сумпору, чиме се формира сулфоксид[10]:
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ Theophil Eicher, Siegfried Hauptmann. (15. 8. 2003). The Chemistry of Heterocycles : Structure, Reactions, Syntheses, and Applications. Wiley. ISBN 978-3-527-30720-3.}-
- ^ Schwarz, George (1955). „2,4-Dimethylthiazole”. Org. Synth.; Coll. Vol., 3, стр. 332
- ^ Alajarín, Mateo; Cabrera, José; Pastor, Aurelia; Pilar Sánchez-Andrada; Bautista, Delia (2006). „On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes”. J. Org. Chem. 71 (14): 5328—5339. PMID 16808523. doi:10.1021/jo060664c. Непознати параметар
|name-list-style=игнорисан (помоћ) - ^ Kriek, Marco; Martins, Filipa; Leonardi, Roberta; Fairhurst, Shirley A.; Lowe, David J.; Roach, Peter L. (2007). „Thiazole Synthase from Escherichia coli”. Journal of Biological Chemistry. 282 (24): 17413—17423. PMID 17403671. doi:10.1074/jbc.M700782200
 .
.
- ^ Alessandro Dondoni and Pedro Merino (1998). „Diastereoselective Homologation of D-(R)-Glyceraldehyde Acetonide using 2-(Trimethylsilyl)thiazole”. Org. Synth.; Coll. Vol., 9, стр. 952
- ^ Amir, Elizabeta; Rozen, Shlomo (2006). „Easy access to the family of thiazole N-oxides using HOF·CH3CN”. Chemical Communications. 2006 (21): 2262—2264. PMID 16718323. doi:10.1039/b602594c. Непознати параметар
|name-list-style=игнорисан (помоћ)