Elektron
| Elektron | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Prvih nekoliko elektronskih orbitala atoma vodonika pokazani su preseci gustine verovatnoće | ||||||||||||
| Klasifikacija | ||||||||||||
| ||||||||||||
| Svojstva | ||||||||||||
|
Elektron (takođe poznat kao negatron, obično se označava kao e−) je subatomska čestica negativnog elementarnog naelektrisanja. Elektron je izuzetno mala čestica i misli se da je nedeljiv.[1] Reč elektron potiče od grčke reči ηλεκτρον, što znači ćilibar, zbog toga što je elektricitet otkriven na ćilibaru koji je privlačio lake naelektrisane predmete, kao što su mali delići papira ili dlake kose.[2]
Atom se može predstaviti preko pozitivno naelektrisanog jezgra sastavljenog od protona i neutrona, i negativno naelektrisanih elektrona koji okružuju jezgro.[3][4] Prve teorije atoma su pretpostavljale da se elektroni kao čestice kreću po tačno zadatim putanjama oko jezgra atoma, ali danas je poznato da je atom komplikovaniji sistem i pozicija elektrona se ne može tačno odrediti, već je negativno naelektrisanje raspoređeno u elektronskom oblaku i može se izračunati samo verovatnoća da se elektron kao čestica u određenom trenutku nađe na određenom mestu.[5]
Elektron ne poseduje poznate komponente ili substrukturu; drugim rečima, ne može se rastaviti na sastavne delove, te se smatra da elektron spada u elementarne čestice.[6] Masa mirovanja elektrona je približno 1/1836 mase protona, te time elektroni ukupnoj masi atoma doprinose sa manje od 0,06%.[7] Spin (tzv. unutrašnji moment impulsa) elektrona je ħ/2, tako da elektron spada u klasu fermiona, odnosno u klasu čestica polucelog spina. Kako je elektron fermion, dva elektrona ne mogu da zauzimaju isto kvantno stanje, u skladu sa Paulijevim principom isključenja.[8] Svaka čestica ima svoj par, antičesticu, koja je identična u odnosu na česticu, ali ima električni i druge naboje obrnutog znaka u odnosu na česticu. Antičestica elektrona je pozitron. Kada se elektron sudari sa pozitronom, oni mogu samo da se elastično odbiju, ali mogu i u potpunosti da se anihiliraju, proizvevši gama zračenje u vidu 2 ili više fotona ili, u slučaju vrlo visokih energija elektrona i pozitrona, kao proizvod anihilacije, energija se može osloboditi u vidu neke druge čestice kao što su B mezon ili W i Z bozoni.[9] Elektron, koji kao elementarna čestica učestvuje u gravitacionim, elektromagnetnim i slabim interakcijama, a ne interaguje jakim nuklearnim interakcijama, kao takav spada u porodicu leptona.[10] Kako je najlakši od 3 naelektrisana leptona, on se klasifikuje u prvu generaciju porodice leptona.[8]
Kod subatomskih čestica kao što su elektroni, vidljiva su njihova kvantnomehanička svojstva. Slično kao i foton, i elektron poseduje kvantnu dualnu prirodu i čestica i talasa, tako da mogu da se sudaraju sa drugim česticama, ali i da budu difraktovani poput svetlosti.
Koncept nedeljive količine električnog naboja je 1838. godine razvio britanski prirodni filozof Ričard Laming, kako bi teorijski objasnio hemijska svojstva atoma.[11] Ime elektron je za ovaj naboj 1894. godine uveo irski fizičar Džordž Džonston Stouni. Elektron je kao česticu identifikovao Dž. Dž. Tomson i njegov tim britanskih fizičara 1897. godine.[12][13][14]
Elektroni igraju ključnu ulogu u mnogim fizičkim fenomenima, kao što su elektricitet, magnetizam, i toplotna provodnost. Privlačna Kulonova sila između elektrona i protona uzrokuje da se elektroni vezuju u atome. Razmena ili deljenje elektrona između dva ili više atoma je glavni uzrok nastanka hemijskih veza.[15] Elektron koji se u odnosu na posmatrača nalazi u stanju kretanja, na osnovu Amperovog zakona, generiše magnetno polje. Kada elektron ubrzava, on može da apsorbuje ili zrači energiju u vidu fotona.
Po teoriji, većina elektrona u univerzumu je nastalo tokom Velikog praska, ali elektroni mogu da nastanu i kroz beta raspad radioaktivnih izotopa i u visokoenergetskim sudarima, na primer kada kosmički zraci prolaze kroz atmosferu. Elektroni mogu biti uništeni u postupku anihilacije sa pozitronima i mogu biti apsorbovani tokom zvezdane nukleosinteze. Laboratorijski instrumenti omogućavaju zadržavanje i posmatranje pojedinačnih elektrona, kao i elektronske plazme, dok posebni teleskopi mogu da detektuju elektronsku plazmu u spoljašnjem svemiru. Elektroni imaju brojne primene, uključujući zavarivanje, katodne cevi, elektronske mikroskope, radijacionu terapiju, lasere, i akceleratore čestica.
Elektroni u univerzumu
[uredi | uredi izvor]Veruje se da broj elektrona u poznatom univerzumu iznosi 1078.
Istorija
[uredi | uredi izvor]Atomska teorija
[uredi | uredi izvor]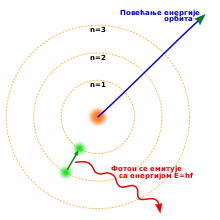
Elektron je otkriven u eksperimentima Tomsona 1897-98. godine i prvobitno nazvan „atom elektriciteta”.[16] Do 1914, eksperimenti fizičara Ernesta Raderforda, Henrija Mozlija, Džejmsa Franka i Gustava Herca su u velikoj meri uspostavili strukturu atoma kao čvrstog jezgra pozitivnog naelektrisanja, koje okružuju elektroni manje mase.[17] Godine 1913, danski fizičar Nils Bor je izneo postulat da se elektroni nalaze u kvantizovanim (tačno određenim diskretnim) energijskim stanjima, a da je energija određena momentom impulsa orbite na kojoj se elektron nalazi kružeći oko atomskog jezgra. Na osnovu ove teorije, elektroni mogu da prelaze iz jednog u drugo stanje, ili drugu elektronsku orbitu, tako što emituju ili apsorbuju fotone odgovarajućih frekvencija. Pomoću ovih kvantizovanih orbita, Bor je tačno objasnio spektralne emisione linije vodonikovog atoma.[18] Međutim, Borov model nije uzeo u obzir relativne intenzitete spektralnih linija i nije uspešno opisao spektre kompleksnijih atoma.[17]
Hemijske veze između atoma je objasnio Gilbert Njutn Luis, koji je 1916. godine izneo ideju da kovalentnu vezu između va atoma održava par elektrona koju ta dva atoma dele.[19] Kasnije, 1923. godine, Valter Hajtler i Fric London su dali puno objašnjenje formiranja hemijskih veza pomoću parova elektrona u kontekstu kvantne mehanike.[20] Godine 1919, američki hemičar Irving Langmjur je razradio Luisov statički model atoma i izneo ideju da su svi elektroni raspoređeni u „koncentričnim (gotovo) sfernim ljuskama, jednakih debljina“.[21] Sferne ljuske su po ovom modelu bile podeljene u više ćelija od kojih je svaka sadržavala po jedan par elektrona. Ovim modelom je Langmjur uspeo da objasni hemijska svojstva svih elemenata u periodnom sistemu elemenata,[20] za koje se znalo da se u velikoj meri periodično ponavljaju.[22]
Godine 1924, austrijski fizičar Volfgang Pauli je uočio da bi ljuskolika struktura atoma mogla da bude objašnjena skupom od četiri parametra koja definišu svako kvantno energetsko stanje, sve dok se u svakom stanju nalazi najviše jedan elektron. (Ovo ograničenje da samo jedan elektron može da se nalazi u jednom kvantno energetskom stanju je postao poznat kao Paulijev princip isključenja.)[23] Fizički mehanizam za objašnjavanje četvrtog parametra, koji je imao dve moguće vrednosti, su dali holandski fizičari Samuel Goudsmit i Džordž Ulenbek. 1925. godine su Goudsmit i Ulenbek izneli ideju da elektron, osim što ima moment impulsa koji zavisi od orbite, poseduje i unutrašnji moment impulsa i magnetni dipolni moment.[17][24] Ovaj intrinsički (unutrašnji) moment impulsa je postao poznat kao spin, i objašnjava ranije misteriozno cepanje spektralnih linija uočeno na spektrografu visoke rezolucije; ovaj fenomen je poznat kao cepanje fine strukture.[25]
Karakteristike
[uredi | uredi izvor]Klasifikacija
[uredi | uredi izvor]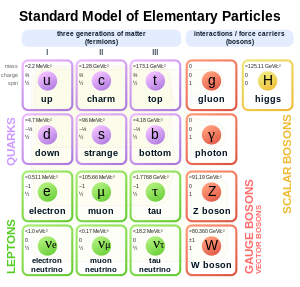
Po Standardnom modelu fizike čestica, elektroni pripadaju grupi subatomskih čestica koje se nazivaju leptonima, za koje se veruje da su fundamentalne ili elementarne čestice. Elektroni imaju najmanju masu od bilo kojih naelektrisanih leptona (ili naelektrisanih čestica bilo kog tipa), i na osnovu toga su svrstani u prvu generaciju fundamentalnih čestica.[26] Druga i treća generacija sadrže naelektrisane leptone, redom, muon i tau, koji su identični elektronu po naelektrisanju, spinu i interakcijama, ali imaju veću masu. Leptoni se razlikuju od ostalih osnovnih gradivnih elemenata materije, kvarkova, po tome što ne učestvuju u jakoj interakciji. Svi članovi grupe leptona su fermioni, jer svi imaju polu-ceo spin; elektron ima spin ½.[27]
Fundamentalna svojstva
[uredi | uredi izvor]Masa mirovanja elektrona je približno 9,109×10−31 kg,[28] ili 5,489×10−4 jedinica atomske mase. Na osnovu Ajnštajnovog principa ekvivalencije mase i energije, ova masa odgovara energiji mirovanja od 0,511 MeV. Odnos između mase protona i mase elektrona je oko 1836.[7][29] Astronomska merenja su pokazala da odnos mase protona i elektrona ima istu vrednost tokom najmanje jedne polovine starosti univerzuma, kao što je i predviđeno Standardnim modelom.[30]
Elektroni imaju električni naboj od −1,602×10−19 kulona,[28] što se koristi kao standardna jedinica naelektrisanja za subatomske čestice. U okviru granica eksperimentalne preciznosti, naelektrisanje elektrona je identično naelektrisanju protona, ali ima suprotan znak.[31] Kako se simbol e koristi za elementarno naelektrisanje, elektron se obično označava sa e−, gde minus označava negativno naelektrisanje. Pozitron se označava sa e+ jer ima ista svojstva kao i elektron, ali sa pozitivnim naelektrisanjem.[27][28]
Elektron ima spin ili tzv. unutrašnji moment impulsa jednak ½.[28] Rezultat merenja projekcije spina duž bilo koje ose može biti samo ± ħ⁄2. Osim spina, elektron ima unutrašnji magnetni moment duž svoje ose spina.[28] On je približno jednak jednom Borovom magnetonu,[32] [a] što je fizička konstanta jednaka 9,27400915(23)×10−24 džula po tesli.[28] Orijentacija spina u odnosu na moment elektrona definiše svojstvo elementarnih čestica poznato kao heličnost.[33]
Napomene
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Logos 2017, str. 246-247.Prema jednom merenju iz 1990.godine prečnik elektrona mora biti manji od 0,000.000.000.000.000.001, ili 1 × 10-18 inča, to jest elektron skoro da nema merljiv prečnik..
- ^ „History of the Electron”. www-spof.gsfc.nasa.gov. Arhivirano iz originala 08. 10. 2019. g. Pristupljeno 2019-10-08.
- ^ Peter Atkins; Julio de Paula (2001). Physical Chemistry (7th izd.). W. H. Freeman. ISBN 0716735393.
- ^ Donald A. McQuarrie; John D. Simon (1997). Physical Chemistry: A Molecular Approach (1st izd.). University Science Books. ISBN 0935702997.
- ^ „Electron Cloud”. science.jrank.org (na jeziku: engleski). Pristupljeno 2019-10-08.
- ^ Eichten, E.J.; Peskin, M.E.; Peskin, M. (1983). „New Tests for Quark and Lepton Substructure”. Physical Review Letters. 50 (11): 811—814. Bibcode:1983PhRvL..50..811E. doi:10.1103/PhysRevLett.50.811.
- ^ a b „CODATA value: proton-electron mass ratio”. 2006 CODATA recommended values. National Institute of Standards and Technology. Pristupljeno 18. 07. 2009.
- ^ a b Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. str. 74. ISBN 978-0-521-53635-6.
- ^ „Feynman Diagrams and Electron-Positron Annihilation”. physics.weber.edu. Pristupljeno 2019-10-08.
- ^ Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. str. 236—237. ISBN 978-0-691-13512-0.
- ^ Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. str. 70—74. ISBN 978-0-226-02421-9.
- ^ Thomson, J.J. (1897). „Cathode Rays”. Philosophical Magazine. 44: 293.
- ^ Dahl 1997
- ^ Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. str. 138. ISBN 978-0-7484-0748-4.
- ^ Pauling, L.C. (1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry (3rd izd.). Cornell University Press. str. 4—10. ISBN 978-0-8014-0333-0.
- ^ Logos 2017, str. 246-247.
- ^ a b v Smirnov, B.M. (2003). Physics of Atoms and Ions. Springer. str. 14—21. ISBN 978-0-387-95550-6.
- ^ Bohr, N. (1922). „Nobel Lecture: The Structure of the Atom” (PDF). The Nobel Foundation. Pristupljeno 03. 12. 2008.
- ^ Lewis, G.N. (1916). „The Atom and the Molecule”. Journal of the American Chemical Society. 38 (4): 762—786. doi:10.1021/ja02261a002.
- ^ a b Arabatzis, T.; Gavroglu, K. (1997). „The chemists' electron”. European Journal of Physics. 18 (3): 150—163. Bibcode:1997EJPh...18..150A. doi:10.1088/0143-0807/18/3/005.
- ^ Langmuir, I. (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002.
- ^ Scerri, E.R. (2007). The Periodic Table. Oxford University Press. str. 205—226. ISBN 978-0-19-530573-9.
- ^ Massimi, M. (2005). Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. Cambridge University Press. str. 7—8. ISBN 978-0-521-83911-2.
- ^ Uhlenbeck, G.E.; Goudsmith, S. (1925). „Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons”. Die Naturwissenschaften. 13 (47): 953—. Bibcode:1925NW.....13..953E. doi:10.1007/BF01558878.
- ^ Pauli, W. (1923). „Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes”. Zeitschrift für Physik. 16 (1): 155—164. Bibcode:1923ZPhy...16..155P. doi:10.1007/BF01327386.
- ^ Frampton, P.H.; Hung, P.Q.; Sher, Marc (2000). „Quarks and Leptons Beyond the Third Generation”. Physics Reports. 330 (5–6): 263—348. Bibcode:2000PhR...330..263F. arXiv:hep-ph/9903387
 . doi:10.1016/S0370-1573(99)00095-2.
. doi:10.1016/S0370-1573(99)00095-2.
- ^ a b Raith, W.; Mulvey, T. (2001). Constituents of Matter: Atoms, Molecules, Nuclei and Particles. CRC Press. str. 777—781. ISBN 978-0-8493-1202-1.
- ^ a b v g d đ Originalni izvor za CODATA je Mohr, P.J.; Taylor, B.N.; Newell, D.B. (2006). „CODATA recommended values of the fundamental physical constants”. Reviews of Modern Physics. 80 (2): 633—730. Bibcode:2008RvMP...80..633M. doi:10.1103/RevModPhys.80.633.
- individualne fizičke konstante iz CODATA su dostupne na: „The NIST Reference on Constants, Units and Uncertainty”. National Institute of Standards and Technology. Pristupljeno 15. 01. 2009.
- ^ Zombeck, M.V. (2007). Handbook of Space Astronomy and Astrophysics (3rd izd.). Cambridge University Press. str. 14. ISBN 978-0-521-78242-5.
- ^ Murphy, M.T.; et al. (2008). „Strong Limit on a Variable Proton-to-Electron Mass Ratio from Molecules in the Distant Universe”. Science. 320 (5883): 1611—1613. Bibcode:2008Sci...320.1611M. PMID 18566280. doi:10.1126/science.1156352.
- ^ Zorn, J.C.; Chamberlain, G.E.; Hughes, V.W. (1963). „Experimental Limits for the Electron-Proton Charge Difference and for the Charge of the Neutron”. Physical Review. 129 (6): 2566—2576. Bibcode:1963PhRv..129.2566Z. doi:10.1103/PhysRev.129.2566.
- ^ Odom, B.; et al. (2006). „New Measurement of the Electron Magnetic Moment Using a One-Electron Quantum Cyclotron”. Physical Review Letters. 97 (3): 030801. Bibcode:2006PhRvL..97c0801O. PMID 16907490. doi:10.1103/PhysRevLett.97.030801.
- ^ Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. str. 261—262. ISBN 978-0-691-13512-0.
Literatura
[uredi | uredi izvor]- Dahl, Per F. (1997). Flash of the Cathode Rays: A History of J J Thomson's Electron. CRC Press. ISBN 978-0-7503-0453-5.
- Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. str. 261—262. ISBN 978-0-691-13512-0.
- Gupta, M.C. (2001). Atomic and Molecular Spectroscopy. New Age Publishers. str. 81. ISBN 978-81-224-1300-7.
- Zombeck, M.V. (2007). Handbook of Space Astronomy and Astrophysics (3rd izd.). Cambridge University Press. str. 14. ISBN 978-0-521-78242-5.
- Raith, W.; Mulvey, T. (2001). Constituents of Matter: Atoms, Molecules, Nuclei and Particles. CRC Press. str. 777—781. ISBN 978-0-8493-1202-1.
- Massimi, M. (2005). Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. Cambridge University Press. str. 7—8. ISBN 978-0-521-83911-2.
- Scerri, E.R. (2007). The Periodic Table. Oxford University Press. str. 205—226. ISBN 978-0-19-530573-9.
- Smirnov, B.M. (2003). Physics of Atoms and Ions. Springer. str. 14—21. ISBN 978-0-387-95550-6.
- Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. str. 138. ISBN 978-0-7484-0748-4.
- Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. str. 70—74. ISBN 978-0-226-02421-9.
- Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. str. 236—237. ISBN 978-0-691-13512-0.
- Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. str. 74. ISBN 978-0-521-53635-6.
- Pauling, L.C. (1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry (3rd izd.). Cornell University Press. str. 4—10. ISBN 978-0-8014-0333-0.
- Logos, Aleksandar A. (2017). Putovanje misli : uvod u potragu za istinom. Beograd.

