Izotop
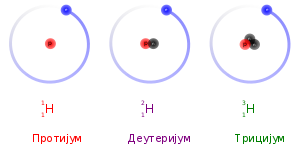
Izotopi su atomi hemijskog elementa čije jezgro ima isti atomski broj, Z, ali različitu atomsku masu, A. Reč izotop, znači na istom mestu, i dolazi od činjenice da se izotopi nalaze na istom mestu u periodnom sistemu elemenata. Izotopni odnos je stalni odnos izotopa u hemijskim elementima u prirodi, i karakteristična veličina za svaku atomsku vrstu.[1]
Atomski broj odgovara broju protona u atomu, Stoga izotopi datog elementa sadrže jednak broj protona. Razlika u atomskim masama potiče iz razlike u broju neutrona u atomskom jezgru. U naučnoj nomenklaturi, izotopi se označavaju imenima datog elementa iza kog sledi crtica, pa broj nukleona (protona i neutrona) u atomskom jezgru (npr., helijum-3, ugljenik-12, ugljenik-14, gvožđe-57, uranijum-238). U simboličkoj formi, broj nukleona se iskazuje iznad hemijskog simbola sa leve strane (npr., 3He, 12C, 14C, 57Fe, 238U).[2]
Izotopi svih elementa obrazuju skup nuklida. Nuklid je definicija za određeno atomsko jezgro i definiše se rednim brojem Z i masenim brojem A: AZHh (32He, 23892U) Strogo govoreći, pre bi trebalo reći da se element kao na primer fluor sastoji od jednog nuklida nego od jednog izotopa.[3]
U neutralnom atomu, broj elektrona je jednak broju protona. Stoga, izotopi datog elementa takođe imaju i isti broj elektrona i istu elektronsku strukturu. Kako je hemijsko ponašanje atoma u najvećoj meri određeno njegovom elektronskom strukturom, izotopi imaju skoro identične hemijske osobine. Glavni izuzetak je, da, usled većih masa, teži izotopi imaju tendenciju da reaguju nešto sporije od lakših izotopa. Ovaj „efekat mase“, ili izotopski efekat je najizraženiji za protijum (1H) i deuterijum (uobičajen naziv za 2H), jer deuterijum ima duplo veću masu od protijuma. Kod težih elemenata je relativna razlika u masi mnogo manja, pa je efekat mase obično zanemarljiv.
Mada, izotopi imaju skoro identične elektronske i hemijske osobine, njihove nuklearne osobine se dramatično razlikuju. Atomsko jezgro se sastoji iz protona i neutrona koje na okupu drži jaka nuklearna sila. Kako su protoni pozitivno naelektrisani, oni se međusobno odbijaju. Neutroni koji su elektroneutralni prave određenu distancu između protona, redukuju elektrostatičko odbijanje i stabilizuju jezgro. Iz ovog razloga su potrebni neutroni da bi se dva ili više protona vezali u jezgro. Kako broj protona raste, potrebni su dodatni neutroni da bi se formiralo stabilno jezgro, na primer, iako je odnos neutron/proton kod 3He 1/2, neutron/proton odnos kod 238U je >3/2. Ipak, ako je prisutno previše neutrona, jezgro postaje nestabilno.
Kako izotopi datog elementa imaju različit broj neutrona, oni imaju i različit odnos neutron/proton. Ovo utiče na njihovu nuklearnu stabilnost, što rezultuje činjenicom da neki izotopi podležu nuklearnom raspadu. Raspad ovih radioaktivnih izotopa (kraće radioizotopa) je važna tema u nuklearnoj fizici. Proučavanjem načina na koji se ovaj raspad odigrava, fizičari stiču uvid u svojstva atomskog jezgra.
Obično se u prirodi može naći nekoliko izotopa istog elementa. Najčešće se javljaju stabilni izotopi, mada se mogu naći i značajne količine nestabilnih izotopa sa velikim vremenom poluraspada kao na primer uranijum-238. Male količine radioaktivnih izotopa sa malim vremenom poluraspada su takođe prisutne u prirodi. Ovi izotopi nastaju kao proizvod raspada većih radioaktivnih jezgara sa dužim životom. Atomska masa elementa u periodnom sistemu elemenata je prosek prirodne rasprostranjenosti izotopa tog elementa.
Prirodna rasprostranjenost raznih izotopa na Zemlji je u krajnjoj liniji rezultat količina izotopa formiranih u zvezdama i supernovama, kao i šema raspada radioaktivnih jezgara formiranih u ovim procesima. Zatim, formiranje Sunčevog sistema je takođe značajno uticalo na proporcije različitih izotopa koji se mogu naći na Zemlji, jer su solarni vetrovi odmah po stvaranju Sunca lakše mogli da oduvaju lakša jezgra ka daljim delovima sunčevog sistema. Zbog ovoga se velike gasovite planete nalaze dalje od Sunca.
Izotop naspram nuklida
[uredi | uredi izvor]Nuklid je vrsta atoma sa specifičnim brojem protona i neutrona u jezgru, na primer ugljenik-13 sa 6 protona i 7 neutrona. Koncept nuklida (koji se odnosi na pojedinačne nuklearne vrste) naglašava nuklearna svojstva u odnosu na hemijska, dok koncept izotopa (grupisanje svih atoma svakog elementa) naglašava hemijska nad nuklearnim. Neutronski broj u velikoj meri utiče na nuklearna svojstva, ali je njegov uticaj na hemijska svojstva zanemarljiv za većinu elemenata. Čak i za najlakše elemente, čiji odnos broja neutrona i atomskog broja najviše varira između izotopa, obično ima samo mali efekat iako je u nekim okolnostima bitan (za vodonik, najlakši element, efekat izotopa je dovoljno velik da snažno utiče na biologiju). Termin izotopi (prvobitno takođe izotopski elementi,[4] sada ponekad izotopski nuklidi[5]) treba da implicira poređenje (poput sinonima ili izomera). Na primer, nuklidi 126C, 136C, 146C su izotopi (nuklidi sa istim atomskim brojem, ali različitim masenim brojem[6]), ali 4018Ar, 4019K, 4020Ca su izobare (nuklidi sa istim masenim brojem[6]). Međutim, izotop je stariji termin i zato je poznatiji od nuklida i još uvek se ponekad koristi u kontekstima u kojima bi nuklid mogao biti prikladniji, kao što su nuklearna tehnologija i nuklearna medicina.
Notacija
[uredi | uredi izvor]Izotop i/ili nuklid su specificirani imenom određenog elementa (ovo označava atomski broj), praćenim crticom i masenim brojem (npr. helijum-3, helijum-4, ugljenik-12, ugljenik-14, uranijum- 235 i uranijum-239).[7] Kada se koristi hemijski simbol, npr. „C” za ugljenik, standardna notacija (sada poznata kao „ AZEnotacija” jer je A maseni broj, Z atomski broj, a E za element) označava maseni broj (broj nukleona) sa superskriptom na vrhu levo od hemijskog simbola i za označavanje atomskog broja sa subskriptom u donjem levom uglu (npr. 32He, 42He, 126C, 146C, 23592U, i 23992U).[8] Pošto je atomski broj dat simbolom elementa, uobičajeno je navesti samo maseni broj u superskriptu, a izostaviti subskript atomskog broja (npr. 3He, 4He, 12C, 14C, 235U, i 239U). Slovo m (za metastabilno) se ponekad dodaje iza masenog broja da bi se označio nuklearni izomer, metastabilno ili energetski pobuđeno nuklearno stanje (za razliku od osnovnog stanja najniže energije), na primer 180m73Ta (tantal-180m).
Uobičajeni izgovor AZE notacije se razlikuje od načina na koji je napisano: 42He se obično izgovara kao helijum-četiri umesto četiri-dva-helijum, a 23592U kao uranijum dva-trideset-pet (američki engleski) ili uranijum-dva-tri-pet (britanski) umesto 235-92-uranij.
Radioaktivni, primordijalni i stabilni izotopi
[uredi | uredi izvor]Neki izotopi/nuklidi su radioaktivni i stoga se nazivaju radioizotopi ili radionuklidi, dok za druge nikada nije primećeno da se radioaktivno raspadaju i nazivaju se stabilnim izotopima ili stabilnim nuklidima. Na primer, 14C je radioaktivni oblik ugljenika, dok su 12C i 13C stabilni izotopi. Na Zemlji postoji oko 339 prirodnih nuklida, od kojih su 286 primordijalni nuklidi, što znači da postoje od formiranja Sunčevog sistema.[9][10][11][12]
Primordijalni nuklidi obuhvataju 35 nuklida sa veoma dugim poluživotom (preko 100 miliona godina) i 251 koji se formalno smatraju „stabilnim nuklidima“,[13] jer nije primećeno da se raspadaju. U većini slučajeva, iz očiglednih razloga, ako element ima stabilne izotope, ti izotopi preovlađuju u obilju elemenata koji se nalazi na Zemlji i u Sunčevom sistemu. Međutim, u slučajevima tri elementa (telur, indijum i renijum) najzastupljeniji izotop koji se nalazi u prirodi je zapravo jedan (ili dva) izuzetno dugovečna radioizotopa elementa, uprkos tome što ovi elementi imaju jedan ili više stabilnih izotopa.
Teorija predviđa da su mnogi naizgled „stabilni“ nuklidi radioaktivni, sa izuzetno dugim poluraspadom (nemajući mogućnost protonskog raspada,[14][15][16][17][18] što bi sve nuklide na kraju učinilo nestabilnim). Neki stabilni nuklidi su u teoriji energetski podložni drugim poznatim oblicima raspadanja, kao što su alfa raspad ili dvostruki beta raspad, ali još uvek nisu primećeni proizvodi raspada, te se kaže da su ovi izotopi „opservaciono stabilni“. Predviđeni periodi poluraspada za ove nuklide često znatno premašuju procenjenu starost univerzuma, i zapravo postoji i 31 poznati radionuklid (vidi primordijalni nuklid) sa periodom poluraspada dužim od starosti univerzuma.
Ako se dodaju radioaktivni nuklidi koji su veštački stvoreni, trenutno je poznato 3.339 nuklida.[19] Ovo uključuje 905 nuklida koji su ili stabilni ili imaju poluživot duži od 60 minuta. Za detalje pogledajte listu nuklida.[20][21][22][23][24][25][26]
Stabilni izotopi
[uredi | uredi izvor]Većina hemijskih elemenata u prirodi smese su prirodnih izotopa, koji su bilo stabilni bilo radioaktivni (nestabilni). Stabilne izotope ima 81 hemijski element. To su redom svi elementi, od vodonika (Z = 1) do uključivo bizmuta (Z = 83), uz izuzetak tehnecijuma (Z = 43) i prometijuma (Z = 61). Mnogi elementi imaju više stabilnih izotopa, a to je razlog što njihove relativne atomske mase nisu celi brojevi. Vodonik je, na primer, smeša stabilnih izotopa 1H i 2H, ugljenik sadrži stabilne izotope 12C i 13C, kiseonik izotope 16O, 17O i 18O i tako dalje. Najviše stabilnih izotopa, njih 10, ima kalaj. Ukupno se u prirodi nalazi oko 270 vrsta stabilnih i oko 70 vrsta radioaktivnih nuklida.
Radioaktivni izotopi, radioizotopi (radionuklidi) pojedinih elemenata, poreklom su prirodni ili veštački. Prirodne radioizotope imaju mnogi elementi koji sadrže i stabilne izotope, a takođe i svi prirodni radioaktivni elementi, to jest oni koji ne sadrže stabilne izotope. To su elementi od polonijuma do uključivo plutonijuma (Z = 84 do 94) te element prometijum. Nuklearnim reakcijama mogu se proizvesti veštački radioizotopi gotovo svih elemenata, pa je danas poznato oko 2 500 vrsta nuklida, što prirodnih, što veštačkih. Svi se oni mogu svrstati u kartu nuklida, u kojoj je svaki nuklid prikazan kvadratom s različitim, za njega karakterističnim podacima (izotopna obilnost, vreme poluraspada, vrsta i energija zračenja i tako dalje). Izotopi pojedinih elemenata svrstani su u vodoravnim redovima prema rastućoj masi.
Nestabilni izotopi
[uredi | uredi izvor]Nestabilni izotopi, odnosno radioaktivni izotopi ili radionuklidi su atomi koji imamu odnos protona i neutrona veći ili manji od odnosa potrebnog za stabilnost. Nestabilni izotopi teže stabilnosti, a to se postiže radioaktivnim raspadom (radioaktivnost). Posledice radioaktivnog raspada je menjanje mase i/ili hemijskih svojstava radionuklida uz istodobno emitiranje jonizujućeg zračenja. Svi elementi iznad rednog broja 82 (olovo) su nestabilni jer odbojnim silama protona više nisu dovoljni neutroni kao ravnoteža. Naime, prevelika je koncentracija protona na jednom mestu.
Jezgra radionuklida se spontano raspada prelazeći pri tome u neko drugo jezgro. Prilikom raspada jezgro radionuklida emituje čestice i/ili elektromagnetne zrake kratke talasne dužine. Emitovane čestice i elektromagnetski zraci se jednim imenom zovu jonizujuće zračenje. To je pojava radioaktivnosti, a sam proces je transmutacija, tj. spontani prelaz jednog jezgra u drugo, što se naziva radioaktivni raspad.
Nuklid je atom hemijskog elementa za koji je tačno poznat ne samo redni ili atomski broj Z, već i ukupan broj nukleona (protona i neutrona) u atomskom jezgru. U prirodi postoje samo 92 hemijska elementa i još 12 veštački proizvedenih, a poznato je oko 3 100 različitih nuklida, od kojih je 350 prirodnih i 2 750 veštačkih. Većina nuklida je nestabilna (radioaktivna), oko 2800. Pogodna kombinacija protona i neutrona čini atomsko jezgru stabilnom, čim je drugačije jezgro nastoji da se izbacivanjem nukleona približi stabilnoj konfiguraciji. Energijski nivoi u jezgru se popunjavaju kako bi se dostigla konfiguracije minimalne energije, to jest maksimalne stabilnosti.
Istorija
[uredi | uredi izvor]Radioaktivni izotopi
[uredi | uredi izvor]Postojanje izotopa je prvi put sugerisao radiohemičar Frederik Sodi 1913. godine na osnovu studija lanaca radioaktivnog raspada koje su ukazale na oko 40 različitih vrsta koje se nazivaju radioelementi (tj. radioaktivni elementi) između uranijuma i olova, iako je periodična tabela dozvoljavala samo 11 elementi između olova i uranijuma.[27][28][29]
Nekoliko pokušaja da se ovi novi radioelementi hemijski odvoje su propali.[30] Na primer, Sodi je 1910. pokazao da je mezotorijum (kasnije se pokazalo da je 228Ra), radijum (226Ra, najdugovečniji izotop) i torijum X (224Ra) nemoguće razdvojiti.[31] Pokušaji da se radioelementi smeste u periodni sistem naveli su Sodija i Kazimierza Fajansa da nezavisno predlože svoj zakon radioaktivnog pomeranja 1913. godine, prema kome alfa raspad proizvodi element dva mesta levo u periodnom sistemu, dok emisija beta raspada proizvodi element jedno mesto udesno.[32][33][34][35] Sodi je prepoznao da je emisija alfa čestice praćene sa dve beta čestice dovela do formiranja elementa hemijski identičnog početnom elementu, ali sa masom za četiri jedinice lakšom i sa različitim radioaktivnim svojstvima.
Sodi je predložio da nekoliko tipova atoma (koji se razlikuju po radioaktivnim svojstvima) može da zauzme isto mesto u tabeli.[29] Na primer, alfa raspad uranijuma-235 formira torijum-231, dok beta raspad aktinijuma-230 formira torijum-230.[30] Termin „izotop“, grčki za „na istom mestu“,[29] je Sodiju predložila Margaret Tod, škotska lekarka i porodična prijateljica, tokom razgovora u kojem joj je objasnio svoje ideje.[31][36][37][38][39][40] On je dobio Nobelovu nagradu za hemiju 1921. delom za svoj rad na izotopima.

Godine 1914, T. V. Ričards je pronašao varijacije između atomske težine olova iz različitih mineralnih izvora, koje se mogu pripisati varijacijama u izotopskom sastavu zbog različitog radioaktivnog porekla.[30][41][42]
Stabilni izotopi
[uredi | uredi izvor]Prvi dokaz za više izotopa stabilnog (neradioaktivnog) elementa pronašao je Džozef Džon Tomson 1912. godine kao deo svog istraživanja sastava kanalnih zraka (pozitivnih jona).[43] Tomson je kanalisao tokove neonskih jona kroz paralelna magnetna i električna polja, merio njihov otklon postavljanjem fotografske ploče na njihovu putanju i izračunavao njihov odnos mase i naelektrisanja koristeći metod koji je postao poznat kao Tomsonova parabolna metoda. Svaki mlaz je stvorio blistavu mrlju na ploči na tački u koju je udario. Tomson je primetio dve odvojene parabolične mrlje svetlosti na fotografskoj ploči (pogledajte sliku), što je sugerisalo dve vrste jezgara sa različitim odnosom mase i naelektrisanja. On je napisao: „Stoga, mislim da nema sumnje da ono što se naziva neon nije jednostavan gas, već mešavina dva gasa, od kojih jedan ima atomsku težinu oko 20, a drugi oko 22. Parabola težeg gasa je uvek mnogo slabija od onog zbog lakšeg, tako da verovatno teži gas čini samo mali procenat smeše.“[44]
F.V. Aston je kasnije otkrio više stabilnih izotopa za brojne elemente koristeći maseni spektrograf. Godine 1919, Aston je proučavao neon sa dovoljnom rezolucijom da pokaže da su dve izotopske mase veoma bliske celim brojevima 20 i 22 i da nijedna nije jednaka poznatoj molarnoj masi (20,2) gasa neona. Ovo je primer Astonovog pravila celog broja za izotopske mase, koje kaže da su velika odstupanja elementarnih molarnih masa od celih brojeva prvenstveno posledica činjenice da je element mešavina izotopa. Aston je na sličan način pokazao 1920. godine da je molarna masa hlora (35,45) ponderisani prosek skoro integralnih masa za dva izotopa 35Cl i 37Cl.[45][46]
Neutroni
[uredi | uredi izvor]Nakon otkrića neutrona od strane Džejmsa Čedvika 1932. godine,[47] razjašnjen je ultimatni osnovni uzrok postojanja izotopa, to jest, jezgra različitih izotopa za dati element imaju različit broj neutrona, iako imaju isti broj od protona.
Varijacije u svojstvima između izotopa
[uredi | uredi izvor]Hemijska i molekularna svojstva
[uredi | uredi izvor]Neutralni atom ima isti broj elektrona kao i protoni. Dakle, svi različiti izotopi datog elementa imaju isti broj elektrona i dele sličnu elektronsku strukturu. Pošto je hemijsko ponašanje atoma u velikoj meri određeno njegovom elektronskom strukturom, različiti izotopi pokazuju skoro identično hemijsko ponašanje.
Glavni izuzetak od ovoga je kinetički izotopski efekat:[48][49][50] zbog svoje veće mase, teži izotopi imaju tendenciju da reaguju nešto sporije od lakših izotopa istog elementa. Ovo je daleko najizraženije za protijum (1H), deuterijum (2H) i tricijum (3H), jer deuterijum ima dvostruko veću masu od protijuma, a tricijum ima tri puta veću masu od protijuma.[51] Ove razlike u masi takođe utiču na ponašanje njihovih odgovarajućih hemijskih veza, promenom centra gravitacije (redukovane mase) atomskih sistema. Međutim, za teže elemente, relativna razlika u masi između izotopa je mnogo manja, tako da su efekti masene razlike na hemiju obično zanemarljivi. (Teški elementi takođe imaju relativno više neutrona nego lakši elementi, tako da je odnos nuklearne mase i kolektivne elektronske mase nešto veći.) Postoji i efekat ravnoteže izotopa.[52]
Slično tome, dva molekula koja se razlikuju samo po izotopima svojih atoma (izotopolozi[53][54]) imaju identičnu elektronsku strukturu, i stoga gotovo nerazlučiva fizička i hemijska svojstva (opet sa deuterijumom i tricijumom koji su primarni izuzeci). Vibracioni modovi molekula su određeni njegovim oblikom i masama njegovih konstitutivnih atoma; tako da različiti izotopolozi imaju različite skupove vibracionih modova. Pošto vibracioni modovi dozvoljavaju molekulu da apsorbuje fotone odgovarajućih energija, izotopolozi imaju različita optička svojstva u infracrvenom opsegu.
Nuklearna svojstva i stabilnost
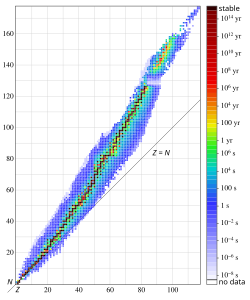
[uredi | uredi izvor]Atomska jezgra se sastoje od protona i neutrona povezanih rezidualnom jakom silom. Pošto su protoni pozitivno naelektrisani, odbijaju se jedni od drugih. Neutroni, koji su električno neutralni, stabilizuju jezgro na dva načina. Njihovo prisustvo malo razmiče protone, smanjujući elektrostatičko odbijanje između protona, i oni vrše privlačnu nuklearnu silu jedni na druge i na protone. Iz tog razloga, jedan ili više neutrona su neophodni da bi se dva ili više protona vezali u jezgro. Kako se broj protona povećava, tako se povećava i odnos neutrona i protona neophodan da bi se obezbedilo stabilno jezgro (pogledajte grafikon desno). Na primer, iako je odnos neutron:proton kod 32He 1:2, odnos neutron:proton kod 23892U je veći od 3:2. Jedan broj lakših elemenata ima stabilne nuklide u odnosu 1:1 (Z = N). Nuklid 4020Ca (kalcijum-40) je opservaciono najteži stabilni nuklid sa istim brojem neutrona i protona. Svi stabilni nuklidi teži od kalcijuma-40 sadrže više neutrona nego protona.
Broj izotopa po elementu
[uredi | uredi izvor]Od 80 elemenata sa stabilnim izotopom, najveći broj stabilnih izotopa uočenih za bilo koji element je deset (za element kalaj). Nijedan element nema devet ili osam stabilnih izotopa. Pet elemenata ima sedam stabilnih izotopa, osam ima šest stabilnih izotopa, deset ima pet stabilnih izotopa, devet ima četiri stabilna izotopa, pet ima tri stabilna izotopa, 16 ima dva stabilna izotopa (računajući 180m73Ta kao stabilnog), a 26 elemenata ima samo jedan stabilni izotop (među njima 19 su tzv. mononuklidni elementi, koji imaju jedan primordijalni stabilni izotop koji dominira i fiksira atomsku težinu prirodnog elementa do visoke preciznosti; javljaju se i 3 radioaktivna mononuklidna elementa).[55] Ukupno postoji 251 nuklid za koji nije primećeno da se raspada. Za 80 elemenata koji imaju jedan ili više stabilnih izotopa, prosečan broj stabilnih izotopa je 251/80 ≈ 3,14 izotopa po elementu.
Parni i neparni brojevi nukleona
[uredi | uredi izvor]| p, n | EE | OO | EO | OE | Ukupno |
|---|---|---|---|---|---|
| Stabilni | 145 | 5 | 53 | 48 | 251 |
| Dugovečni | 23 | 4 | 3 | 5 | 35 |
| Sva primordijalni | 168 | 9 | 56 | 53 | 286 |
Odnos proton:neutron nije jedini faktor koji utiče na nuklearnu stabilnost. Ona takođe zavisi od parnosti ili neparnosti njegovog atomskog broja Z, neutronskog broja N i, posledično, njihovog zbira, masenog broja A. Neparnost i Z i N ima tendenciju smanjivanja nuklearne energije vezivanja, čineći neparna jezgra, generalno, manje stabilnim. Ova izuzetna razlika u energiji nuklearnog vezivanja između susednih jezgara, posebno neparnih A izobara, ima važne posledice: nestabilni izotopi sa neoptimalnim brojem neutrona ili protona raspadaju se beta raspadom (uključujući emisiju pozitrona), hvatanjem elektrona ili drugim manje uobičajenim raspadom modovima kao što su spontana fisija[56][57] i raspad klastera.[58][59]
Većina stabilnih nuklida su oblika parni-proton-parni-neutron, gde su svi brojevi Z, N, i A parni. Nuklidi sa neparnim A su podeljeni (približno ravnomerno) na neutrone oblika neparni-proton-parni-neutron i parni-proton-neparni-neutron. Stabilni neparni-proton-neparni-neutron nuklidi su najmanje zastupljeni.
Parni atomski broj
[uredi | uredi izvor]Sed od 146 nuklida oblika parni-proton, parni-neutrona (EE) čini ~58% svih stabilnih nuklida i svi imaju spin 0 zbog uparivanja. Postoje i 24 primordijalna dugovečna parno-parna nuklida. Kao rezultat, svaki od 41 parna elementa od 2 do 82 ima najmanje jedan stabilan izotop, i većina ovih elemenata ima nekoliko primordijalnih izotopa. Polovina ovih parnih elemenata ima šest ili više stabilnih izotopa. Ekstremna stabilnost helijuma-4 je posledica dvostrukog uparivanja[60][61] 2 protona i 2 neutrona što sprečava da bilo koji nuklid koji sadrži pet (52He, 53Li) ili osam (84Be) nukleona postoji dovoljno dugo da služe kao platforme za nakupljanje težih elemenata putem nuklearne fuzije u zvezdama (pogledajte trostruki alfa proces).
| Raspad | Poluživot | |
|---|---|---|
| 11348Cd | beta | 7,7×1015 a |
| 14762Sm | alfa | 1,06×1011 a |
| 23592U | alfa | 7,04×108 a |
Samo pet stabilnih nuklida sadrži neparan broj protona i neparan broj neutrona. Prva četiri „neparno-neparna” nuklida se javljaju u nuklidima male mase, za koje bi promena protona u neutron ili obrnuto dovela do veoma jednostranog odnosa proton-neutron (21H, 63Li, 105B, i 147N; spinovi 1, 1, 3, 1). Smatra se da je jedini drugi potpuno „stabilan“ nepar-neparni nuklid, 180m73Ta (spin 9), najređi od 251 stabilnog nuklida, i jedini je primordijalno nuklearni izomer, za koji još uvek nije primećeno da se raspada uprkos eksperimentalnim pokušajima.[62]
Poznati su mnogi neparni-neparni radionuklidi (kao što je osnovno stanje tantala-180) sa relativno kratkim poluživotom. Obično se beta raspadaju do svojih obližnjih parno-parnih izobara koji imaju uparene protone i uparene neutrone. Od devet primordijalnih nuklida oblika neparan-neparan (pet stabilnih i četiri radioaktivna sa dugim periodom poluraspada), samo je 147N najčešći izotop široko zastupljenog elementa. Ovo je slučaj jer je deo CNO ciklusa. Nuklidi 63Li i 105B su manjinski izotopi elemenata koji su i sami retki u poređenju sa drugim lakim elementima, dok ostalih šest izotopa čine samo mali udeo prirodne zastupljenosti njihovih elemenata.
Neparni atomski broj
[uredi | uredi izvor]Set od 53 stabilna nuklida imaju paran broj protona i neparan broj neutrona. Oni su manjina u poređenju sa parno-parnim izotopima, kojih je oko 3 puta više. Među 41 elementa sa parnim Z koji imaju stabilan nuklid, samo dva elementa (argon i cerijum) nemaju parno-neparne stabilne nuklide. Jedan element (kalaj) ima tri. Postoje 24 elementa koji imaju jedan paran-neparni nuklid i 13 koji imaju dva neparno-parna nuklida. Od 35 primordijalnih radionuklida postoje četiri parno-neparna nuklida (pogledajte tabelu desno), uključujući fisijski 23592U. Zbog svog neparnog broja neutrona, parno-neparni nuklidi imaju tendenciju da imaju velike poprečne preseke hvatanja neutrona, zbog energije koja je rezultat efekata uparivanja neutrona. Ovi stabilni nuklidi parnih protona neparnih neutrona su neuobičajeni u pogledu zastupljenosti u prirodi, generalno zato što da bi se formirali i ušli u primordijalnu zastupljenost, morali bi da izbegnu hvatanja neutrona čime bi formirali još neke stabilne parno-parne izotope, tokom oba s-procesa i r-procesa hvatanja neutrona, tokom nukleosinteze u zvezdama. Iz tog razloga, samo su 19578Pt i 94Be prirodno najzastupljeniji izotopi svog elementa.
Set od 48 stabilnih nuklida oblika neparni-proton-parni-neutron, stabilizovanih njihovim uparenim neutronima, formira većinu stabilnih izotopa neparnih elemenata; vrlo malo nuklida oblika neparni-proton-neparni-neutron čine ostale. Postoji 41 neparni element sa Z = 1 do 81, od kojih 39 ima stabilne izotope (tehnecijum (Tc) i prometijum (Pm) nemaju stabilne izotope). Od ovih 39 elemenata sa neparnim Z, 30 elemenata (uključujući vodonik-1 gde je 0 neutrona parano) ima jedan stabilan neparno-parni izotop i devet elemenata: hlor (Cl), kalijum (K), bakar (Cu), galijum (Ga), brom (Br), [[silver]|srebro]] (Ag), antimon (Sb), iridijum (Ir), and talijum (Tl), imaju po dva neparno-parna stabilna izotopa. Ovo čini ukupno 30 + 2(9) = 48 stabilnih neparno-parnih izotopa.
Takođe postoji pet primordijalnih dugovečnih radioaktivnih neparno-parnih izotopa, 8737Rb, 11549In, 18775Re, 15163Eu, i 20983Bi. Poslednja dva su tek nedavno otkrivena da se raspadaju, sa periodom poluraspada dužim od 1018 godina.
Neparni neutronski broj
[uredi | uredi izvor]| N | Paran | Neparan |
|---|---|---|
| Stabilan | 193 | 58 |
| Dugovečan | 28 | 7 |
| Svi primordijalni | 221 | 65 |
Aktinidi sa neparnim brojem neutrona su generalno fisioni (sa termičkim neutronima[63][64][65]), dok oni sa parnim brojem neutrona generalno nisu, iako podležu fisiji sa brzim neutronima. Svi opservacioni stabilni nuklidi oblika neparan-neparan imaju celobrojni spin različit od nule. To je zato što pojedinačni neupareni neutron i neupareni proton imaju veću privlačnost nuklearne sile jedni prema drugima, ako su njihovi spinovi poravnati (stvarajući ukupan spin od najmanje 1 jedinice), umesto antiporavnanih. Pogledajte deuterijum za najjednostavniji slučaj ovog nuklearnog ponašanja.
Samo 19578Pt, 94Be, i 147N imaju neparan broj neutrona i najprirodniji su izotop svog elementa.
Pojava u prirodi
[uredi | uredi izvor]Elementi se sastoje bilo od jednog nuklida (mononuklidnih elemenata[66]), ili od više od jednog prirodnog izotopa. Nestabilni (radioaktivni) izotopi su ili primordijalni ili postprimordijalni. Primordijalni izotopi su bili proizvod zvezdane nukleosinteze ili drugog tipa nukleosinteze kao što je spalacije kosmičkih zraka,[67][68][69][70][71] i opstali su do sada jer je njihova brzina raspadanja tako spora (npr. uranijum-238 i kalijum-40). Post-primordijalni izotopi su stvoreni bombardovanjem kosmičkim zracima kao kosmogeni nuklidi[72][73][74] (npr. tricijum, ugljenik-14), ili raspadom radioaktivnog primordijalnog izotopa do radioaktivne ćerke radiogenog nuklida[75][76][77][78] (npr. uranijum u radijum). Nekoliko izotopa se prirodno sintetiše kao nukleogeni nuklidi, nekom drugom prirodnom nuklearnom reakcijom, na primer kada neutrone iz prirodne nuklearne fisije apsorbuje drugi atom.
Kao što je gore objašnjeno, samo 80 elemenata ima stabilne izotope, a 26 od njih ima samo jedan stabilan izotop. Dakle, oko dve trećine stabilnih elemenata se prirodno javlja na Zemlji u više stabilnih izotopa, pri čemu je najveći broj stabilnih izotopa za element deset, za kalaj (Sn). Postoji oko 94 elemenata koja se prirodno nalaze na Zemlji (do plutonijuma), mada se neki detektuju samo u veoma malim količinama, kao što je plutonijum-244. Naučnici procenjuju da se elementi koji se prirodno javljaju na Zemlji (neki samo kao radioizotopi) javljaju kao ukupno 339 izotopa (nuklida).[79] Samo 251 od ovih prirodno prisutnih nuklida je stabilno, u smislu da nikada nije primećeno da se raspadaju do sada. Dodatnih 35 primordijalnih nuklida (do ukupno 286 primordijalnih nuklida) su radioaktivni sa poznatim poluraspadom, ali imaju period poluraspada duži od 100 miliona godina, što im omogućava da postoje od početka Sunčevog sistema. Za detalje pogledajte spisak nuklida.
Svi poznati stabilni nuklidi se prirodno javljaju na Zemlji; ostali prirodni nuklidi su radioaktivni, ali se javljaju na Zemlji zbog njihovog relativno dugog poluraspada, ili zbog drugih vidova tekuće prirodne produkcije. Ovo uključuje gore pomenute kosmogene nuklide, nukleogene nuklide, i sve radiogene nuklide nastale tekućim raspadom primordijalnog radioaktivnog nuklida, kao što su radon i radijum iz uranijuma.
Dodatnih ~3000 radioaktivnih nuklida koji se ne nalaze u prirodi stvoreno je u nuklearnim reaktorima i u akceleratorima čestica. Mnogi kratkotrajni nuklidi koji se prirodno ne nalaze na Zemlji takođe su primećeni spektroskopskom analizom, jer su prirodno stvoreni u zvezdama ili supernovama. Primer je aluminijum-26, koji se prirodno ne nalazi na Zemlji, ali se nalazi u izobilju u astronomskim razmerama.
Tabelarno prikazane atomske mase elemenata su proseci koji objašnjavaju prisustvo više izotopa različitih masa. Pre otkrića izotopa, empirijski određene necelobrojne vrednosti atomske mase zbunjivale su naučnike. Na primer, uzorak hlora sadrži 75,8% hlora-35 i 24,2% hlora-37, što daje prosečnu atomsku masu od 35,5 jedinica atomske mase.
Prema opšteprihvaćenoj kosmološkoj teoriji, u Velikom prasku su nastali samo izotopi vodonika i helijuma, tragovi nekih izotopa litijuma i berilijuma, a možda i nešto bora, dok su svi ostali nuklidi sintetisani kasnije, u zvezdama i supernovama i u interakcije između energetskih čestica kao što su kosmički zraci i prethodno proizvedenih nuklida. (Pogledajte nukleosintezu za detalje o različitim procesima za koje se smatra da su odgovorni za proizvodnju izotopa.) Odgovarajuće obilje izotopa na Zemlji proizilazi iz količina koje su formirane ovim procesima, njihovog širenja kroz galaksiju i stopa raspada za izotope koji su nestabilni. Nakon početne koalescencije Sunčevog sistema, izotopi su redistribuirani prema masi, a izotopski sastav elemenata neznatno varira od planete do planete. Ovo ponekad omogućava praćenje porekla meteorita.
Atomska masa izotopa
[uredi | uredi izvor]Atomska masa (mr) izotopa (nuklida) je određena uglavnom njegovim masenim brojem (tj. brojem nukleona u njegovom jezgru). Male korekcije su posledica energije vezivanja jezgra[80][81] (pogledajte defekt mase[82][83][84]), male razlike u masi između protona i neutrona i mase elektrona povezanih sa atomom, poslednjeg jer se odnos elektron:nukleon razlikuje među izotopima.
Maseni broj je bezdimenzionalna veličina. Atomska masa se, s druge strane, meri pomoću jedinice atomske mase zasnovane na masi atoma ugljenika-12. Označava se simbolima „u” (za jedinstvenu jedinicu atomske mase) ili „Da” (za dalton[85][86]).
Atomske mase prirodnih izotopa elementa određuju standardnu atomsku težinu elementa.[87][88] Kada element sadrži N izotopa, donji izraz se primenjuje za prosečnu atomsku masu :
gde su m1, m2, ..., mN atomske mase svakog pojedinačnog izotopa, a x1, ..., xN su relativne količine ovih izotopa.
Upotreba izotopa
[uredi | uredi izvor]Postoji nekoliko primena, koje koriste svojstva različitih izotopa datog elementa. Jedna od najčešćih primena je trejser ili marker u tehnici zvanoj izotopsko obeležavanje. Izotopi datog elementa ne mogu se razlikovati međusobno hemijskim metodama. Ipak, mogu se razlikovati korišćenjem fizičkohemijskih metoda, recimo masene spektrometrije (direktne razlike u masi), infracrvene spektroskopije (na osnovu vibracionih frekvencija u molekulu - teži izotopi vibriraju nižim frekvencijama od lakših), nuklearne magnetne rezonancije (na osnovu različitih žiromagnetnih odnosa itd.
Primer korišćenja izotopskog obeležavanja je proučavanje fenola (C6H5OH) u vodi. Nakon dodavanja fenola deuterisanoj vodi (voda koja sadrži D2O osim uobičajenog H2O), istraživači su primetili supstituciju vodonika deuterijumom u hidroksilnoj grupi (C6H5OD), što znači da se fenol lako podvrgava reakcijama razmene vodonika sa vodom. Samo hidroksilna grupa je učestvovala u reakciji, što znači da ostalih 5 vodonikovih atoma ne učestvuju u reakcijama razmene.
Izotopska izmena se takođe može koristiti da se odrede mehanizmi reakcije putem kinetičkog izotopskog efekta (kinetic isotope effect).
Osim izotopskog obeležavanja, nekoliko vrsta spektroskopije koristi jedinstvena nuklearna svojstva posebnih izotopa. Na primer, nuklearno magnetno rezonantna (NMR) spektroskopija se može koristiti samo za izotope sa nuklearnim spinom koji nije nula (nonzero). Izotopi koji se najčešće koriste u NMR spektroskopiji su 1H, 2D, 13C, i 31P. Misbauerova spektroskopija (Mossbauer spectroscopy) se zasniva na detektovanju nuklearnih prelaza određenih izotopa, recimo 57Fe.
Izotopski sastav elemenata se razlikuje od planete do planete. Ova činjenica omogućava da se odredi poreklo meteorita. Neki meteoriti su klasifikovani kao mesečevi ili Marsovi meteoriti.
Radioaktivni izotopi takođe imaju važne primene. Razvoj nuklearne energije i nuklearnog oružja zahtevaju znatno veće količine određenih izotopa. Proces separacije izotopa predstavlja značajan tehnološki izazov.
Radioizotopi se takođe često koriste u medicini, biohemiji, i hemiji kao trejseri. Male količine radioizotopa mogu lako da se detektuju zbog karakterističnih emisija raspadajućeg jezgra.
Prirodni radioaktivni raspad 14C omogućava radiougljenično datiranje. Kosmički zraci stvaraju izotop 14C u atmosferi tako što u sudaru sa jezgrima iz vazduha izbijaju slobodne neutrone. Ti neutroni mogu jezgro azota iz molekula azota (N2) da transformišu u izotop ugljenika 14C:
- 1n + 14N → 14C + 1p
Ovaj izotop se na kraju ugradi u molekul ugljendioksida i tako dospeva u biljke, a preko njih i u životinje. Izotop 14C se, dakle, u prirodi stalno stvara (zbog kosmičkih zraka) i raspada (zbog nestabilnosti) te je njegova koncentracija u živim organizmima konstantna. Međutim, u neživom svetu nema razmene ugljendioksida te koncentracija 14C opada sa vremenom. Dakle, merenjem preostale radioaktivnosti 14C u biološkom uzorku, može da se utvrdi vreme kada je kruženje ugljenika zaustavljeno (kada je životinja uginula, drvo posečeno, biljka ubrana...).
Zbog stabilnosti i prirodne rasprostranjenosti, izotop 12C je izabran kao standard za jedinicu atomske mase, (dvanaestina mase izotopa 12C) a onda takođe u definiciji mola, u osnovnim jedinicama SI sistema.
Prečišćavanje izotopa
[uredi | uredi izvor]Postoji nekoliko aplikacija koje koriste svojstva različitih izotopa datog elementa. Odvajanje izotopa je značajan tehnološki izazov,[89] posebno sa teškim elementima kao što su uranijum ili plutonijum.[90] Lakši elementi kao što su litijum, ugljenik, azot i kiseonik se obično odvajaju difuzijom gasa njihovih jedinjenja kao što su CO i NO. Odvajanje vodonika i deuterijuma je neobično jer se zasniva na hemijskim, a ne fizičkim svojstvima, na primer u Girdlerovom sulfidnom procesu.[91][92][93][94] Izotopi uranijuma su odvojeni u rasutom stanju difuzijom gasa, gasnim centrifugiranjem, laserskom jonizacionom separacijom i (u Projektu Menhetn) vrstom proizvodne masene spektrometrije.
Korišćenje hemijskih i bioloških svojstava
[uredi | uredi izvor]- Analiza izotopa je određivanje izotopskog potpisa,[95][96][97] relativne zastupljenosti izotopa datog elementa u određenom uzorku.[98][99][100][101][102][103] Analiza izotopa se često radi masenom spektrometrijom odnosa izotopa.[104][105][106] Naročito za biogene supstance mogu se javiti značajne varijacije izotopa C, N, i O. Analiza takvih varijacija ima širok spektar primena, kao što je otkrivanje falsifikata u prehrambenim proizvodima[107] ili geografsko poreklo proizvoda korišćenjem izoskejpa.[108][109][110][111][112][113] Identifikacija određenih meteorita nastalih od Marsa je delimično zasnovana na izotopskom potpisu gasova u tragovima koji se nalaze u njima.[114][115][116]
- Izotopska supstitucija se može koristiti za određivanje mehanizma hemijske reakcije putem kinetičkog izotopskog efekta.[117][118][119][120][121]
- Još jedna uobičajena primena je izotopsko obeležavanje, korišćenje neobičnih izotopa kao tragača ili markera u hemijskim reakcijama.[122] Obično se atomi datog elementa ne razlikuju jedan od drugog. Međutim, korišćenjem izotopa različitih masa, čak i različiti neradioaktivni stabilni izotopi mogu se razlikovati masenom spektrometrijom ili infracrvenom spektroskopijom. Na primer, u „obeležavanju stabilnih izotopa aminokiselinama u ćelijskoj kulturi (SILAC[123][124][125][126][127])“ stabilni izotopi se koriste za kvantifikaciju proteina. Ako se koriste radioaktivni izotopi, oni se mogu detektovati po zračenju koje emituju (ovo se zove radioizotopsko obeležavanje).
- Izotopi se obično koriste za određivanje koncentracije različitih elemenata ili supstanci pomoću metode razblaživanja izotopa,[128][129] pri čemu se poznate količine izotopski supstituisanih jedinjenja mešaju sa uzorcima, a izotopski potpisi dobijenih smeša se određuju masenom spektrometrijom.
Korišćenje nuklearnih svojstava
[uredi | uredi izvor]- Tehnika slična obeležavanju radioizotopa je radiometrijsko datiranje: korišćenjem poznatog poluživota nestabilnog elementa, može se izračunati količina vremena koja je protekla od postojanja poznate koncentracije izotopa. Najpoznatiji primer je radiokarbonsko datiranje koje se koristi za određivanje starosti ugljeničnih materijala.
- Nekoliko oblika spektroskopije oslanja se na jedinstvena nuklearna svojstva specifičnih izotopa, radioaktivnih i stabilnih. Na primer, spektroskopija nuklearne magnetne rezonance (NMR) se može koristiti samo za izotope sa nuklearnim spinom koji nije nula. Najčešći nuklidi koji se koriste u NMR spektroskopiji su 1H, 2D, 15N, 13C, i 31P.
- Misbauerova spektroskopija se takođe oslanja na nuklearne prelaze specifičnih izotopa, kao što je 57Fe.[130][131][132][133]
- Radionuklidi takođe imaju važnu upotrebu. Nuklearna energija[134][135][136] i razvoj nuklearnog oružja zahtevaju relativno velike količine specifičnih izotopa. Nuklearna medicina i radijaciona onkologija[137][137][138][139][140] koriste radioizotope za medicinsku dijagnozu i lečenje.
Vidi još
[uredi | uredi izvor]- Tabela izotopa (podeljena) - tabela svih poznatih izotopa
- Tabela izotopa (kompletna)
- Lista čestica
- Izotopi su nuklidi koji imaju isti broj protona; uporedi:
- Izotoni su nuklidi koji imaju isti broj neutrona.
- Izobari su nuklidi koji imaju isti maseni broj to jest zbir protona i neutrona.
- Nuklearni izomeri su različita pobuđena stanja istog tipa jezgra. Promena jednog izomera u drugi je praćena emisijom ili apsorpcijom gama zraka, ili procesom interne konverzije. (ne treba mešati sa hemijskim izomerima.)
Reference
[uredi | uredi izvor]- ^ Herzog, Gregory F. (2. 6. 2020). „Isotope”. Encyclopedia Britannica.
- ^ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Arhivirano na sajtu Wayback Machine (3. mart 2016), 1970; probably in the 1958 first edition as well
- ^ „NuDat 2 Description”. Arhivirano iz originala 23. 12. 2016. g. Pristupljeno 2. 1. 2016.
- ^ Soddy, Frederick (1913). „Intra-atomic charge”. Nature. 92 (2301): 399—400. Bibcode:1913Natur..92..399S. S2CID 3965303. doi:10.1038/092399c0.
- ^ „IUPAP Red Book” (PDF). Arhivirano iz originala (PDF) 2015-03-18. g. Pristupljeno 2018-01-06.
- ^ a b IUPAC Gold Book
- ^ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Arhivirano 2016-03-03 na sajtu Wayback Machine, 1970; probably in the 1958 first edition as well
- ^ This notation seems to have been introduced in the second half of the 1930s. Before that, various notations were used, such as Ne(22) for neon-22 (1934), Ne22 for neon-22 (1935), or even Pb210 for lead-210 (1933).
- ^ Samir Maji; et al. (2006). „Separation of samarium and neodymium: a prerequisite for getting signals from nuclear synthesis”. Analyst. 131 (12): 1332—1334. Bibcode:2006Ana...131.1332M. PMID 17124541. doi:10.1039/b608157f.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). „Detection of Plutonium-244 in Nature”. Nature. 234 (5325): 132—134. Bibcode:1971Natur.234..132H. S2CID 4283169. doi:10.1038/234132a0.
- ^ Lachner, J.; et al. „Attempt to detect primordial 244Pu on Earth”. Physical Review C. 85 (1): 015801. Bibcode:2012PhRvC..85a5801L. doi:10.1103/PhysRevC.85.015801.
- ^ Wu, Yang; Dai, Xiongxin; Xing, Shan; Luo, Maoyi; Christl, Marcus; Synal, Hans-Arno; Hou, Shaochun. „Direct search for primordial 244Pu in Bayan Obo bastnaesite”. Chinese Chemical Letters. 33 (7): 3522—3526. doi:10.1016/j.cclet.2022.03.036. Pristupljeno 29. 1. 2024.
- ^ Belli, P.; Bernabei, R.; Danevich, F. A.; et al. (2019). „Experimental searches for rare alpha and beta decays”. European Physical Journal A. 55 (8): 140—1—140—7. Bibcode:2019EPJA...55..140B. ISSN 1434-601X. S2CID 201664098. arXiv:1908.11458
 . doi:10.1140/epja/i2019-12823-2.
. doi:10.1140/epja/i2019-12823-2.
- ^ Bajc, Borut; Hisano, Junji; Kuwahara, Takumi; Omura, Yuji (2016). „Threshold corrections to dimension-six proton decay operators in non-minimal SUSY SU(5) GUTs”. Nuclear Physics B. 910: 1. Bibcode:2016NuPhB.910....1B. S2CID 119212168. arXiv:1603.03568
 . doi:10.1016/j.nuclphysb.2016.06.017.
. doi:10.1016/j.nuclphysb.2016.06.017.
- ^ Francis, Matthew R. (22. 9. 2015). „Do protons decay?”. symmetry magazine (na jeziku: engleski). Pristupljeno 2020-11-12.
- ^ Talou, P.; Carjan, N.; Strottman, D. (1998). „Time-dependent properties of proton decay from crossing single-particle metastable states in deformed nuclei”. Physical Review C. 58 (6): 3280—3285. Bibcode:1998PhRvC..58.3280T. S2CID 119075457. arXiv:nucl-th/9809006
 . doi:10.1103/PhysRevC.58.3280.
. doi:10.1103/PhysRevC.58.3280.
- ^ Dicus, D. A.; Letaw, J. R.; Teplitz, D. C.; Teplitz, V. L. (januar 1982). „Effects of proton decay on the cosmological future”. The Astrophysical Journal (na jeziku: engleski). 252: 1. Bibcode:1982ApJ...252....1D. ISSN 0004-637X. doi:10.1086/159528.
- ^ Trixler, F. (2013). „Quantum Tunnelling to the Origin and Evolution of Life”. Current Organic Chemistry. 17 (16): 1758—1770. PMC 3768233
 . PMID 24039543. doi:10.2174/13852728113179990083.
. PMID 24039543. doi:10.2174/13852728113179990083.
- ^ „NuDat 2 Description”. Arhivirano iz originala 23. 12. 2016. g. Pristupljeno 2. 1. 2016.
- ^ Yan, X.; Cheng, Z.; Abdukerim, A.; et al. (2024). „Searching for two-neutrino and neutrinoless double beta decay of 134Xe with the PandaX-4T experiment”. Physical Review Letters. 132 (152502). arXiv:2312.15632
 . doi:10.1103/PhysRevLett.132.152502.
. doi:10.1103/PhysRevLett.132.152502.
- ^ Beeman, J. W.; Bellini, F.; Cardani, L.; Casali, N.; Di Domizio, S.; Fiorini, E.; Gironi, L.; Nagorny, S. S.; Nisi, S.; Orio, F.; Pattavina, L.; Pessina, G.; Piperno, G.; Pirro, S.; Previtali, E.; Rusconi, C.; Tomei, C.; Vignati, M. (2013). „New experimental limits on the α decays of lead isotopes”. The European Physical Journal A. 49 (4). ISSN 1434-6001. arXiv:1212.2422
 . doi:10.1140/epja/i2013-13050-7.
. doi:10.1140/epja/i2013-13050-7.
- ^ Akerib, D S; et al. (2020-10-01). „Search for two neutrino double electron capture of 124Xe and 126Xe in the full exposure of the LUX detector”. Journal of Physics G: Nuclear and Particle Physics. 47 (10): 105105. ISSN 0954-3899. arXiv:1912.02742
 . doi:10.1088/1361-6471/ab9c2d.
. doi:10.1088/1361-6471/ab9c2d.
- ^ Belli, P.; Bernabei, R.; Cappella, F.; Cerulli, R.; Danevich, F. A.; d’Angelo, S.; Incicchitti, A.; Kovtun, G. P.; Kovtun, N. G.; Laubenstein, M.; Poda, D. V.; Polischuk, O. G.; Shcherban, A. P.; Solopikhin, D. A.; Suhonen, J.; Tretyak, V. I. (2013-03-06). „Search for 2 β decays of 96 Ru and 104 Ru by ultralow-background HPGe γ spectrometry at LNGS: Final results”. Physical Review C. 87 (3). ISSN 0556-2813. arXiv:1302.7134
 . doi:10.1103/PhysRevC.87.034607.
. doi:10.1103/PhysRevC.87.034607.
- ^ Danevich, F. A.; Hult, M.; Junghans, A.; Kasperovych, D. V.; Kropivyansky, B. N.; Lutter, G.; Marissens, G.; Polischuk, O. G.; Romaniuk, M. V.; Stroh, H.; Tessalina, S.; Tretyak, V. I.; Ware, B. (2022). „New limits on double-beta decay of 190Pt and 198Pt”. The European Physical Journal C. 82 (1). ISSN 1434-6044. arXiv:2201.06555
 . doi:10.1140/epjc/s10052-022-09989-1.
. doi:10.1140/epjc/s10052-022-09989-1.
- ^ Belli, P.; Bernabei, R.; Boiko, R. S.; Cappella, F.; Caracciolo, V.; Cerulli, R.; Danevich, F. A.; Di Marco, A.; Incicchitti, A.; Kropivyansky, B. N.; Laubenstein, M.; Nisi, S.; Poda, D. V.; Polischuk, O. G.; Tretyak, V. I. (2019). „First direct search for 2ϵ and ϵβ+ of 144Sm and 2β- decay of 154Sm”. The European Physical Journal A. 55 (11). ISSN 1434-6001. arXiv:1910.02262
 . doi:10.1140/epja/i2019-12911-3.
. doi:10.1140/epja/i2019-12911-3.
- ^ Arnquist, I. J.; Avignone III, F. T.; Barabash, A. S.; Barton, C. J.; Bhimani, K. H.; Blalock, E.; Bos, B.; Busch, M.; Buuck, M.; Caldwell, T. S.; Christofferson, C. D.; Chu, P.-H.; Clark, M. L.; Cuesta, C.; Detwiler, J. A.; Efremenko, Yu.; Ejiri, H.; Elliott, S. R.; Giovanetti, G. K.; Goett, J.; Green, M. P.; Gruszko, J.; Guinn, I. S.; Guiseppe, V. E.; Haufe, C. R.; Henning, R.; Aguilar, D. Hervas; Hoppe, E. W.; Hostiuc, A.; Kim, I.; Kouzes, R. T.; Lannen V., T. E.; Li, A.; López-Castaño, J. M.; Massarczyk, R.; Meijer, S. J.; Meijer, W.; Oli, T. K.; Paudel, L. S.; Pettus, W.; Poon, A. W. P.; Radford, D. C.; Reine, A. L.; Rielage, K.; Rouyer, A.; Ruof, N. W.; Schaper, D. C.; Schleich, S. J.; Smith-Gandy, T. A.; Tedeschi, D.; Thompson, J. D.; Varner, R. L.; Vasilyev, S.; Watkins, S. L.; Wilkerson, J. F.; Wiseman, C.; Xu, W.; Yu, C.-H. (13. 10. 2023). „Constraints on the Decay of 180mTa”. Phys. Rev. Lett. 131 (15): 152501. arXiv:2306.01965
 . doi:10.1103/PhysRevLett.131.152501.
. doi:10.1103/PhysRevLett.131.152501.
- ^ Choppin, G.; Liljenzin, J. O. and Rydberg, J. (1995) Radiochemistry and Nuclear Chemistry (2nd ed.) Butterworth-Heinemann, pp. 3–5
- ^ Others had also suggested the possibility of isotopes; for example:
- Strömholm, Daniel and Svedberg, Theodor (1909) „Untersuchungen über die Chemie der radioactiven Grundstoffe II.”. Zeitschrift für anorganischen Chemie. 63: 197—206. (Investigations into the chemistry of the radioactive elements, part 2). ; see especially page 206.
- Alexander Thomas Cameron (1910). Radiochemistry. London, England: J. M. Dent & Sons. str. 141.. (Cameron also anticipated the displacement law.)
- ^ a b v Ley, Willy (oktobar 1966). „The Delayed Discovery”. For Your Information. Galaxy Science Fiction. str. 116—127.
- ^ a b v Scerri, Eric R (2007). The Periodic Table. Oxford University Press, USA. str. 176—179. ISBN 978-0-19-530573-9.
- ^ a b Nagel, Miriam C. (1982). „Frederick Soddy: From Alchemy to Isotopes”. Journal of Chemical Education. 59 (9): 739—740. Bibcode:1982JChEd..59..739N. doi:10.1021/ed059p739.
- ^ Kasimir Fajans (1913) „Über eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente”. Physikalische Zeitschrift. 14: 131—136. (On a relation between the type of radioactive transformation and the electrochemical behavior of the relevant radioactive elements), .
- ^ Soddy announced his "displacement law". Soddy, Frederick (1913). „The Radio-Elements and the Periodic Law”. Nature. 91 (2264): 57—58. Bibcode:1913Natur..91...57S. S2CID 3975657. doi:10.1038/091057a0..
- ^ Soddy elaborated his displacement law in: Soddy, Frederick. „Radioactivity”. Chemical Society Annual Report. 10: 262—288. 1913..
- ^ Alexander Smith Russell (1888–1972) also published a displacement law: Russell, Alexander S. „The periodic system and the radio-elements”. Chemical News and Journal of Industrial Science. 107: 49—52. 1913..
- ^ Soddy first used the word "isotope". Soddy, Frederick (1913). „Intra-atomic charge”. Nature. 92 (2301): 399—400. Bibcode:1913Natur..92..399S. S2CID 3965303. doi:10.1038/092399c0.
- ^ Fleck, Alexander (1957). „Frederick Soddy”. Biographical Memoirs of Fellows of the Royal Society. 3: 203—216. doi:10.1098/rsbm.1957.0014
 . „p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir George Beilby.”
. „p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir George Beilby.”
- ^ Budzikiewicz H, Grigsby RD (2006). „Mass spectrometry and isotopes: a century of research and discussion”. Mass Spectrometry Reviews. 25 (1): 146—57. Bibcode:2006MSRv...25..146B. PMID 16134128. doi:10.1002/mas.20061.
- ^ Scerri, Eric R (2007). „6”. The Periodic Table. Oxford University Press. ISBN 978-0-19-530573-9.. note 44 (p. 312) citing Alexander Fleck, described as a former student of Soddy's.
- ^ In his 1893 book, William T. Preyer also used the word "isotope" to denote similarities among elements. From Preyer, William T. (1893). Das genetische System der chemischen Elemente.. )
- ^ Soddy, Frederick (12. 12. 1922). „The origins of the conceptions of isotopes” (PDF). Nobelprize.org. str. 393. Pristupljeno 9. 1. 2019. „Thus the chemically identical elements - or isotopes, as I called them for the first time in this letter to Nature, because they occupy the same place in the Periodic Table ...”
- ^ „isotope—Origin and meaning”. www.etymonline.com (na jeziku: engleski). Pristupljeno 21. 10. 2021.
- ^ Thomson, J. J. (1912). „XIX. Further experiments on positive rays”. Philosophical Magazine. Series 6. 24 (140): 209—253. doi:10.1080/14786440808637325.
- ^ J. J. Thomson (1913). „Rays of positive electricity”. Proceedings of the Royal Society A. 89: 1—20..
- ^ Aston, F. W. (1920). „Isotopes and Atomic Weights”. Nature. 105 (2646): 617—619. S2CID 4267919. doi:10.1038/105617a0.
- ^ Mass spectra and isotopes Francis W. Aston, Nobel prize lecture 1922
- ^ Chadwick, James (1932). „Existence of a Neutron”. Proceedings of the Royal Society A. 136 (830): 692—708. Bibcode:1932RSPSA.136..692C. doi:10.1098/rspa.1932.0112
 .
.
- ^ Atkins P, de Paula J (2006). Atkins' Physical Chemistry
 (8th izd.). Oxford University Press. str. 286–288, 816–818. ISBN 978-0-19-870072-2.
(8th izd.). Oxford University Press. str. 286–288, 816–818. ISBN 978-0-19-870072-2.
- ^ Westaway, Kenneth C. (2006). „Using kinetic isotope effects to determine the structure of the transition states of SN. 2 reactions”. Advances in Physical Organic Chemistry. 41: 217—273. ISBN 978-0-12-033541-1. doi:10.1016/S0065-3160(06)41004-2.
- ^ Lynn KR, Yankwich PE (5. 8. 1961). „Isotope Fractionation at the Methyl Carbon in the Reactions of Cyanide Ion with Methyl Chloride and Methyl Bromide”. Journal of the American Chemical Society. 83 (15): 3220—3223. Bibcode:1961JAChS..83.3220L. doi:10.1021/ja01476a012.
- ^ Laidler, Keith (1987). Chemical Kinetics (na jeziku: engleski) (3rd izd.). India: Pearson Education. str. 427. ISBN 978-81-317-0972-6.
- ^ Laidler K.J. (1987). Chemical Kinetics (3rd izd.). Harper & Row. str. 428–433. ISBN 0-06-043862-2.
- ^ Seeman, Jeffrey I.; Secor, Henry V.; Disselkamp, R.; Bernstein, E. R. (1992). „Conformational analysis through selective isotopic substitution: supersonic jet spectroscopic determination of the minimum energy conformation of o-xylene”. Journal of the Chemical Society, Chemical Communications (9): 713. doi:10.1039/C39920000713.
- ^ Seeman, Jeffrey I.; Paine, III, John B. (7. 12. 1992). „Letter to the Editor: 'Isotopomers, Isotopologs'”. Chemical & Engineering News. American Chemical Society. 70 (2). doi:10.1021/cen-v070n049.p002
 .
.
- ^ Sonzogni, Alejandro (2008). „Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Arhivirano iz originala 2018-10-10. g. Pristupljeno 2013-05-03.
- ^ Schunck, Nicolas; Regnier, David (1. 7. 2022). „Theory of nuclear fission”. Progress in Particle and Nuclear Physics. 125. Bibcode:2022PrPNP.12503963S. arXiv:2201.02719
 . doi:10.1016/j.ppnp.2022.103963
. doi:10.1016/j.ppnp.2022.103963  .
.
- ^ Krane, Kenneth S. (1988). Introductory nuclear physics. Hoboken, NJ: Wiley. ISBN 9780471805533.
- ^ Poenaru, Dorin N.; Greiner, Walter (2011). „Cluster Radioactivity”. Clusters in Nuclei I. Lecture Notes in Physics. 818. Berlin: Springer. str. 1—56. ISBN 978-3-642-13898-0.
- ^ Poenaru, D. N.; Greiner, W. (1996). Nuclear Decay Modes. Bristol: Institute of Physics Publishing. str. 1—577. ISBN 978-0-7503-0338-5.
- ^ Gamow, George (1930). „Mass Defect Curve and Nuclear Constitution”. Proceedings of the Royal Society A. 126 (803): 632—644. Bibcode:1930RSPSA.126..632G. JSTOR 95297. doi:10.1098/rspa.1930.0032
 .
.
- ^ von Weizsäcker, C. F. (1935). „Zur Theorie der Kernmassen”. Zeitschrift für Physik (na jeziku: nemački). 96 (7–8): 431—458. Bibcode:1935ZPhy...96..431W. S2CID 118231854. doi:10.1007/BF01337700.
- ^ Hult, Mikael; Wieslander, J. S.; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). „Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer”. Applied Radiation and Isotopes. 67 (5): 918—21. PMID 19246206. doi:10.1016/j.apradiso.2009.01.057.
- ^ de Broglie, Louis. „On the Theory of Quanta” (PDF). aflb.ensmp.fr. Pristupljeno 2. 2. 2019.
- ^ Carron, N.J. (2007). An Introduction to the Passage of Energetic Particles Through Matter. str. 308. Bibcode:2007ipep.book.....C.
- ^ „Neutron Energy”. www.nuclear-power.net. Pristupljeno 27. 1. 2019.
- ^ Šablon:Housecroft4th
- ^ Sapphire Lally (24. 7. 2021). „How is gold made? The mysterious cosmic origins of heavy elements”. New Scientist.
- ^ Coc, A.; Olive, K. A.; Uzan, J.-P.; Vangioni, E. (2012). „Variation of fundamental constants and the role of A = 5 and A = 8 nuclei on primordial nucleosynthesis”. Physical Review D. 86 (4): 043529. Bibcode:2012PhRvD..86d3529C. S2CID 119230483. arXiv:1206.1139
 . doi:10.1103/PhysRevD.86.043529.
. doi:10.1103/PhysRevD.86.043529.
- ^ Starrfield, Sumner (27. 5. 2020). „Carbon–Oxygen Classical Novae Are Galactic 7Li Producers as well as Potential Supernova Ia Progenitors”. The Astrophysical Journal. 895 (1): 70. S2CID 203610207. arXiv:1910.00575
 . doi:10.3847/1538-4357/ab8d23
. doi:10.3847/1538-4357/ab8d23  .
.
- ^ Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd izd.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ Meneguzzi, M.; Audouze, J.; Reeves, H. (1971). „The production of the elements Li, Be, B by galactic cosmic rays in space and its relation with stellar observations”. Astronomy and Astrophysics. 15: 337. Bibcode:1971A&A....15..337M.
- ^ Sapphire Lally (24. 7. 2021). „How is gold made? The mysterious cosmic origins of heavy elements”. New Scientist.
- ^ Schaefer, Joerg M.; Codilean, Alexandru T.; Willenbring, Jane K.; Lu, Zheng-Tian; Keisling, Benjamin; Fülöp, Réka-H.; Val, Pedro (2022-03-10). „Cosmogenic nuclide techniques”. Nature Reviews Methods Primers (na jeziku: engleski). 2 (1): 1—22. ISSN 2662-8449. S2CID 247396585. doi:10.1038/s43586-022-00096-9.
- ^ Lal, D.; Peters, B. (1967). „Cosmic Ray Produced Radioactivity on the Earth”. Kosmische Strahlung II / Cosmic Rays II. Handbuch der Physik / Encyclopedia of Physics. 9 / 46 / 2. str. 551—612. ISBN 978-3-642-46081-4. doi:10.1007/978-3-642-46079-1_7.
- ^ Dickin, A.P. (2018). Radiogenic Isotope Geology. Cambridge University Press. doi:10.1017/9781316163009.
- ^ Allaby, Alisa; Michael Allaby (1999). „radiogenic heating”. A Dictionary of Earth Sciences. Pristupljeno 24. 11. 2013.
- ^ Mutter, John C. „The Earth as a Heat Engine”. Introduction to Earth Sciences I. Columbia University. str. 3.2 Mantle convection. Pristupljeno 23. 11. 2013.
- ^ Dumé, Belle (27. 7. 2005). „Geoneutrinos make their debut; Radiogenic heat in the Earth”. Physics World. Institute of Physics. Arhivirano iz originala 07. 05. 2017. g. Pristupljeno 23. 11. 2013.
- ^ „Radioactivity and earth sciences: Understanding the natural environment” (PDF). Pristupljeno 2024-09-24.
- ^ Rohlf, James William (1994). Modern Physics from α to Z°. John Wiley & Sons. str. 20. ISBN 0471572705.
- ^ Eisberg, Robert; Resnick, Robert (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles (2nd izd.). John Wiley & Sons. str. 524. ISBN 047187373X.
- ^ Frisch, David H.; Thorndike, Alan M. (1964). Elementary Particles. Princeton, New Jersey: David Van Nostrand. str. 11—12.
- ^ „20.8: Converting Mass to Energy: Mass Defect and Nuclear Binding Energy”. Chemistry LibreTexts (na jeziku: engleski). 2016-03-11. Pristupljeno 2019-11-05.
- ^ Pourshahian, Soheil (2017-09-01). „Mass Defect from Nuclear Physics to Mass Spectral Analysis”. Journal of the American Society for Mass Spectrometry (na jeziku: engleski). 28 (9): 1836—1843. Bibcode:2017JASMS..28.1836P. ISSN 1879-1123. PMID 28733967. S2CID 34178643. doi:10.1007/s13361-017-1741-9.
- ^ Smith, R. Angus (1856). Memoir of John Dalton and History of the Atomic Theory. London: H. Bailliere. str. 279. ISBN 978-1-4021-6437-8. Arhivirano iz originala 15. 8. 2022. g. Pristupljeno 24. 12. 2007.
- ^ „John Dalton: atoms, eyesight and auroras”. Science and Industry Museum. Arhivirano iz originala 24. 6. 2021. g. Pristupljeno 21. 6. 2021.
- ^ Wieser, M. E (2006). „Atomic weights of the elements 2005 (IUPAC Technical Report)” (PDF). Pure and Applied Chemistry. 78 (11): 2051—2066. S2CID 94552853. doi:10.1351/pac200678112051.
- ^ „IUPAC Goldbook”. Compendium of Chemical Terminology. doi:10.1351/goldbook.S05907
 . Pristupljeno 12. 7. 2019. „standard atomic weights: Recommended values of relative atomic masses of the elements revised biennially by the IUPAC Commission on Atomic Weights and Isotopic Abundances and applicable to elements in any normal sample with a high level of confidence. A normal sample is any reasonably possible source of the element or its compounds in commerce for industry and science and has not been subject to significant modification of isotopic composition within a geologically brief period.”
. Pristupljeno 12. 7. 2019. „standard atomic weights: Recommended values of relative atomic masses of the elements revised biennially by the IUPAC Commission on Atomic Weights and Isotopic Abundances and applicable to elements in any normal sample with a high level of confidence. A normal sample is any reasonably possible source of the element or its compounds in commerce for industry and science and has not been subject to significant modification of isotopic composition within a geologically brief period.”
- ^ Thomas, Andrew (30. 11. 2000). „AMD tests 'super silicon' to beat heat problems”. The Register: Channel. The Register. Pristupljeno 17. 1. 2014.
- ^ Garwin, Richard L. (novembar 1997). „The Technology of Nuclear Weapons”. Arms Control Today. 27 (8): 6—7 — preko Proquest.
- ^ Castell, Lutz (2003). Time, Quantum and Information. Google Books: Springer Science+Business Media. str. 37. ISBN 978-3-642-07892-7.
- ^ „Bruce Heavy Water Plant Decommissioning” (PDF).
- ^ „Heavy Water Board – A unit under Department of Atomic Energy, Govt. of India<”. Arhivirano iz originala 12. 10. 2007. g.
- ^ Rae, H. K. (1978). „Selecting Heavy Water Processes”. Separation of Hydrogen Isotopes. ACS Symposium Series. 68. str. 1—26. ISBN 978-0-8412-0420-1. doi:10.1021/bk-1978-0068.ch001.
- ^ Hanson, James Ralph (2011). The organic chemistry of isotopic labelling. Cambridge: Royal society of chemistry. ISBN 978-1-84973-188-1.
- ^ Blake, Michael E.; Bartlett, Kevin L.; Jones, Maitland (2003). „Am-Benzyne too-Benzyne Conversion through a 1,2-Shift of a Phenyl Group”. Journal of the American Chemical Society. 125 (21): 6485—6490. ISSN 0002-7863. PMID 12785789. doi:10.1021/ja0213672.
- ^ Kruger, Nicholas; Antje von Schaewen (2003). „The oxidative pentose phosphate pathway: structure and organisation” (PDF). Current Opinion in Plant Biology. 6 (3): 236—246. Bibcode:2003COPB....6..236K. PMID 12753973. doi:10.1016/s1369-5266(03)00039-6. Arhivirano iz originala (PDF) 15. 4. 2012. g.
- ^ Nobel, Park S. (7. 2. 2005). Physicochemical and Environmental Plant Physiology. Academic Press. str. 411. ISBN 978-0-12-520026-4.
- ^ Fernandez, Irene; Cadisch, Georg (2003). „Discrimination against13C during degradation of simple and complex substrates by two white rot fungi”. Rapid Communications in Mass Spectrometry. 17 (23): 2614—2620. Bibcode:2003RCMS...17.2614F. ISSN 0951-4198. PMID 14648898. doi:10.1002/rcm.1234.
- ^ Fernandez, I.; Mahieu, N.; Cadisch, G. (2003). „Carbon isotopic fractionation during decomposition of plant materials of different quality”. Global Biogeochemical Cycles. 17 (3): n/a. Bibcode:2003GBioC..17.1075F. ISSN 0886-6236. doi:10.1029/2001GB001834
 .
.
- ^ Farquhar, G D; Ehleringer, J R; Hubick, K T (1989). „Carbon Isotope Discrimination and Photosynthesis”. Annual Review of Plant Physiology and Plant Molecular Biology. 40 (1): 503—537. ISSN 1040-2519. S2CID 12988287. doi:10.1146/annurev.pp.40.060189.002443.
- ^ McCarroll, Danny; Loader, Neil J. (2004). „Stable isotopes in tree rings”. Quaternary Science Reviews. 23 (7–8): 771—801. Bibcode:2004QSRv...23..771M. CiteSeerX 10.1.1.336.2011
 . ISSN 0277-3791. doi:10.1016/j.quascirev.2003.06.017.
. ISSN 0277-3791. doi:10.1016/j.quascirev.2003.06.017.
- ^ Ewe, Sharon M.L; da Silveira Lobo Sternberg, Leonel; Busch, David E (1999). „Water-use patterns of woody species in pineland and hammock communities of South Florida”. Forest Ecology and Management. 118 (1–3): 139—148. Bibcode:1999ForEM.118..139E. ISSN 0378-1127. doi:10.1016/S0378-1127(98)00493-9
 .
.
- ^ Paul D, Skrzypek G, Fórizs I (2007). „Normalization of measured stable isotopic compositions to isotope reference scales - a review”. Rapid Commun. Mass Spectrom. 21 (18): 3006—14. Bibcode:2007RCMS...21.3006P. PMID 17705258. doi:10.1002/rcm.3185.
- ^ Stellaard F, Elzinga H (2005). „Analytical techniques in biomedical stable isotope applications: (isotope ratio) mass spectrometry or infrared spectrometry?”. Isotopes in Environmental and Health Studies. 41 (4): 345—61. PMID 16543190. doi:10.1080/10256010500384333.
- ^ Dickin, A.P. (2005). Radiogenic Isotope Geology. Cambridge University Press. Arhivirano iz originala 2014-03-27. g. Pristupljeno 2008-10-09.
- ^ Jamin, Eric; Guérin, Régis; Rétif, Mélinda; Lees, Michèle; Martin, Gérard J. (2003). „Improved Detection of Added Water in Orange Juice by Simultaneous Determination of the Oxygen-18/Oxygen-16 Isotope Ratios of Water and Ethanol Derived from Sugars”. J. Agric. Food Chem. 51 (18): 5202—6. PMID 12926859. doi:10.1021/jf030167m.
- ^ „First appearance of "isoscapes" at a scientific meeting”.
- ^ „Peer-reviewed article that discusses isoscapes”.
- ^ „Isoscapes to Address Large-Scale Earth Science Challenges”. Eos, transactions, American Geophysical Union. sv. 90 br. 13. 2009. str. 109—116. doi:10.1029/2009EO130001
 .
.
- ^ Dutton, Andrea; Wilkinson, Bruce H.; Welker, Jeffrey M.; Bowen, Gabriel J.; Lohmann, Kyger C. (2005-12-30). „Spatial distribution and seasonal variation in 18 O/ 16 O of modern precipitation and river water across the conterminous USA”. Hydrological Processes (na jeziku: engleski). 19 (20): 4121—4146. S2CID 54706113. doi:10.1002/hyp.5876. hdl:2027.42/49284
 .
.
- ^ Bowen, Gabriel J.; Wassenaar, Leonard I.; Hobson, Keith A. (april 2005). „Global application of stable hydrogen and oxygen isotopes to wildlife forensics”. Oecologia (na jeziku: engleski). 143 (3): 337—348. ISSN 0029-8549. PMID 15726429. S2CID 1762342. doi:10.1007/s00442-004-1813-y.
- ^ Kendall, Carol; Coplen, Tyler B. (maj 2001). „Distribution of oxygen-18 and deuterium in river waters across the United States”. Hydrological Processes (na jeziku: engleski). 15 (7): 1363—1393. ISSN 0885-6087. S2CID 27744095. doi:10.1002/hyp.217.
- ^ Treiman, A. H.; Gleason, J. D.; Bogard, D. D. (2000). „The SNC meteorites are from Mars”. Planet. Space Sci. 48 (12–14): 1213. Bibcode:2000P&SS...48.1213T. doi:10.1016/S0032-0633(00)00105-7.
- ^ „Search results for 'Martian meteorites'”. Meteoritical Bulletin. Meteoritical Society. Pristupljeno 27. 4. 2020.
- ^ Staff (3. 1. 2013). „Researchers Identify Water Rich Meteorite Linked To Mars Crust”. NASA. Arhivirano iz originala 29. 5. 2018. g. Pristupljeno 3. 1. 2013.
- ^ Westaway, Kenneth C. (2006). „Using kinetic isotope effects to determine the structure of the transition states of SN. 2 reactions”. Advances in Physical Organic Chemistry. 41: 217—273. ISBN 978-0-12-033541-1. doi:10.1016/S0065-3160(06)41004-2.
- ^ Poirier RA, Wang Y, Westaway KC (mart 1994). „A Theoretical Study of the Relationship between Secondary .alpha.-Deuterium Kinetic Isotope Effects and the Structure of SN. 2 Transition States”. Journal of the American Chemical Society. 116 (6): 2526—2533. doi:10.1021/ja00085a037.
- ^ Buncel E, Lee CC (1977). Isotopes in cationic reactions
 . Isotopes in Organic Chemistry. 5. Amsterdam: Elsevier. ISBN 978-0-444-41927-9. OCLC 867217247.
. Isotopes in Organic Chemistry. 5. Amsterdam: Elsevier. ISBN 978-0-444-41927-9. OCLC 867217247.
- ^ Melander L, Saunders WH (1980). Reaction Rates of Isotopic Molecules. New York: Wiley.
- ^ Bigeleisen J, Wolfsberg M (januar 1957). „Theoretical and experimental aspects of isotope effects in chemical kinetics.”. Advances in Chemical Physics. 1: 15—76.
- ^ Deegan, Frances M.; Troll, Valentin R.; Whitehouse, Martin J.; Jolis, Ester M.; Freda, Carmela (2016-08-04). „Boron isotope fractionation in magma via crustal carbonate dissolution”. Scientific Reports (na jeziku: engleski). 6 (1): 30774. Bibcode:2016NatSR...630774D. ISSN 2045-2322. PMC 4973271
 . PMID 27488228. doi:10.1038/srep30774.
. PMID 27488228. doi:10.1038/srep30774.
- ^ Oda Y, Huang K, Cross FR, Cowburn D, Chait BT (jun 1999). „Accurate quantitation of protein expression and site-specific phosphorylation”. Proceedings of the National Academy of Sciences of the United States of America. 96 (12): 6591—6596. Bibcode:1999PNAS...96.6591O. PMC 21959
 . PMID 10359756. doi:10.1073/pnas.96.12.6591
. PMID 10359756. doi:10.1073/pnas.96.12.6591  .
.
- ^ Jiang H, English AM (2002). „Quantitative analysis of the yeast proteome by incorporation of isotopically labeled leucine”. Journal of Proteome Research. 1 (4): 345—350. PMID 12645890. doi:10.1021/pr025523f.
- ^ Ong SE, Blagoev B, Kratchmarova I, Kristensen DB, Steen H, Pandey A, Mann M (maj 2002). „Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics”. Molecular & Cellular Proteomics. 1 (5): 376—386. PMID 12118079. doi:10.1074/mcp.M200025-MCP200
 .
.
- ^ Zhu H, Pan S, Gu S, Bradbury EM, Chen X (2002). „Amino acid residue specific stable isotope labeling for quantitative proteomics”. Rapid Communications in Mass Spectrometry. 16 (22): 2115—2123. Bibcode:2002RCMS...16.2115Z. PMID 12415544. doi:10.1002/rcm.831.
- ^ Schoeters F, Van Dijck P (2019). „Protein-Protein Interactions in Candida albicans”. Frontiers in Microbiology. 10: 1792. PMC 6693483
 . PMID 31440220. doi:10.3389/fmicb.2019.01792
. PMID 31440220. doi:10.3389/fmicb.2019.01792  .
.
- ^ M.J.T. Milton; R. I. Wielgosz (2000). „Uncertainty in SI-traceable measurements of amount of substance by isotope dilution mass spectrometry”. Metrologia. 37 (3): 199—206. Bibcode:2000Metro..37..199M. S2CID 250890206. doi:10.1088/0026-1394/37/3/3.
- ^ G. V. Hevesy; F. Paneth (1913). „Die Löslichkeit des Bleisulfids und Bleichromats”. Z. Anorg. Allg. Chem. 82 (1): 323—328. doi:10.1002/zaac.19130820125.
- ^ Walker, L.; Wertheim, G.; Jaccarino, V. „Interpretation of the Fe57 Isomer Shift”. Physical Review Letters. 6 (3): 98. Bibcode:1961PhRvL...6...98W. doi:10.1103/PhysRevLett.6.98.
- ^ Nagy, D. L. (1994). „Trends in Mössbauer emission spectroscopy of 57Co/57Fe”. Hyperfine Interactions. 83 (1): 1—19. Bibcode:1994HyInt..83....1N. S2CID 95685404. doi:10.1007/BF02074255.
- ^ Schröder, Christian. „Mössbauer spectroscopy in astrobiology”. Spectroscopy Europe. 27 (2): 10. Arhivirano iz originala 2018-01-08. g. Pristupljeno 2018-01-08.
- ^ Sarkar, A.; et al. (2007). „Fischer–Tropsch Synthesis: Characterization Rb Promoted Iron Catalyst”. Catalysis Letters. 121 (1–2): 1—11. S2CID 94596943. doi:10.1007/s10562-007-9288-1.
- ^ „Reactors: Modern-Day Alchemy - Argonne's Nuclear Science and Technology Legacy”. www.ne.anl.gov. Pristupljeno 24. 3. 2021.
- ^ Wellerstein, Alex (2008). „Inside the atomic patent office”. Bulletin of the Atomic Scientists. 64 (2): 26—31. Bibcode:2008BuAtS..64b..26W. ISSN 0096-3402. doi:10.2968/064002008.
- ^ „The Einstein Letter”. Atomicarchive.com. Arhivirano iz originala 2013-06-28. g. Pristupljeno 2013-06-22.
- ^ a b Yerramilli D, Xu AJ, Gillespie EF, Shepherd AF, Beal K, Gomez D, et al. (2020-07-01). „Palliative Radiation Therapy for Oncologic Emergencies in the Setting of COVID-19: Approaches to Balancing Risks and Benefits”. Advances in Radiation Oncology (na jeziku: engleski). 5 (4): 589—594. PMC 7194647
 . PMID 32363243. doi:10.1016/j.adro.2020.04.001.
. PMID 32363243. doi:10.1016/j.adro.2020.04.001.
- ^ Rades D, Stalpers LJ, Veninga T, Schulte R, Hoskin PJ, Obralic N, et al. (maj 2005). „Evaluation of five radiation schedules and prognostic factors for metastatic spinal cord compression”. Journal of Clinical Oncology. 23 (15): 3366—3375. PMID 15908648. doi:10.1200/JCO.2005.04.754.
- ^ Rades D, Panzner A, Rudat V, Karstens JH, Schild SE (novembar 2011). „Dose escalation of radiotherapy for metastatic spinal cord compression (MSCC) in patients with relatively favorable survival prognosis”. Strahlentherapie und Onkologie. 187 (11): 729—735. PMID 22037654. S2CID 19991034. doi:10.1007/s00066-011-2266-y.
- ^ Rades D, Šegedin B, Conde-Moreno AJ, Garcia R, Perpar A, Metz M, et al. (februar 2016). „Radiotherapy With 4 Gy × 5 Versus 3 Gy × 10 for Metastatic Epidural Spinal Cord Compression: Final Results of the SCORE-2 Trial (ARO 2009/01)”. Journal of Clinical Oncology. 34 (6): 597—602. PMID 26729431. doi:10.1200/JCO.2015.64.0862
 .
.
Literatura
[uredi | uredi izvor]- Various (2002). Lide, David R., ur. Handbook of Chemistry & Physics (88th izd.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Arhivirano iz originala 2017-07-24. g. Pristupljeno 2008-05-23.
- Belli, P.; Bernabei, R.; Danevich, F. A.; et al. (2019). „Experimental searches for rare alpha and beta decays”. European Physical Journal A. 55 (8): 140—1—140—7. Bibcode:2019EPJA...55..140B. ISSN 1434-601X. S2CID 201664098. arXiv:1908.11458
 . doi:10.1140/epja/i2019-12823-2.
. doi:10.1140/epja/i2019-12823-2. - Various (2002). Lide, David R., ur. Handbook of Chemistry & Physics (88th izd.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Arhivirano iz originala 2017-07-24. g. Pristupljeno 2008-05-23.
- Kelkar, N. G.; Nowakowski, M. (2016). „Signature of the N = 126 shell closure in dwell times of alpha-particle tunneling”. Journal of Physics G: Nuclear and Particle Physics. 43 (105102). arXiv:1610.02069
 . doi:10.1088/0954-3899/43/10/105102.
. doi:10.1088/0954-3899/43/10/105102. - Marcillac, Pierre de; Noël Coron; Gérard Dambier; Jacques Leblanc; Jean-Pierre Moalic (2003). „Experimental detection of α-particles from the radioactive decay of natural bismuth”. Nature. 422 (6934): 876—878. Bibcode:2003Natur.422..876D. PMID 12712201. S2CID 4415582. doi:10.1038/nature01541.
- de Carvalho H. G.; de Araújo Penna M. (1972). „Alpha-activity of 209. Bi”. Lett. Nuovo Cimento. 3 (18): 720—722. doi:10.1007/BF02824346.
- Blank, B.; Regan, P.H. (2000). „Magic and doubly-magic nuclei”. Nuclear Physics News. 10 (4): 20—27. S2CID 121966707. doi:10.1080/10506890109411553.
- A. Yu. Smirnov; V. D. Borisevich; A. Sulaberidze (jul 2012). „Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials”. Theoretical Foundations of Chemical Engineering. 46 (4): 373—378. S2CID 98821122. doi:10.1134/S0040579512040161.
- Mcclain, D. E.; Miller, A. C.; Kalinich, J. F. (20. 12. 2007). „Status of Health Concerns about Military Use of Depleted Uranium and Surrogate Metals in Armor-Penetrating Munitions” (PDF). NATO. Arhivirano iz originala (PDF) 19. 4. 2011. g. Pristupljeno 14. 11. 2010.
- Arevalo, Ricardo; McDonough, William F.; Luong, Mario (2009). „The K-U ratio of the silicate Earth: Insights into mantle composition, structure and thermal evolution”. Earth and Planetary Science Letters. 278 (3–4): 361—369. Bibcode:2009E&PSL.278..361A. doi:10.1016/j.epsl.2008.12.023.
- „Radiation and Radioactive Decay. Radioactive Human Body”. Harvard Natural Sciences Lecture Demonstrations. Pristupljeno 2. 7. 2016.
- Winteringham, F. P. W; Effects, F.A.O. (1989). Radioactive fallout in soils, crops and food: a background review. Standing Committee on Radiation, Land And Water Development Division, Food and Agriculture Organization of the United Nations. Food & Agriculture Org. str. 32. ISBN 978-92-5-102877-3.
- P. Mohr; F. Kaeppeler; R. Gallino (2007). „Survival of Nature's Rarest Isotope 180Ta under Stellar Conditions”. Phys. Rev. C. 75: 012802. S2CID 44724195. arXiv:astro-ph/0612427
 . doi:10.1103/PhysRevC.75.012802.
. doi:10.1103/PhysRevC.75.012802. - Planck Collaboration (2016). „Planck 2015 results. XIII. Cosmological parameters (See Table 4 on page 31 of pfd).”. Astronomy & Astrophysics. 594: A13. Bibcode:2016A&A...594A..13P. S2CID 119262962. arXiv:1502.01589
 . doi:10.1051/0004-6361/201525830.
. doi:10.1051/0004-6361/201525830. - Dvornický, R.; Šimkovic, F. „Second unique forbidden β decay of 115In and neutrino mass”. AIP Conf. Proc. AIP Conference Proceedings. 1417 (33): 33. Bibcode:2011AIPC.1417...33D. doi:10.1063/1.3671032.
- Bosch, F.; Faestermann, T.; Friese, J.; et al. (1996). „Observation of bound-state β− decay of fully ionized 187Re: 187Re-187Os Cosmochronometry”. Physical Review Letters. 77 (26): 5190—5193. Bibcode:1996PhRvL..77.5190B. PMID 10062738. doi:10.1103/PhysRevLett.77.5190.
- Belli, P.; et al. (2007). „Search for α decay of natural europium”. Nuclear Physics A. 789 (1–4): 15—29. Bibcode:2007NuPhA.789...15B. doi:10.1016/j.nuclphysa.2007.03.001.
- Casali, N.; Nagorny, S. S.; Orio, F.; Pattavina, L.; et al. „Discovery of the 151Eu α decay”. Journal of Physics G: Nuclear and Particle Physics. 41 (7): 075101. Bibcode:2014JPhG...41g5101C. S2CID 116920467. arXiv:1311.2834
 . doi:10.1088/0954-3899/41/7/075101.
. doi:10.1088/0954-3899/41/7/075101. - Dumé, Belle (2003-04-23). „Bismuth breaks half-life record for alpha decay”. Physicsweb.
Spoljašnje veze
[uredi | uredi izvor]- Atomske težine svih izotopa
- The Nuclear Science web portal Nucleonica
- The Karlsruhe Nuclide Chart
- National Nuclear Data Center Portal to large repository of free data and analysis programs from NNDC
- National Isotope Development Center Coordination and management of the production, availability, and distribution of isotopes, and reference information for the isotope community
- Isotope Development & Production for Research and Applications (IDPRA) U.S. Department of Energy program for isotope production and production research and development
- International Atomic Energy Agency Homepage of International Atomic Energy Agency (IAEA), an Agency of the United Nations (UN)
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope
- Exploring the Table of the Isotopes at the LBNL
- Current isotope research and information isotope.info
- Emergency Preparedness and Response: Radioactive Isotopes by the CDC (Centers for Disease Control and Prevention)
- Chart of Nuclides Arhivirano 2018-10-10 na sajtu Wayback Machine Interactive Chart of Nuclides (National Nuclear Data Center)
- Interactive Chart of the nuclides, isotopes and Periodic Table Arhivirano 2008-09-30 na sajtu Wayback Machine
- The LIVEChart of Nuclides – IAEA with isotope data.
- Annotated bibliography for isotopes from the Alsos Digital Library for Nuclear Issues
- The Valley of Stability (video) – a virtual "flight" through 3D representation of the nuclide chart, by CEA (France)


