Hemijski element
 | |
 | |
  | |
  | |
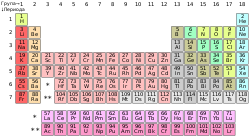
| gore: Periodni sistem hemijskih elemenata. ispod: primeri određenih hemijskih elemenata. Sleva nadesno: vodonik, barijum, bakar, uranijum, brom i helijum. |
Hemijski element je vrsta čiste hemijske supstance koja se ne može podeliti na dve ili više čiste supstance običnim hemijskim metodama.[1] Hemijski elementi se sastoje od samo jedne vrste atoma, koji se razlikuju po svom atomskom broju, tj. broju protona u atomskom jezgru.[2] Elementi se dele na metale, metaloide i nemetale. Najpoznatiji primeri hemijskih elemenata su ugljenik, azot, kiseonik, silicijum, arsen, aluminijum, gvožđe, bakar, zlato, živa i olovo.
Najlakši hemijski elementi, među kojima su vodonik, helijum i manje količine litijuma, berilijuma i bora, nastali su različitim kosmičkim procesima tokom Velikog praska i delovanjem kosmičkih zraka. Nastanak težih elemenata, počev od ugljenika do najtežih elemenata, desio se putem nukleosinteze u zvezdama, a pri nastanku Sunčevog sistema i formiranjem njegovog planetarnog sistema iz planetarnih maglina i supernova, koje su izbacivale ove elemente u svemir.[3][4]
Velika rasprostranjenost kiseonika, silicijuma i gvožđa za Zemlji odaje njihovo zajedničko poreklo u takvim zvezdama. Dok je većina elemenata uglavnom stabilno, postoji mali broj prirodnih nuklearnih transformacija iz jednog elementa u drugi, a koje se takođe dešavaju pri raspadu radioaktivnih elemenata kao i u drugim prirodnim nuklearnim procesima.[5]
Danas je poznato 118 elemenata, od čega se 91 hemijski element može naći u prirodi, a ostali su proizvedeni u laboratoriji. U hemiji, svaki element ima svoj jedinstveni hemijski simbol. On se sastoji iz jednog ili dva slova, obično izvedena iz imena tog elementa. Na primer simbol za ugljenik (karbon) je C, dok je simbol za aluminijum Al. Ponekad su simboli izvedeni iz latinskih imena elemenata ili iz nekog njegovog jedinjenja.[6]
Deljenjem materije (u idealnom slučaju) došli bi do atoma tog hemijskog elementa.
Istorija otkrića
[uredi | uredi izvor]Pojam hemijskog elementa nastao je tokom 17. veka, nakon što je sve više postajalo jasno, da pojam elementa iz alhemije nije pogodan za naučno objašnjenje raznovrsnosti osobina supstanci i njihovih reakcija.[7] Jedan značajan iskorak učinio je Etienne de Klav koji je 1641. dao definiciju elemenata kao najjednostavnijih supstanci od čijih su mešavina sastavljena jedinjenja i čija se jedinjenja mogu ponovno razložiti na te supstance. Robert Bojl je 1661. objavio rad pod naslovom The Sceptical Chymist vrlo uticajnu kritiku nedostataka alhemije. Osim toga, dalje je naveo da pod pojmom hemijskog elementa treba podrazumevati primitivne supstance, koje nisu nastale iz drugih supstanci ili jedni iz drugih, već čine osnovne sastojke iz kojih se sastoje mešane supstance.
Oba naučnika su se tako postavila nasuprot tada vladajućeg učenja alhemičara o četiri elementa, po kojem su sve supstance zapravo nastale različitim mešanjem vatre, vode, vazduha i zemlje, te su tako učinile pojam elementa opšte bližim eksperimentalnom naučnom istraživanju. Međutim i pored naprednog razmišljanja, i dalje su ostali „verni“ alhemiji, jer su smatrali da takvi elementi u prirodi ne postoje, jer je istovremeno svaka realna supstanca istovremeno i mešavina određenih elemenata. Bojle je izražavao sumnju da takvih elemenata uopšte ima. Potpuno u duhu tada važeće mehanike, on je zauzimao stav da supstance koje naoko izgledaju monolitno, zapravo se sastoje iz mnogo sićušnih istovrsnih delića (korpuskula), a koje se dalje opet mogu deliti na još sitnije. Takođe je objašnjavao raznovrsnost supstanci i njihovih reakcija preko bezbrojnih načina u kojima ovi sićušni delići mogu spajati karakteristično različito za svaku supstancu. Kao rezultat takvog mišljenja, smatrao je mogućom takozvanu transmutaciju u alhemiji kojom bi se takvi delići supstance mogli presložiti iz jednog elementa (npr. olova) u drugi (npr. zlato).
Ipak, Bojl je na taj način pripremio put za istraživanja Lavoazjea, koji je odbacio teoriju delića (korpuskula) kao metafizičku spekulaciju, ali je već 1789. u svoju definiciju hemijskog elementa ugradio njihovu osobinu da se oni ne mogu razložiti u druge supstance. Preciznije, svi materijali bi trebalo da budu svrstani u elemente, osim ako ne postoji otkrivena metoda za dalje odvajanje pojedinih komponenti.[8]
Na osnovu ove definicije, Lavoazje je započeo izuzetno precizna posmatranja hemijskih i fizičkih transformacija materijala u modernoj hemiji. Posebno se ističe njegovo otkriće zakona o očuvanju ukupne mase svih transformacija supstanci i utvrdio tačan maseni odnos u kojem čisti elementi reagiraju jedan s drugim. Tako je i Džon Dalton izveo i zakon o umnoženim proporcijama, te 1803. naučno mogao potvrditi postojanje nepromenjivih i neuništivih najmanjih čestica materije, atoma. Prema Daltonu, element je definisan kao uniformni skup istovrsnih atoma koji se mogu spajati sa drugim atomima prema stalnim, nepromenjivim pravilima. Različito ponašanje elemenata je objašnjavano činjenicom da se atomi razlikuju po svojoj masi, veličini i mogućnosti spajanja sa drugim atomima. Iz toga je proizašla mogućnost da se odrede atomske mase različitih elemenata (barem odnos jednih prema drugim), te su atomi po prvi put postali predmet proučavanja eksperimentalne nauke.
Otkrića elemenata
[uredi | uredi izvor]

Od antičkih vremena pa sve do srednjeg veka ljudi su živeli u uverenju, da se svet sastoji iz četiri elementa: zemlje, vode, vazduha i vatre.
Od elemenata u današnjem smislu te reči u antici je bilo poznato samo njih nekoliko u čistom obliku, koji su se dobijali istopljeni iz ruda ili su pronađeni samorodni: ugljenik, sumpor, gvožđe, bakar, cink, srebro, kalaj, zlato, živa i olovo.
U toku srednjovjekovne istorije rudarstva, naročito u nemačkim Rudnim gorama, pronađene su rude koje su sadržavale male primese do tad nepoznatih metala a koji su dobili imena po duhovima iz rudnika: kobalt, nikl i volfram. Henig Brand otkrio je 1669. fosfor čime je započelo doba otkrivanja većine elemenata, te zaključno sa 1789. godinu kada je Klaprot otkrio uranijum u rudi uranitu.
Od 1751. bili su poznati sledeći prelazni elementi: gvožđe, kobalt, nikl, bakar, cink, srebro, platina, zlato i živa, te elementi glavne grupe periodnog sistema ugljenik, fosfor, sumpor, arsen, kalaj, antimon, olovo i bizmut.[9]
Nakon 1751. pa sve do 1800. pronađeni su i vodonik, titanijum, hrom, mangan, itrijum, cirkonijum, molibden, volfram, uranijum, a kasnije i azot, kiseonik, hlor i telur.[10]
U periodu od 1800. do 1830. otkrivena su ukupno 22 nova elemente i to iz sporedne grupe elemenata: vanadijum, tantal, rodijum, paladijum, kadmijum, osmijum, iridijum te metal iz grupe retkih zemalja torijum, kao i elementi iz glavne grupe: litijum, berilijum, natrijum, magnezijum, kalijum, kalcijum, stroncijum, barijum, bor, aluminijum, silicijum, selen, jod i brom.[11]
Daljnih 11 elemenata otkriveno je u periodu između 1830. i 1869. godine. Oni su takođe bili i određena prekretnica u tehničko-naučnom stanju razvoja, kojom je postignuto otkriće i opis nekih vrlo retkih elemenata koje je do tada bilo vrlo teško ili gotovo nemoguće naći. Bili su to helijum, rubidijum, cezijum, indijum, talijum, niobijum, rutenijum, kao i lantan, cerijum, terbijum i erbijum.[12]
Podela elemenata
[uredi | uredi izvor]Elementi se mogu podjeliti na metale i nemetale. Metali su obično sjajne čvrste materije koje provode elektricitet. Većina metala se topi na visokim temperaturama. Metali su kovni, što znači da se kovanjem mogu oblikovati u različite oblike. Mnogi su takođe istegljivi, što znači da se mogu rastezati bez lomova. Gvožđe, bakar, cink i uranijum su primeri metala. Uz izuzetak grafita - oblika ugljenika - nemetali ne provode elektricitet. Nemetali u čvrstom stanju, kao što su sumpor i fosfor, krti su (kod udaraca se raspadaju na delove). Mnogi se nemetali tope kod mnogo nižih temperatura od metala; mnogi su na sobnoj temperaturi u plinovitom stanju. Hlor, vodonik i kiseonik su nemetali. U prirodi postoje 92 elementa. Izuzev helijuma i neona, svi se mogu s drugim elementima spajati u jedinjenja. Za rastavljanje hemijskih jedinjenja i oslobađanje elemenata koje sadržavaju se koriste hemijske reakcije.
Nazivi i oznake
[uredi | uredi izvor]Za označavanje elemenata hemičari koriste oznake sastavljene od jednog ili dvaju slova. Prvo je slovo uvek veliko, a drugo slovo je uvek malo. Na primer, oznake za vodonik i cink su H i Zn. Elementi koji su otkriveni pre 1800-te godine često su nazivani latinskim imenima. Rimljani su olovo zvali plumbum, a koristili su ga za izradu cevi za vodu. Od latinskog imena dolazi oznaka Pb i takođe pokazuje korene engleskih reči plumber (vodoinstalater) i plumbing (vodoinstalaterstvo). Elementi iz grupe metala koji su otkriveni naknadno, i često imaju imena koja završavaju na -ium. Na primer plutonijum je otkriven je 1940.
Atomski broj i masa
[uredi | uredi izvor]Atomski broj elementa, Z, je jednak broju protona u elementu. Na primer, ugljenik, element sa atomskim brojem 6, sadrži 6 protona u svom jezgru (nukleusu). Svi atomi datog elementa imaju isti atomski broj i sadrže isti broj protona. Ipak, atomi istog elementa mogu imati različit broj neutrona, i zovu se izotopi tog elementa. Atomska masa elementa, A, se meri u jedinicama atomske mase (amu) i otprilike je jednaka zbiru protona i neutrona datog elementa. Neki elementi su radioaktivni i podležu radioaktivnom raspadu, menjajući se u drugi element.[13]
Periodni sistem
[uredi | uredi izvor]Ima 118 poznatih elemenata, od kojih se samo 94 javlja u prirodi. Ostalih 24 je napravio čovek; prvi takav element je tehnicijum, otkriven 1937. Svi elementi koje je čovek napravio su radioaktivni sa kratkim vremenom poluraspada tako da ako je neki od njih i postojao pri nastanku Zemlje, davno se raspao.
Postoje spiskovi elemenata po imenu, po simbolu, i po atomskom broju. Ipak, najzgodnije predstavljanje elemenata je putem periodnog sistema elemenata, koji grupiše elemente sa sličnim hemijskim svojstvima.
Zvanična imena hemijskih elemenata dodeljuje Međunarodna unija za čistu i primenjenu hemiju (IUPAC - ajupak), koja obično prihvata ime koje izabere pronalazač. Ovo može da dovede do kontroverznih pitanja o tome koja je istraživačka grupa stvarno otkrila element, što je za relativno dugo vremena odložilo dodeljivanje imena elementima sa atomskim brojem 104 i više. (vidi kontroverza o imenima hemijskih elemenata) Hemijskim elementima se takođe dodeljuje jedinstveni hemijski simbol, baziran na imenu elementa na latinskom jeziku. (Na primer, hemijski simbol ugljenika ima simbol C (lat. carboneum), a natrijum ima hemijski simbol Na od lat. natrium). Hemijski simboli važe svuda u svetu iako se imena elemenata često prevode. Prvo slovo hemijskog simbola je uvek veliko, kao u datim primerima.
Izotopi
[uredi | uredi izvor]Atomi istog elementa čija jezgra sadrže različit broj neutrona su različiti izotopi tog elementa. Čist element može postojati u monoatomskim jedinicama, u dvoatomskim ili poliatomskim jedinicama koje sadržavaju istu vrstu atoma. Ove jedinice se zovu alotropi, bez obzira na stanje.
Veštački elementi
[uredi | uredi izvor]Svemir se sastoji uglavnom od vodonika (90%) i helijuma (9%). Ogromni pritisci i temperature u unutrašnjosti zvezda kao što je npr. Sunce uzrokuju nuklearne reakcije koje pretvaraju vodonik u helijum. Dalje nuklearne reakcije spajaju vodonik i helijum zajedno uz formiranje težih elemenata. Zemlja je nastala od tih elemenata kada su se odvojili delovi Sunca. Naučnici koriste nuklearne reakcije za proizvodnju teških, veštačkih elemenata iz prirodnih elemenata. Ovi veštački elementi su toliko nestabilni da se raspadaju ili razdvajaju, često u minutima ili čak sekundama.
Jedinjenja i legure
[uredi | uredi izvor]Elementi mogu da se kombinuju (da reaguju) stvarajući čista jedinjenja (kao na primer vodu, so, okside i organska jedinjenja). U mnogim slučajevima ova jedinjenja imaju esencijalno jedan fiksiran stehiometrijski sastav, svoju strukturu i svojstva.
Neki elementi, pogotovo metali, se kombinuju, stvarajući nove strukture promenljivijih sastava (npr. metalne legure). U tim slučajevima je bolje govoriti o fazama nego o jedinjenjima.
Spisak 118 poznatih hemijskih elemenata
[uredi | uredi izvor]Sledeća tabela sadrži 118 poznatih hemijskih elemenata.
- Atomski broj, ime, i simbol služe nezavisno kao jedinstveni identifikatori.
- Imena su ona koja su prihvaćena od strane IUPAC; провизиона имена за недавно произведене елементе који нису формално именовани су дата у заградама.
- Група, периода, и блок се односе на позицију елемента у периодном систему. Бројеви група су у тренутно званично прихваћеној нотацији; за старије алтернативне нотације погледајте Група периодног система елемената.
- Stanje materije (Čvrsto, tečno, ili gasovito) se odnosi na standardne uslove temperature i pritiska (STP).
- Pojavljivanje pravi razliku između elemenata koji se javljaju u prirodi, kategorisane kao bilo Praiskonski ili Prolazni (u smislu raspada), i Sintetički elementi koji su proizvedeni tehnološkim putem, i nisu prirodno poznati.
- Opis sumira svojstva elementa koristeći opširne kategorije koje su prisutne u periodnom sistemu: aktinoid, alkalni metal, zemnoalkalni metal, halogen, lantanoid, metal, metaloid, plemeniti gas, nemetal, i prelazni metal.
| Атомски бр. |
Име | Симбол | Група | Периода | Блок | Стање при СТП |
Појављивање | Опис |
|---|---|---|---|---|---|---|---|---|
| 1 | Водоник | H | 1 | 1 | s | Gas | Praiskonski | Nemetal |
| 2 | Helijum | He | 18 | 1 | s | Gas | Praiskonski | Plemeniti gas |
| 3 | Litijum | Li | 1 | 2 | s | Čvrst | Praiskonski | Alkalni metal |
| 4 | Berilijum | Be | 2 | 2 | s | Čvrst | Praiskonski | Zemnoalkalni metal |
| 5 | Bor | B | 13 | 2 | p | Čvrst | Praiskonski | Metaloid |
| 6 | Ugljenik | C | 14 | 2 | p | Čvrst | Praiskonski | Nemetal |
| 7 | Azot | N | 15 | 2 | p | Gas | Praiskonski | Nemetal |
| 8 | Kiseonik | O | 16 | 2 | p | Gas | Praiskonski | Nemetal |
| 9 | Fluor | F | 17 | 2 | p | Gas | Praiskonski | Halogen |
| 10 | Neon | Ne | 18 | 2 | p | Gas | Praiskonski | Plemeniti gas |
| 11 | Natrijum | Na | 1 | 3 | s | Čvrst | Praiskonski | Alkalni metal |
| 12 | Magnezijum | Mg | 2 | 3 | s | Čvrst | Praiskonski | Zemnoalkalni metal |
| 13 | Aluminijum | Al | 13 | 3 | p | Čvrst | Praiskonski | Metal |
| 14 | Silicijum | Si | 14 | 3 | p | Čvrst | Praiskonski | Metaloid |
| 15 | Fosfor | P | 15 | 3 | p | Čvrst | Praiskonski | Nemetal |
| 16 | Sumpor | S | 16 | 3 | p | Čvrst | Praiskonski | Nemetal |
| 17 | Hlor | Cl | 17 | 3 | p | Gas | Praiskonski | Halogen |
| 18 | Argon | Ar | 18 | 3 | p | Gas | Praiskonski | Plemeniti gas |
| 19 | Kalijum | K | 1 | 4 | s | Čvrst | Praiskonski | Alkalni metal |
| 20 | Kalcijum | Ca | 2 | 4 | s | Čvrst | Praiskonski | Zemnoalkalni metal |
| 21 | Skandijum | Sc | 3 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 22 | Titanijum | Ti | 4 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 23 | Vanadijum | V | 5 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 24 | Hrom | Cr | 6 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 25 | Mangan | Mn | 7 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 26 | Gvožđe | Fe | 8 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 27 | Kobalt | Co | 9 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 28 | Nikal | Ni | 10 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 29 | Bakar | Cu | 11 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 30 | Cink | Zn | 12 | 4 | d | Čvrst | Praiskonski | Prelazni metal |
| 31 | Galijum | Ga | 13 | 4 | p | Čvrst | Praiskonski | Metal |
| 32 | Germanijum | Ge | 14 | 4 | p | Čvrst | Praiskonski | Metaloid |
| 33 | Arsen | As | 15 | 4 | p | Čvrst | Praiskonski | Metaloid |
| 34 | Selen | Se | 16 | 4 | p | Čvrst | Praiskonski | Nemetal |
| 35 | Brom | Br | 17 | 4 | p | Tečnost | Praiskonski | Halogen |
| 36 | Kripton | Kr | 18 | 4 | p | Gas | Praiskonski | Plemeniti gas |
| 37 | Rubidijum | Rb | 1 | 5 | s | Čvrst | Praiskonski | Alkalni metal |
| 38 | Stroncijum | Sr | 2 | 5 | s | Čvrst | Praiskonski | Zemnoalkalni metal |
| 39 | Itrijum | Y | 3 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 40 | Cirkonijum | Zr | 4 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 41 | Niobijum | Nb | 5 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 42 | Molibden | Mo | 6 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 43 | Tehnecijum | Tc | 7 | 5 | d | Čvrst | Prolazan | Prelazni metal |
| 44 | Rutenijum | Ru | 8 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 45 | Rodijum | Rh | 9 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 46 | Paladijum | Pd | 10 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 47 | Srebro | Ag | 11 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 48 | Kadmijum | Cd | 12 | 5 | d | Čvrst | Praiskonski | Prelazni metal |
| 49 | Indijum | In | 13 | 5 | p | Čvrst | Praiskonski | Metal |
| 50 | Kalaj | Sn | 14 | 5 | p | Čvrst | Praiskonski | Metal |
| 51 | Antimon | Sb | 15 | 5 | p | Čvrst | Praiskonski | Metaloid |
| 52 | Telur | Te | 16 | 5 | p | Čvrst | Praiskonski | Metaloid |
| 53 | Jod | I | 17 | 5 | p | Čvrst | Praiskonski | Halogen |
| 54 | Ksenon | Xe | 18 | 5 | p | Gas | Praiskonski | Plemeniti gas |
| 55 | Cezijum | Cs | 1 | 6 | s | Čvrst | Praiskonski | Alkalni metal |
| 56 | Barijum | Ba | 2 | 6 | s | Čvrst | Praiskonski | Zemnoalkalni metal |
| 57 | Lantan | La | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 58 | Cerijum | Ce | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 59 | Prazeodijum | Pr | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 60 | Neodijum | Nd | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 61 | Prometijum | Pm | 3 | 6 | f | Čvrst | Prolazan | Lantanoid |
| 62 | Samarijum | Sm | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 63 | Europijum | Eu | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 64 | Gadolinijum | Gd | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 65 | Terbijum | Tb | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 66 | Disprozijum | Dy | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 67 | Holmijum | Ho | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 68 | Erbijum | Er | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 69 | Tulijum | Tm | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 70 | Iterbijum | Yb | 3 | 6 | f | Čvrst | Praiskonski | Lantanoid |
| 71 | Lutecijum | Lu | 3 | 6 | d | Čvrst | Praiskonski | Lantanoid |
| 72 | Hafnijum | Hf | 4 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 73 | Tantal | Ta | 5 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 74 | Volfram | W | 6 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 75 | Renijum | Re | 7 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 76 | Osmijum | Os | 8 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 77 | Iridijum | Ir | 9 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 78 | Platina | Pt | 10 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 79 | Zlato | Au | 11 | 6 | d | Čvrst | Praiskonski | Prelazni metal |
| 80 | Živa | Hg | 12 | 6 | d | Tečnost | Praiskonski | Prelazni metal |
| 81 | Talijum | Tl | 13 | 6 | p | Čvrst | Praiskonski | Metal |
| 82 | Olovo | Pb | 14 | 6 | p | Čvrst | Praiskonski | Metal |
| 83 | Bizmut | Bi | 15 | 6 | p | Čvrst | Praiskonski | Metal |
| 84 | Polonijum | Po | 16 | 6 | p | Čvrst | Prolazan | Metal |
| 85 | Astat | At | 17 | 6 | p | Čvrst | Prolazan | Halogen |
| 86 | Radon | Rn | 18 | 6 | p | Gas | Prolazan | Plemeniti gas |
| 87 | Francijum | Fr | 1 | 7 | s | Čvrst | Prolazan | Alkalni metal |
| 88 | Radijum | Ra | 2 | 7 | s | Čvrst | Prolazan | Zemnoalkalni metal |
| 89 | Aktinijum | Ac | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 90 | Torijum | Th | 3 | 7 | f | Čvrst | Praiskonski | Aktinoid |
| 91 | Protaktinijum | Pa | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 92 | Uranijum | U | 3 | 7 | f | Čvrst | Praiskonski | Aktinoid |
| 93 | Neptunijum | Np | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 94 | Plutonijum | Pu | 3 | 7 | f | Čvrst | Praiskonski | Aktinoid |
| 95 | Americijum | Am | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 96 | Kirijum | Cm | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 97 | Berklijum | Bk | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 98 | Kalifornijum | Cf | 3 | 7 | f | Čvrst | Prolazan | Aktinoid |
| 99 | Ajnštajnijum | Es | 3 | 7 | f | Čvrst | Sintetički | Aktinoid |
| 100 | Fermijum | Fm | 3 | 7 | f | Sintetički | Aktinoid | |
| 101 | Mendeljevijum | Md | 3 | 7 | f | Sintetički | Aktinoid | |
| 102 | Nobelijum | No | 3 | 7 | f | Sintetički | Aktinoid | |
| 103 | Lorencijum | Lr | 3 | 7 | d | Sintetički | Aktinoid | |
| 104 | Raderfordijum | Rf | 4 | 7 | d | Sintetički | Prelazni metal | |
| 105 | Dubnijum | Db | 5 | 7 | d | Sintetički | Prelazni metal | |
| 106 | Siborgijum | Sg | 6 | 7 | d | Sintetički | Prelazni metal | |
| 107 | Borijum | Bh | 7 | 7 | d | Sintetički | Prelazni metal | |
| 108 | Hasijum | Hs | 8 | 7 | d | Sintetički | Prelazni metal | |
| 109 | Majtnerijum | Mt | 9 | 7 | d | Sintetički | ||
| 110 | Darmštatijum | Ds | 10 | 7 | d | Sintetički | ||
| 111 | Rentgenijum | Rg | 11 | 7 | d | Sintetički | ||
| 112 | Kopernicijum | Cn | 12 | 7 | d | Sintetički | Prelazni metal | |
| 113 | Nihonijum | Nh | 13 | 7 | p | Sintetički | ||
| 114 | Flerovijum | Fl | 14 | 7 | p | Sintetički | ||
| 115 | Moskovijum | Mc | 15 | 7 | p | Sintetički | ||
| 116 | Livermorijum | Lv | 16 | 7 | p | Sintetički | ||
| 117 | Tenesin | Ts | 17 | 7 | p | Sintetički | ||
| 118 | Oganeson | Og | 18 | 7 | p | Sintetički |
Vidi još
[uredi | uredi izvor]- Otkrića hemijskih elemenata
- Rasprostranjenost hemijskih elemenata
- Hemijski elementi nazvani po ljudima
- Hemijski elementi nazvani po mestima
- Jedinjenje
- Hemijski simbol
- Periodni sistem elemenata
Reference
[uredi | uredi izvor]- ^ William L. Masterton, Cecile N. Hurley, Edward J. Neth : Chemistry: Principles and Reactions, 7. izd., Brooks/Cole, Cengage Learning. Masterton, William L.; Hurley, Cecile N.; Neth, Edward (2012). Chemistry: Principles and Reactions. Cengage Learning. str. 2. ISBN 978-1-111-42710-8.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). „Synthesis of the Elements in Stars”. Reviews of ModernPhysics. 29 (4): 547—650.}
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). „Synthesis of the Elements in Stars”. Reviews of Modern Physics. 29 (4): 547—650. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ^ Oerter 2006, str. 223.
- ^ Los Alamos National Laboratory (2011). „Periodic Table of Elements: Oxygen”. Los Alamos, New Mexico: Los Alamos National Security, LLC. Pristupljeno 7. 5. 2011.
- ^ Boas 1958
- ^ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1992.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim prije 1751.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1800.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1830.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1869.
- ^ Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
Literatura
[uredi | uredi izvor]- Boas, Marie (1958). Robert Boyle and the seventeenth century chemistry. Cambridge: Cambridge University Press. ISBN 978-0527092504.
- Oerter, Robert (2006). The Theory of Almost Everything: The Standard Model, the Unsung Triumph of Modern Physics. Penguin. str. 223. ISBN 978-0-452-28786-0.
- Ball, P (2004). The Elements: A Very Short Introduction. Oxford University Press. ISBN 978-0-19-284099-8.
- Emsley, J (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-850340-8.
- Gray, T (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers Inc. ISBN 978-1-57912-814-2.
- Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- Scerri, ER (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press.
- Strathern, P (2000). Mendeleyev's Dream: The Quest for the Elements. Hamish Hamilton Ltd. ISBN 978-0-241-14065-9.
- Kean, Sam (2011). The Disappearing Spoon: And Other True Tales of Madness, Love, and the History of the World from the Periodic Table of the Elements. Back Bay Books. ISBN 9780316051637.
- Gray, Theodore (2009). Die Elemente: Bausteine unserer Welt. Köln: Fackelträger-Verlag. ISBN 978-3771644352.
- Rauchhaupt, Ulf von (2009). Die Ordnung der Stoffe: Ein Streifzug durch die Welt der chemischen Elemente. Frankfurt am Main: Fischer-Taschenbuch-Verlag. ISBN 978-3-596-18590-0.
- Lucien F. Trueb: Die chemischen Elemente – Ein Streifzug durch das Periodensystem. . Die chemischen Elemente: Ein Streifzug durch das Periodensystem. Stuttgart: S. Hirzel Verlag. 2005. ISBN 978-3-7776-1356-7.
- Binder, Harry H. (1999). Lexikon der chemischen Elemente: Das Periodensystem in Fakten, Zahlen und Daten. Stuttgart: S. Hirzel Verlag. ISBN 978-3-7776-0736-8.
- Alexander C. Wimmer: Die chemischen Elemente.. SMT, Leoben. Wimmer, Alexander C. (2011). Die chemischen Elemente. ISBN 978-3-2000-2434-2.
- Mendeleev D. I.,. Эlementы himičeskie // Эnciklopedičeskiй slovarь Brokgauza i Efrona: V 86 tomah (82 t. i 4 dop.). — SPb., 1890—1907.
- Černobelьskaя G. M. Metodika obučeniя himii v sredneй škole. — M.: Gumanitarnый izdatelьskiй centr VLADOS, — 336 s. 2000. ISBN 5-691-00492- nevažeći ISBN.
Spoljašnje veze
[uredi | uredi izvor]- Elementimologija & Multidikt elemenata istorija reči i rečnik jezika
- Videos for each element by the University of Nottingham
- www.chemieseite.de enthält ausführliche Beschreibungen der Hauptelemente
- www.pse-mendelejew.de enthält viele Fotografien von reinen Elementen
- Umfangreiche Übersicht
