Пероксид
| |
| Називи | |
|---|---|
| IUPAC назив
Пероксид
| |
| Системски IUPAC назив
Dioxidanediide | |
| Други називи
Диоксид(2-)
| |
| Идентификација | |
| |
3Д модел (Jmol)
|
|
| ChEBI |
|
| ChemSpider |
|
| Гмелин Референца | 486 |
| |
| |
| Својства | |
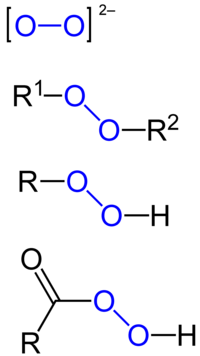
| R−O−O−R' | |
| Моларна маса | 32,00 g·mol−1 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
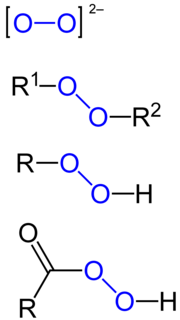
Пероксид је хемијско једињење хемијских елемената са кисеоником, у којем се кисеоник јавља са оксидационим бројем -I. Најпознатији пероксид је пероксид водоника.[5][6]
Пероксид баријума налази примену у пиротехници. Пероксид натријума се користи за апсорбовање угљен-диоксида и регенератор кисеоника (нпр. у подморницама), у след реакције:
- 2Na2O2 + 2CO2 → 2Na2CO3 + O2
Неки од најпознатијих пероксида су:
- H2O2
- Na2O2
- K2O2
- Rb2O2
- Cs2O2
- (NH4)2O2
- MgO2. xH2O
- CaO2
- SrO2
- BaO2
- ZnO2
- CdO2
- HgO2
Такође постоје и супероксиди, код којих се кисеоник јавља са оксидационим бројем -½ нпр. KO2 - супероксид калијума.
Биохемија
[уреди | уреди извор]Пероксиди су обично веома реактивни и стога се појављују у природи у веома мало облика, међу којима, поред водоник-пероксида, и неки продукти поврћа као што су аскаридол и дериват пероксида простагландина. Водоник-пероксид јавља се на површини воде, у подземним водама и у атмосфери. Формира се под светлошћу или неким другим катализатором. Морска вода садржи од 0.5 до 14 милиграма по литру водоник-пероксида, свежа вода од 1 до 30. Водоник-пероксид формира се у људима и животињама, као и у кратко живом продукту у биохемијском процесу и токсичан је за ћелије. Токсичност потиче од оксидације протеина и ДНК од пероксидних јона.[7] Класа биолошких ензима СОД (супероксид дисмутаза) ствара се у скоро свим живим ћелијама као антиоксиданси. Они помажу разлагање супероксида у кисеоник и водоник-пероксид, који је убрѕо разложен помоћу ензима каталазе у кисеоник и воду.[8]
- Формирање водоник-пероксида помоћу супероксида дисмутазе (SOD)
Пероксизоми су органеле које се налазе у скоро свим еукариотским ћелијама.[9] Оне учествују у катаболизму дугих ланаца масних киселина, биосинтези плазмалогена. Приликом оксидације, оне производе водоник-пероксид.[10]
- FAD = Флавин аденин динуклеоид
Каталаза, још један пероксимални ензим, користи водоник-пероксид да оксидира друге субстрате, укључујући феноле, метанску (мрављу) киселину, формалдехид и алкохол. Овај процес такође отклања отрован водоник-пероксид у току процеса.
Ова реакција је важна у ћелијама јетре и бубрега, где пероксизоми неутралишу разне токсичне супстанце које уђу у крв. Један део алкохола (етанола) који људи унесу је оксидиран до ацеталдехида на овај начин. Такође, када се водоник-пероксид нагомила (скупи) у ћелији, каталаза га претвара у воду у следећој реакцији.
Још један извор водоник-пероксида је деградација аденозин-монофосфата који даје хипоксатин. Хипоксатин је затим катаболизован до ксантина а онда до уринске киселине, а катализатор у овој реакцији је ксантин оксидаза.

Деградација гуанозина монофосфата даје ксантин као примарни продукт који је затим конвертован на исти начин у уринску киселину са формацијом водоник-пероксида.
Јаја морског јежа, убрзо након што су оплођена, производе водоник-пероксид. Он је убрзо разложен на OH- радикале. Радикали служе као покретачи радијалне полимеризације, која окружује јаја заштитним слојем полимера.

Једна брста бубе (bombardier beetle на енглеском) може да баца корозивне и смрдљиве мехурове на своје непријатеље. Буба производи и складишти хидрохинон и водоник-пероксид, у два одвојена резервоара на задњем делу абдомена. Када је нападнута, буба грчи мишиће који гураху два реактанта кроз канале у одељак који садржи воду и смешу каталичких ензима. Када се комбинују, настаје бурна егзотермна хемијска реакција, температура расте скоро до тачке кључања воде (100 °C). Кључајућа течност непријатног мириса делом постаје гас и избачена је кроз спољашњи вентил уз гласан звук.
Синтеза водоник-пероксида
[уреди | уреди извор]
Најчешће коришћен метод синтезе водоник-пероксида је антрахинон процес. Антахинон је прво хидрогенизован до антахидрохинона. Ова редукована компонента је оксидирана са молекулима кисеоника, регенеришући антахинон и отпуштајући водоник-пероксид. Директна синтеза водоник-пероксида из водоника и кисеоника је неефикасна и тренутно се не употребљава у индустрији.
Многи пероксиди минералних соли, као што су пероксид-дисулфати и перкарбонати, могу бити добијени оксидацијом (помоћу анода) тих киселина. Материјал аноде мора бити стабилан на високим потенцијалима од неколико волти, тако да је углавном или платина или њене легуре.
Пероксидисумпорна киселина је у историји коришћена за прављење водоник-пероксида, помоћу метода развијеном на почетку 20. века.
Овај процес захтева релативно високу концентрацију пероксидисумпорне киселине зато што разблаженији раствори стварају кисеоник уместо пероксида.
Органски пероксиди
[уреди | уреди извор]Органски пероксиди могу бити подељени у две велике групе, пероксикиселине и органске хидропероксиде. Прва група се прави од карбоксилних киселина а друга од етра или алкохола.
Прављење
[уреди | уреди извор]Већина пероксикиселина могу се добити у реакцији водоник-пероксида и одговарајуће карбоксилне киселине.
- R је органска група
Други начин користи алил (киселински) халид уместо карбоксилне киселине. Овај начин се користи највише са ароматичним једињењима у бази да би се неутрализовао добијени хлороводоник.
Ароматични алдехиди могу бити ауто-оксидирани у пероксикарбоксилну киселину.
- Ar је арил
Продукти међутим делују са почетним адехидом градећи карбоксилну киселину.
Познато је неколико начина за синтезу алифатичних пероксида, као што је реакција диалкил-сулфата са алкалним раствором водоник-пероксида.[11][12] Овим методом, алкил-сулфат даје алкил групу и сулфатни јон формира напуштајућу групу (?).
Анализа пероксида
[уреди | уреди извор]
За квалитативно и квантитативно одређивање пероксида користи се неколико аналитичких метода.[13] Једноставна квалитативна детекција пероксида се врши јодно-скробном реакцијом.[14] Овде пероксиди, хидропероксиди или перкиселине оксидују додати калијум јодид у јод, који реагује са скробом дајући тамноплаву боју. Доступни су индикатори комерцијалног папира који користе ову реакцију. Ова метода је такође погодна за квантитативну процену, али не може да разликује различите врсте пероксидних једињења. Уместо тога, за ову сврху се користи промена боје различитих индиго боја у присуству пероксида.[15] На пример, губитак плаве боје у леуко-метилен плаво је селективан за водоник пероксид.[16]
Квантитативна анализа хидропероксида може се извршити потенциометријском титрацијом са литијум алуминијум хидридом.[17] Други начин да се процени садржај перкиселина и пероксида је волуметријска титрација са алкоксидима као што је натријум етоксид.[18]
Активни кисеоник у пероксидима
[уреди | уреди извор]Сматра се да свака перокси група садржи један активни атом кисеоника. Концепт садржаја активног кисеоника је користан за поређење релативне концентрације перокси група у формулацијама, што је повезано са енергетским садржајем. Генерално, садржај енергије се повећава са садржајем активног кисеоника, и самим тим што је већа молекулска тежина органских група, то је нижи енергетски садржај и, обично, мања опасност.
Термин активни кисеоник се користи за одређивање количине пероксида присутног у било којој формулацији органског пероксида. Један од атома кисеоника у свакој пероксидној групи се сматра „активним”. Теоријска количина активног кисеоника може се описати следећом једначином:[19]
где је p број пероксидних група у молекулу, а m је молекулска маса чистог пероксида.
Безбедност
[уреди | уреди извор]
Пероксиди су јаки оксиданси и лако реагују са кожом, памуком и дрвеном пулпом.[20] Из безбедносних разлога, пероксидна једињења се чувају у хладном, непрозирном контејнеру, јер загревање и осветљење убрзавају њихове хемијске реакције. Мале количине пероксида, које излазе из резервоара за складиштење или реакционих судова, неутралишу се коришћењем редукционих агенаса као што је гвожђе(II) сулфат. Мере безбедности у индустријским постројењима која производе велике количине пероксида укључују следеће:
- Опрема се налази унутар армиранобетонских конструкција са прозорима од фолије, који би смањили притисак и не би дoшло до лома у случају експлозије.
- Производи се флаширају у мале контејнере и премештају се на хладно место одмах након синтезе.
- Контејнери су направљени од нереактивних материјала као што су нерђајући челик, неке легуре алуминијума или тамно стакло.[21]
За безбедно руковање концентрованим органским пероксидима, важан параметар је температура узорка, коју треба одржавати испод температуре самоубрзајућег разлагања једињења.[22]
Транспорт органских пероксида је ограничен. Министарство саобраћаја САД наводи ограничења испоруке органског пероксида и забрањене материјале у табели опасних материјала 49 CFR 172.101 на основу концентрације и физичког стања материјала:
| Хемијски назив | CAS број | Забрана |
|---|---|---|
| Ацетил ацетон пероксид | 37187-22-7 | > 9% по маси активног кисеоника |
| Ацетил бензоил пероксид | 644-31-5 | чврст, или > 40% у раствору |
| Аскаридол | 512-85-6 | (органски пероксид) |
| tert-Бутил хидропероксид | 75-91-2 | > 90% у раствору (воденом) |
| Ди-(1-нафтоил)пероксид | 29903-04-6 | |
| Диацетил пероксид | 110-22-5 | чврст, или > 25% у раствору |
| Етил хидропероксид | 3031-74-1 | |
| Метил етил кетон пероксид | 1338-23-4 | > 9% по маси активног кисеоника у раствору |
| Метил изобутил кетон пероксид | 37206-20-5 | > 9% по маси активног кисеоника у раствору |
Референце
[уреди | уреди извор]- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Herbert Klenk (2005). „Peroxy Compounds, Organic”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_199.
- ^ Silbert, L. S.; Siegel, E.; Swern, D. (1964). „Peroxybenzoic Acid”. Org. Synth. 44: 81. doi:10.15227/orgsyn.044.0081.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Löffler & Petrides 1988, стр. 288
- ^ Löffler, Georg; Petrides, Petro E. (1988). Physiologische Chemie (4th изд.). Berlin: Springer. стр. 321—322. ISBN 978-3-540-18163-7.
- ^ Gabaldón T. (2010). „Peroxisome diversity and evolution”. Philos Trans R Soc Lond B Biol Sci. 365 (1541): 765—73. PMC 2817229
 . PMID 20124343. doi:10.1098/rstb.2009.0240.
. PMID 20124343. doi:10.1098/rstb.2009.0240.
- ^ Nelson & Cox 2005, стр. 663–664
- ^ Medwedew, S. S.; Alexejewa, E. N. (1932). „Organic peroxides II. Of the reaction between benzoyl hydroperoxide or benzoyl peroxide and triphenylmethyl”. Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 65 (2): 137. doi:10.1002/cber.19320650204.
- ^ Wiley, Richard Haven "Preparation of diaikyl peroxides" U.S. Patent 2.357.298 Issue date: 1942
- ^ Légrádi, L.; Légrádi, J. (1970). „Detection of peroxides, hydroperoxides and peracids”. Microchimica Acta. 58: 119—122. S2CID 101877371. doi:10.1007/BF01218105.
- ^ Lea, C. H. (1931). „The Effect of Light on the Oxidation of Fats”. Proceedings of the Royal Society B: Biological Sciences. 108 (756): 175—189. Bibcode:1931RSPSB.108..175L. doi:10.1098/rspb.1931.0030
 .
.
- ^ Veibel, S. Analytik organischer Verbindungen, Akademie-Verlag, Berlin, 1960, p. 262
- ^ Eiss, M. I.; Giesecke, Paul (1959). „Colorimetric Determination of Organic Peroxides”. Analytical Chemistry. 31 (9): 1558. doi:10.1021/ac60153a038.
- ^ Higuchi, T.; Zuck, Donald Anton (1951). „Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups”. Journal of the American Chemical Society. 73 (6): 2676. Bibcode:1951JAChS..73.2676H. doi:10.1021/ja01150a073.
- ^ Martin, A. J. (1957). „Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine”. Analytical Chemistry. 29: 79—81. doi:10.1021/ac60121a022.
- ^ „ASTM E298, Standard Test Methods for Assay of Organic Peroxides”. ASTM. 2010.
- ^ Heinz G. O. Becker Schwetlick, Klaus (2001). Organikum. Wiley. стр. 741—762. ISBN 3-527-29985-8.. Wiley-VCH.
- ^ Ozonelab Peroxide compatibility
- ^ „Product Stewardship”. American Chemistry Council. 2021-01-17. Приступљено 2022-01-03.
Литература
[уреди | уреди извор]- Nelson, David L.; Cox, Michael M. (2005). Lehninger Biochemie. Springer. стр. 663—664. ISBN 978-3-540-41813-9.
- Creaser, I.I.; Edwards, J.O. (1972). „?”. Topics in Phosphorus Chemistry. 7: 379—435.
- Chen, Li-Jiang; Lin, Chang-Jian; Zuo, Juan; Song, Ling-Chun; Huang, Chao-Ming (2004). „First Spectroscopic Observation of Peroxocarbonate/ Peroxodicarbonate in Molten Carbonate”. The Journal of Physical Chemistry B. 108 (23): 7553—7556. doi:10.1021/jp035749l.
- „The Perils of Peroxides”. carolina.com. Burlington, NC: Carolina Biological Supply Company. Архивирано из оригинала 2007-12-18. г.
Спољашње везе
[уреди | уреди извор] Медији везани за чланак Пероксид на Викимедијиној остави
Медији везани за чланак Пероксид на Викимедијиној остави- Organic Peroxide Producers Safety Division
- OSH Answers – organic peroxides
- European Organic Peroxide Safety Group













![{\displaystyle A[\mathrm {O} ]_{\text{теоријски}}(\%)=16{\frac {p}{m}}\times 100,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4977b7f801b71ec577b97705d65b4733a6024dc0)