Metalocen

Metalocen je jedinjenje koje se tipično sastoji od dva ciklopentadienil anjona (Cp, ili C
5H−
5) vezana za metalni centar (M) u oksidacionom stanju II, sa opštom formulom (C5H5)2M. Blisko srodni metalocenima su metalocenski derivati, e.g. titanocen dihlorid, vanadocen dihlorid. Pojedini metaloceni i njihovi derivati ispoljavaju katalitička svojstva, mada se metaloceni retko koriste u industriji. Katjonska grupa četiri derivata metalocena srodna sa [Cp2ZrCH3]+ katalizuje olefinsku polimerizaciju. Metaloceni su podgrupa šire klase organometalnih jedinjenja zvanih sendvična jedinjenja.
U strukturi prikazanoj na desnoj strani, dva pentagona su ciklopentadienilni anjoni, pri čemu krugovi označavaju da su oni aromatično stabilizovani. Ovde su prikazani u stepeničastoj konformaciji.
Istorija
[уреди | уреди извор]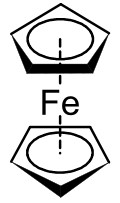
Prvi klasifikovani metalocen je bio ferocen. Ovo jedinjenje su simultano otkirili Keli i Pauson,[1] i Milera et al 1951. godine.[2] Keli i Pauson su pokušali da sintetišu fulvalen putem oksidacije ciklopentadienilne soli sa anhidriranim FeCl3 ali su umesto toga proizveli supstancju C10H10Fe[1] Istovremeno su Miler et al objavili isti produkat iz reakcije ciklopentadiena sa gvožđem u prisustvu aluminijumskih, kalijumskih, ili molibdenskih oksida.[2] Strukturu "C10H10Fe" su odredili Vilkinson et al.[3] i Fišer et al.[4] Oni su nagrađeni Nobelovom nagradom za hemiju 1973. godine za njihov rad na sendvičnim jedinjenjima, uključujući strukturnu determinaciju ferocena.[3] Oni su utvrdili da atomi ugljenika ciklopentadienilnog (Cp) liganda u jednakoj meri doprinose vezivanju i da do vezivanja dolazi između metalnih d-orbitala i π-elektrona p-orbitala Cp liganda. Taj kompleks je poznat kao ferocen, a grupa prelaznih metala diciklopentadienilnih jedinjenja je poznata kao metaloceni i imaju opštu forumulu [(η5-C5H5)2M]. Fišer et al. su prvi pripremili ferocenske derivate sa Co i Ni. Postoje metaloceni mnogih elemenata. Oni su obično izvedeni iz supstituisanih derivata ciklopentadienida.[5]
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ а б Kealy, T. J.; Pauson, P. L. (1951). „A New Type of Organo-Iron Compound”. Nature. 168 (4285): 1039. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0.
- ^ а б Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). „114. Dicyclopentadienyliron”. J. Chem. Soc. 1952: 632—635. doi:10.1039/JR9520000632.
- ^ а б Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). „The Structure of Iron Bis-Cyclopentadienyl”. J. Am. Chem. Soc. 74 (8): 2125—2126. doi:10.1021/ja01128a527.
- ^ Fischer, E. O.; Pfab, W. (1952). „Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels” [On the crystal structure of the di-cyclopentadienyl compounds of divalent iron, cobalt and nickel]. Z. Naturforsch. B. 7: 377—379.
- ^ Chirik, Paul J. (2010). „Group 4 Transition Metal Sandwich Complexes: Still Fresh after Almost 60 Years”. Organometallics. 29: 1500—1517. doi:10.1021/om100016p.
Literatura
[уреди | уреди извор]- Salzer, A. (1999). „Nomenclature of Organometallic Compounds of the Transition Elements”. Pure Appl. Chem. 71 (8): 1557—1585. doi:10.1351/pac199971081557. Архивирано из оригинала 16. 07. 2007. г. Приступљено 04. 11. 2016.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4th изд.). Wiley-Interscience.
- Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry. Upper Saddle River, NJ: Pearson Education. ISBN 0-13-035471-6.
- Cotton, F. A.; Wilkinson, G. (1988). Inorganic Chemistry (5th изд.). Wiley. стр. 626–7.
- Togni, A.; Halterman, R. L. (1998). Metallocenes. Wiley-VCH.
