Максвел–Болцманова дистрибуција
У физици (посебно у статистичкој механици), Максвел-Болцманова расподела је посебна дистрибуција вероватноће названа по Џејмсу Клерку Максвелу и Лудвигу Болцману.
Прво је дефинисана и коришћена за описивање брзина честица у идеалним гасовима, где се честице слободно крећу унутар непокретног контејнера без међусобне интеракције, изузев врло кратких судара у којима међусобно или са својим окружењем размењују енергију и моментум. Термин „честица“ у овом контексту односи се само на гасовите честице ( атоме или молекуле), а претпоставља се да је систем честица достигао термодинамичку равнотежу . [1] Енергије таквих честица прате оно што је познато као Максвел-Болцманова статистика, а статистичка расподела брзина изведена је изједначавањем енергија честица са кинетичком енергијом .
Математички, Максвел-Болцманова расподела је хи дистрибуција са три степена слободе (компоненте вектора брзине у Еуклидовом простору), са параметром скале који мери брзине у јединицама пропорционалним квадратном корену од (однос температуре и масе честица). [2]
Максвел-Болцманова расподела резултат је кинетичке теорије гасова, која пружа поједностављено објашњење многих основних гасних својстава, укључујући притисак и дифузију . [3] Максвел-Болцманова расподела се у основи примењује на брзине честица у три димензије, али се испоставило да зависи само од брзине ( износа брзине) честица. Расподела вероватноће брзине честице указује на то које су брзине вероватније: честица ће имати брзину случајно одабрану из расподеле и већа је вероватноћа да ће бити унутар једног опсега брзина од другог. Кинетичка теорија гасова односи се на класични идеалан гас, који је идеализација стварних гасова. У стварним гасовима постоје различити ефекти (нпр. Ван дер Валсове интеракције, вртложни ток, релативистичка ограничења брзине и интеракције квантне размене ) који могу учинити њихову расподелу брзине другачијом од Максвел-Болцмановог модела. Међутим, разређени гасови на уобичајеним температурама понашају се готово као идеалан гас и Максвелова расподела брзине је одлична апроксимација за такве гасове. Идеалне плазме, које су јонизовани гасови са довољно малом густином, често имају и расподелу честица која је делимично или у потпуности максвеловска. [4]
Дистрибуцију је први извео Максвел 1860. године на хеуристичким основама. [5] Болцман је касније, 1870-их, спровео значајна истраживања физичког порекла ове дистрибуције.
Дистрибуција се може извести на основу тога што максимализује ентропију система. Списак извода су:
- Максимална расподела вероватноће ентропије у фазном простору, са ограничењем очувања просечне енергије ;
- Канонски ансамбл .
Функција дистрибуције
[уреди | уреди извор]Под претпоставком да систем од интереса садржи велики број честица, удео честица унутар бесконачно малог елемента тродимензионалног простора брзине,, центриран на вектор брзине величине, је, у којима
где је маса честица и је производ Болцманове константне и термодинамичке температуре .
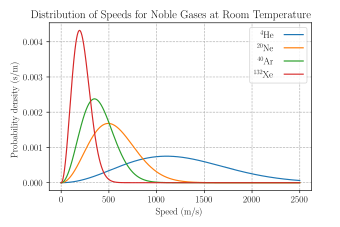
Елемент простора брзине можемо записати као d = d d d, за брзине у стандардном картезијанском координатном систему или као d = д d у стандардном сферном координатном систему, где d је елемент пуног угла. У овом случају, је дата као функција расподеле вероватноће, правилно нормализована тако да d преко свих брзина једнака је један. У физици плазме, расподела вероватноће се често помножи са густином честица, тако да је интеграл резултујуће функције расподеле једнак густини.
Максвелова функција расподеле за честице које се крећу само у једном смеру, ако је овај правац , је
који се могу добити интегрисањем тродимензионалне форме дане изнад и .
Препознавши симетрију , може се интегрисати преко пуног угла и написати расподела вероватноће брзина као функција
Ова функција густине вероватноће даје вероватноћу, по јединици брзине, налажења честице брзином близу . Ова једначина је једноставно Максвел-Болцманова расподела (дата у инфо кутији) са параметром расподеле . Максвел-Болцманова расподела еквивалентна је хи дистрибуцији са три степена слободе и параметром скале .
Најједноставнија обична диференцијална једначина коју задовољава расподела је:
или представљено без јединице:
Дарвин-Фовлер-овом методом средњих вредности добија се Максвел-Болцманова расподела као тачан резултат.
Однос према 2D Максвел-Болцмановој расподели
[уреди | уреди извор]
За честице ограничене да се крећу у равни, расподела брзине је дата са
Ова расподела се користи за опис система у равнотежи. Међутим, већина система не започиње у равнотежном стању. Еволуцијом система ка његовом равнотежном стању управља Болцманова једначина . Једначина предвиђа да ће за интеракције кратког домета равнотежна расподела брзине следити Максвел-Болцманову расподелу. Десно је симулација молекуларне динамике (МД) у којој је 900 честица тврде сфере ограничено да се креће у правоугаонику. Они комуницирају помоћу савршено еластичних судара. Систем се покреће из равнотеже, али расподела брзине (у плавој боји) брзо конвергира у 2D Максвел-Болцман расподелу (у наранџастој боји).
Типичне брзине
[уреди | уреди извор]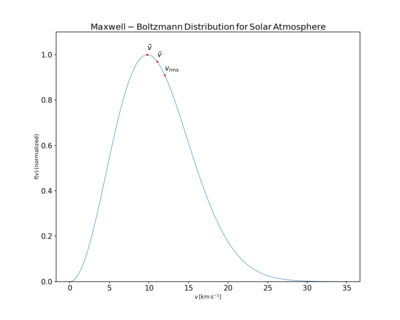
Средња брзина , највероватнија брзина ( режим) vp и средња квадратна брзина могу се добити из својстава Максвелове расподеле.
Ово добро функционише за готово идеалне, монатомске гасове попут хелијума, али и за молекуларне гасове попут двоатомског кисеоника . То је зато што, упркос већем топлотном капацитету (већој унутрашњој енергији при истој температури) због већег броја степени слободе, њихова транслациона кинетичка енергија (а самим тим и брзина) остаје непромењена. [6]
- }}-->Укратко, типичне брзине су повезане на следећи начин:
Средња квадратна брзина директно је повезана са брзином звука c у гасу, за
где је адијабатски индекс, f је број степена слободе појединачног молекула гаса. За горњи пример, двоатомни азот (приближни ваздух) на 300, [7] и
права вредност ваздуха се може апроксимализовати коришћењем просечне моларне тежине ваздуха ( 29 ), дајући 347 на 300 (корекције за променљиву влажност ваздуха су реда од 0,1% до 0,6%).
Просечна релативна брзина
где је тродимензионална расподела брзине
Интеграл се лако може извршити променом на координате и
Извођење и сродне дистрибуције
[уреди | уреди извор]Максвел – Болцман статистика
[уреди | уреди извор]Првобитно извођење из 1860. године Џејмса Клерка Максвела био је аргумент заснован на молекуларним сударима кинетичке теорије гасова као и одређеним симетријама у функцији расподеле брзине; Максвел је такође дао рани аргумент да ови молекуларни судари имају тенденцију ка равнотежи. [5] [8] После Максвела, Лудвиг Болцман је 1872. године [9] такође извео расподелу на механичким основама и тврдио да би гасови временом требало да теже ка тој расподели, услед судара (види Х-теорему ). Касније (1877) [10] је поново извео расподелу у оквиру статистичке термодинамике . Изводи у овом одељку су у складу са Болцмановим извођењем из 1877. године, почев од резултата познатог као Максвел -Болцман статистика (из статистичке термодинамике). Максвел -Болцманова статистика даје просечан број честица пронађених у датом једночестичном микростању. Под одређеним претпоставкама, логаритам фракције честица у датом микростању сразмеран је односу енергије тог стања и температуре система:
Претпоставке ове једначине су да честице не интерагују међусобно и да су класичне; то значи да се стање сваке честице може сматрати независно од стања осталих честица. Поред тога, претпоставља се да су честице у топлотној равнотежи. [1] [11]
Ова веза се може написати као једначина увођењем нормализујућег фактора:
-
(1)
где:
- Ni је очекивани број честица у једночестичном микростању i,
- N је укупан број честица у систему,
- Ei је енергија микростања i,
- збир над индексом j узима у обзир сва микростања,
- T је равнотежна температура система,
- k је Болцманова константа .
Деноминатор у једначини ( 1 ) је једноставно нормализујући фактор тако да односи доприносе јединству- другим речима, то је нека врста партицијске функције (за једнопартицијски систем, а не уобичајена партицијска функција читавог система).
Будући да су брзина и велоцитет повезани са енергијом, једначина ( 1 ) се може користити за добијање односа између температуре и брзине честица гаса. Све што је потребно је открити густину микростања у енергији, која се одређује поделом простора импулса на регионе једнаке величине.
Расподела вектора импулса
[уреди | уреди извор]За потенцијалну енергију се узима нула, тако да је сва енергија у облику кинетичке енергије. Однос између кинетичке енергије и импулса за масивне нерелативистичке честице је
-
(2)
где је п 2 квадрат импулсног вектора p = [ п к, п и, п з ]. Стога једначину ( 1 ) можемо преписати као:
-
(3)
где је З партицијска функција, која одговара деноминатору у једначини ( 1 ). Овде је m молекулска маса гаса, Т термодинамичка температура и k Болцманова константа . Ова дистрибуција је пропорционалан функцији густине вероватноће f п за проналажење молекула са овим вредностима компоненти импулса, па:
-
(4)
Нормализујућа константа може се одредити препознавањем да вероватноћа молекула има одређени замах мора бити 1. Интегрисањем експоненцијала у ( 4 ) по свим pk,p y и pz добија се фактор од
Тако да је нормализована функција расподеле:
Сматра се да је расподела производ три независне нормално дистрибуиране променљиве, , и, са одступањем . Поред тога, може се видети да ће величина моментума бити распоређена као Максвел-Болцманова расподела, са . Максвел-Болцманова расподела за импулс (или једнако за брзине) може се темељније добити помоћу Х-теореме у равнотежи у оквиру кинетичке теорије гасних оквира.
Расподела енергије
[уреди | уреди извор]Расподела енергије је импозантна
-
(7)
где је бесконачно мали запремински простор импулса фазног простора који одговара енергетском интервалу . Користећи сферну симетрију односа дисперзије енергије и импулса, ово се може изразити у на следећи начин :
-
(8)
Користећи тада ( 8 ) у ( 7 ) и изражавајући све у смислу енергије, добијамо
Будући да је енергија пропорционална збиру квадрата три нормално распоређене компоненте импулса, ова расподела енергије може се записати еквивалентно гама расподели, користећи параметар облика, и параметар скале, .
Користећи теорему о равнотежи, с обзиром да је енергија равномерно распоређена између сва три степена слободе у равнотежи, такође можемо поделити у скуп хи-квадрат дистрибуција, где енергија по степену слободе,, дистрибуира се као хи-квадрат дистрибуција са једним степеном слободе, [12]
У равнотежи, ова расподела ће важити за било који број степени слободе. На пример, ако су честице ригидни масени диполи фиксног диполног момента, имаће три транслациона степена слободе и два додатна ротациона степена слободе. Енергија у сваком степену слободе биће описана према горњој хи-квадрат расподели са једним степеном слободе, а укупна енергија биће распоређена према хи-квадрат дистрибуцији са пет степена слободе. То има импликације у теорији специфичне топлоте гаса.
Максвел-Болцман-ова расподела се такође може добити узимајући у обзир да је гас врста квантног гаса за који се може извршити апроксимација ε >> к Т.
Расподела за вектор брзине
[уреди | уреди извор]Схватајући да је густина вероватноће брзине f v пропорционална функцији густине вероватноће импулса за
и користећи p = m v добијамо
што је Максвел-Болцманова расподела брзине. Вероватноћа проналаска честице брзином у бесконачно малом елементу [ dv k, dv y, dv z ] о брзини v = [ vk, v y, v z] је
Као и моментум, и за ову расподелу се види да је производ три независне нормално дистрибуиране променљиве, , и, али са одступањем . Такође се може видети да је Максвел-Болцманова расподела брзине за векторску брзину [v k, v y, vz ] је умножак расподеле за сваки од три правца:
где је расподела за један правац
Свака компонента вектора брзине има нормалну расподелу са средњом вредношћу и стандардна девијација, тако да вектор има тродимензионалну нормалну расподелу, одређену врсту мултиваријантне нормалне расподеле, са средњом вредности и коваријанција, где је идентитет матрица.
Расподела брзине
[уреди | уреди извор]Максвел-Болцманова расподела брзине следи непосредно из расподеле вектора брзине, горе. Имајте на уму да је брзина
а елемент запремине у сферним координатама
где и су сферни координатни углови вектора брзине. Интеграција функције густине вероватноће брзине преко пуних углова даје додатни фактор од . Расподела брзине са заменом брзине за збир квадрата векторских компонената:
У n -димензионалном простору
[уреди | уреди извор]У n- димензионалном простору Максвел-Болцманова расподела постаје:
Дистрибуција брзине постаје:
Следећи интегрални резултат је користан:
где је функција Гама . Овај резултат се може користити за израчунавање тренутака функције расподеле брзине:
која је сама средња брзина .
Извод функције расподеле брзине:
Види још
[уреди | уреди извор]- Квантна Болцманова једначина
- Максвел – Болцман статистика
- Максвел-Јуттнерова расподела
- Болцманова расподела
- Болцманов фактор
- Раилеигх дистрибуција
- Кинетичка теорија гасова
Референце
[уреди | уреди извор]- ^ а б Statistical Physics (2nd Edition), F. Mandl, Manchester Physics, John Wiley & Sons, (2008) ISBN 9780471915331
- ^ University Physics – With Modern Physics (12th Edition), H.D. Young, R.A. Freedman (Original edition), Addison-Wesley (Pearson International), 1st Edition: 1949, 12th Edition: (2008) ISBN 978-0-321-50130-1
- ^ Encyclopaedia of Physics (2nd Edition), R.G. Lerner, G.L. Trigg, VHC publishers, (1991) ISBN 3-527-26954-1 (Verlagsgesellschaft), ISBN 0-89573-752-3 (VHC Inc.)
- ^ N.A. Krall and A.W. Trivelpiece, Principles of Plasma Physics, San Francisco Press, Inc., 1986, among many other texts on basic plasma physics
- ^ а б See:
- ^ Raymond A. Serway; Jerry S. Faughn; Chris Vuille (2011). College Physics, Volume 1 (9th изд.). стр. 352. ISBN 9780840068484.
- ^ Nitrogen at room temperature is considered a "rigid" diatomic gas, with two rotational degrees of freedom additional to the three translational ones, and the vibrational degree of freedom not accessible.
- ^ Gyenis, Balazs (2017). „Maxwell and the normal distribution: A colored story of probability, independence, and tendency towards equilibrium”. Studies in History and Philosophy of Modern Physics. 57: 53—65. Bibcode:2017SHPMP..57...53G. arXiv:1702.01411
 . doi:10.1016/j.shpsb.2017.01.001.
. doi:10.1016/j.shpsb.2017.01.001.
- ^ Boltzmann, L., "Weitere studien über das Wärmegleichgewicht unter Gasmolekülen." Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften in Wien, mathematisch-naturwissenschaftliche Classe, 66, 1872, pp. 275–370.
- ^ Boltzmann, L., "Über die Beziehung zwischen dem zweiten Hauptsatz der mechanischen Wärmetheorie und der Wahrscheinlichkeitsrechnung respektive den Sätzen über das Wärmegleichgewicht." Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften in Wien, Mathematisch-Naturwissenschaftliche Classe. Abt. II, 76, 1877, pp. 373–435. Reprinted in Wissenschaftliche Abhandlungen, Vol. II, pp. 164–223, Leipzig: Barth, 1909. Translation available at: http://crystal.med.upenn.edu/sharp-lab-pdfs/2015SharpMatschinsky_Boltz1877_Entropy17.pdf Архивирано на сајту Wayback Machine (5. март 2021)
- ^ McGraw Hill Encyclopaedia of Physics (2nd Edition), C.B. Parker, (1994) ISBN 0-07-051400-3
- ^ Laurendeau, Normand M. (2005). Statistical thermodynamics: fundamentals and applications. Cambridge University Press. стр. 434. ISBN 0-521-84635-8., Appendix N, page 434
Додатна литература
[уреди | уреди извор]- Физика за научнике и инжењере - са савременом физиком (6. издање), ПА Типлер, Г. Мосца, Фрееман, (2008) ISBN 0-7167-8964-7
- Термодинамика, од концепата до примене (друго издање), А. Схавит, Ц. Гутфингер, ЦРЦ Press (Таилор и Францис Гроуп, САД), (2009) ISBN 978-1-4200-7368-3
- Хемијска термодинамика, ДЈГ Ивес, Универзитетска хемија, Мацдоналд Тецхницал анд Сциентифиц, (1971) ISBN 0-356-03736-3
- Елементи статистичке термодинамике (друго издање), ЛК Насх, Принциплес оф Цхемистри, Аддисон-Веслеи, (1974) ISBN 0-201-05229-6
- Вард, ЦА и Фанг, Г 1999, „Израз за предвиђање флукса испаравања течности: Приступ статистичкој брзини теорије“, Пхисицал Ревиев Е, вол. 59, бр. 1, стр. 429–40.
- Рахими, П & Вард, ЦА 2005, „Кинетика испаравања: приступ теорији статистичке брзине“, Међународни часопис за термодинамику, вол. 8, бр. 9, стр. 1–14.
Спољашње везе
[уреди | уреди извор]- "Расподела брзине Максвел" из пројекта Волфрам Демонстратионс на Матхворлд-у


















































![{\displaystyle {\frac {N_{i}}{N}}={\frac {1}{Z}}\exp \left[-{\frac {p_{i,x}^{2}+p_{i,y}^{2}+p_{i,z}^{2}}{2mkT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8dc173ee0113a100c4713d64801c5f4d028cff71)
![{\displaystyle f_{\mathbf {p} }(p_{x},p_{y},p_{z})\propto \exp \left[-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3712e79fe2355995f5c9ee99a51c83127dff8a0a)
![{\displaystyle \iiint _{-\infty }^{+\infty }\exp \left[-{\frac {p_{x}^{2}+p_{y}^{2}+p_{z}^{2}}{2mkT}}\right]dp_{x}\ dp_{y}\ dp_{z}={({\sqrt {\pi }}{\sqrt {2mkT}})^{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70f4955201fb75e0921b1738f340ca8d935c95b6)

















![{\displaystyle f_{\epsilon }(\epsilon )\,d\epsilon ={\sqrt {\frac {1}{\pi \epsilon kT}}}~\exp \left[{\frac {-\epsilon }{kT}}\right]\,d\epsilon }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b957722f14b4f35ca02434218927e2ffff4d4)

![{\displaystyle f_{\mathbf {v} }(v_{x},v_{y},v_{z})=\left({\frac {m}{2\pi kT}}\right)^{3/2}\exp \left[-{\frac {m(v_{x}^{2}+v_{y}^{2}+v_{z}^{2})}{2kT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efc0617ed7d78e1282e9dffef06398cadf8b74b9)



![{\displaystyle f_{v}(v_{i})={\sqrt {\frac {m}{2\pi kT}}}\exp \left[{\frac {-mv_{i}^{2}}{2kT}}\right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86a6d2151bda2079488be11059d0320477fb8eb8)












![{\displaystyle f(v)=\left({\frac {2}{\pi }}\right)^{1/2}\left({\frac {m}{kT}}\right)^{3/2}v^{2}\exp \left[-{\frac {mv^{2}}{2kT}}\right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8efeebc81e96ca2166aa4652f1228131ab1eeb66)


![{\displaystyle {\begin{aligned}\int _{0}^{+\infty }v^{a}e^{-{\frac {mv^{2}}{2kT}}}dv&=\left[{\frac {2kT}{m}}\right]^{(a+1)/2}\int _{0}^{+\infty }e^{-x}x^{\frac {a}{2}}dx^{\frac {1}{2}}\\&=\left[{\frac {2kT}{m}}\right]^{(a+1)/2}\int _{0}^{+\infty }e^{-x}x^{\frac {a}{2}}{\frac {x^{-{\frac {1}{2}}}}{2}}dx\\&=\left[{\frac {2kT}{m}}\right]^{(a+1)/2}{\frac {\Gamma ({\frac {a+1}{2}})}{2}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5aa880a767dda0a1e61815cab2be0c852f49e72)

![{\displaystyle {\begin{aligned}\langle v\rangle &={\frac {\int _{0}^{+\infty }v\cdot v^{n-1}e^{-{\frac {mv^{2}}{2kT}}}dv}{\int _{0}^{+\infty }v^{n-1}e^{-{\frac {mv^{2}}{2kT}}}dv}}\\&=\left[{\frac {2kT}{m}}\right]^{1/2}{\frac {\Gamma ({\frac {n+1}{2}})}{\Gamma ({\frac {n}{2}})}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c2b85e7ed2894cbdb61eb8583ebfbe02d526b97)
![{\displaystyle v_{\text{avg}}=\langle v\rangle =\left[{\frac {2kT}{m}}\right]^{1/2}{\frac {\Gamma ({\frac {n+1}{2}})}{\Gamma ({\frac {n}{2}})}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8505a8edd15b531a592698dbcbe9f8f52ea34575)
![{\displaystyle {\begin{aligned}\langle v^{2}\rangle &={\frac {\int _{0}^{+\infty }v^{2}\cdot v^{n-1}e^{-{\frac {mv^{2}}{2kT}}}dv}{\int _{0}^{+\infty }v^{n-1}e^{-{\frac {mv^{2}}{2kT}}}dv}}\\&=\left[{\frac {2kT}{m}}\right]{\frac {\Gamma ({\frac {n+2}{2}})}{\Gamma ({\frac {n}{2}})}}\\&=\left[{\frac {2kT}{m}}\right]{\frac {n}{2}}={\frac {nkT}{m}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7229babe1109170d8853238e96bbd3ee0087ee56)
