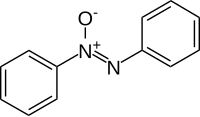
Azoksibenzen
| |

| |
| Називи | |
|---|---|
| Преферисани IUPAC назив
Difenildiazen oksid [1] | |
| Други називи | |
| Идентификација | |
| ECHA InfoCard | 100.007.094 |
| UNII | |
| Својства | |
| C12H10N2O | |
| Моларна маса | 198,23 g·mol−1 |
| Агрегатно стање | žuta čvrsta supstanca |
| Густина | 1,318 g/cm3 |
| Тачка топљења | 35,5—36,5 °C (95,9—97,7 °F; 308,6—309,6 K) |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Azoksibenzen je organsko jedinjenje sa formulom C6H5N(O)NC6H5. To je žuta čvrsta supstanca koja ima nisku tačku topljenja. [4] Molekul ima planarno jezgro C2N2O. Dužina NN i NO veze je skoro ista na 1,23 A. [5]
Priprema
[уреди | уреди извор]Može se pripremiti delimičnim smanjenjem nitrobenzena. Ova reakcija je predložena da se nastavi putem posredovanja fenilhidroksilamina i nitrozobenzena: [4]
- PhNHOH + PhNO → PhN(O)NPh + H2O
Druga opcija je oksidacija anilina vodonik-peroksidom u acetonitrilu na 50 °C (122 °F; 323 K). U ovoj reakciji, pH treba održavati oko 8, da bi se aktivirao vodonik-peroksid i istovremeno izbeglo previše oslobađanja kiseonika. Prvo se oksiduje acetonitril, formirajući imin hidroperoksid. Zatim, ova međufaza oksiduje anilin u azoksibenzen. [4]
- CH3CN + H2O2 → [CH3C(OOH)=NH]
- 2 PhNH2 + 3 [CH3C(OOH)=NH] → PhN(O)NPh + 3 CH3C(O)NH2 + 2 H2O
- PhNO2 + Na3AsO3/NaOH→ Ph−N+O−=N-Ph
Još jedna od opcija kada se Azoksibenzen dobija redukcijom nitrobenzena sa natrijum arsenitom, koji se, pak, dobija rastvaranjem arsenik(III) oksida u vodenoj bazi. Nakon obrade, proizvod se издваја u obliku žutih kristala. [6]
Svojstva
[уреди | уреди извор]Toplota razlaganja određena korišćenjem DSC je −258 kJ mol−1 ili −1303 kJ kg−1. [7]
Hemijska svojstva
[уреди | уреди извор]Azoksibenzen reaguje sa aluminijum hloridom u CS2 ili sa acetil hloridom, dajući para-hlorazobenzen. Ako se ista reakcija odvija u benzenu, proizvodi se samo para-fenilazobenzen. [8]
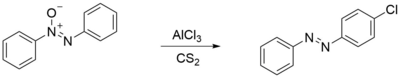
Na sličan način, azoksibenzen reaguje sa alkil i arilsulfonil hloridima, kako bi proizveo zamenske proizvode u para položaju sa izvesnom dodatkom orto supstitucionog proizvoda. Ako umesto sulfonil hlorida uzmemo odgovarajuće anhidride, reakcija dovodi do stvaranja samo paraproizvoda. [8]

Pri reakciji sa antimon(V) hloridom dolazi do taloženja kompleksa čije toplotno raspadanje vodi do proizvoda orto-hidroksilacije. [8]

Reference
[уреди | уреди извор]- ^ а б в г Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 1009. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-00648.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б H. E. Bigelow; Albert Palmer (1931). „Azoxybenzene”. Organic Syntheses. 11: 16. doi:10.15227/orgsyn.011.0016.
- ^ S. P. G. Martínez; S. Bernès (2007). „trans-Diphenyldiazene Oxide”. Acta Crystallographica Section E. 63 (8): o3639. doi:10.1107/S1600536807035787.
- ^ Bigelow H. E., Palmer A. (1935). „Azoxybenzene”. Org. Syn (на језику: енглески). 11: 16. doi:10.15227/orgsyn.011.0016.
- ^ Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften, VDI-Verlag, Schriftenreihe "Humanisierung des Arbeitslebens", Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- ^ а б в EROS 2016.
Literatura
[уреди | уреди извор]- El-Awa A. (2016). „Azoxybenzene” (на језику: енглески) (Encyclopedia of Reagents for Organic Synthesis изд.). Wiley. doi:10.1002/047084289X.rn01782.

![{\displaystyle {\mathsf {PhNO_{2}{\xrightarrow[{NaOH,H_{2}O}]{As_{2}O_{3}}}PhN=N^{+}(O^{-})Ph}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/274dc1a1185c707bcb68d47e6855c0ce0f57382c)