Organohlorid
|
| Dva prikaza organohlorida hloroforma. |
Organohlorid, organohlorno jedinjenje, hlorougljenik, ili hlorinisani ugljovodonik je organsko jedinjenje koje sadrži bar jedan kovalentno vezani atom hlora, koji utiče na hemijska svojstva molekula. Hloroalkanska klasa (alkani sa jednim ili više vodonika zamenjenih hlorom) je dobar primer takvih jedinjenja. Široka strukturna varijabilnost i divergentnost hemijskih svojstava organohlorida dovodi do njihovog širokog opsega naziva i primena. Organohloridi su veoma korisna jedinjenja u mnogim oblicima primene, mada je prisustvo dela tih jedinjenja uzrok ozbiljnih problema u životnoj sredini.[1]
Fizička i hemijska svojstva
[уреди | уреди извор]Hlorinacijom se modifikuju fizička svojstva ugljenovodonika na nekoliko načina. Jedinjenja su tipično gušća od vode usled veće atoske težine hlora u odnosu na vodonik. Alifatični organohloridi su alkilacioni agensi, zato što je hlorid dobra odlazeća grupa.
Prirodna zastupljenost
[уреди | уреди извор]Mnoga organohlorna jedinjenja su izolovana iz prirodnih izvora koji su u rasponu od bakterija do ljudi.[2][3] Hlorinisana organska jedinjenja su prisutna u skoro svakoj klasi biomolekula uključujući alkaloide, terpene, aminokiseline, flavonoide, steroide, i masne kiselines.[2][4] Organohloridi, uključujući dioksine, se formiraju na visokim temperaturama tokom šumskih požara. Dioksinis su nađeni u pepelu požara izazvanih gromom koji predatiraju sintetičke dioksine.[5] Osim toga, mnoštvo jednostavnih hlorinisanih ugljovodonika uključujući dihlorometan, hloroform, i ugljentetrahlorid su izolovani iz morskih algi.[6] Najveći deo hlorometana u životnoj sredini se formira prirodno putem biološke dekompozicije, šumskih požara, i rada vulkana.[7]
Prirodni organohlorid epibatidin, alkaloid izolovan iz žaba, ima potentno analgetsko dejstvo i stimuliše istraživanja novih lekova za tretman bola. (Žabe dobijaju epibatidin putem ishrane i zatim ga sekvestriraju na kožu. Mogući prehrambeni izvori su bube, mravi, gnjide, i muve.[8])
Priprema
[уреди | уреди извор]Polazeći od hlora
[уреди | уреди извор]Alkani i arilni alkani se mogu hlorinisati koristeći reakcione uslove reakcija slobodnih radikala, kao što je UV svetlo. Međutim, teško je kontrolisati do koje mere dolazi do hlorinacije. Arilni hloridi se mogu pripremiti putem Fridel-Kraftsove halogenacije, koristeći hlor i Luisovu kiselinu kao katalizator.[9]
Haloformna reakcija, u kojoj se koriste hlor i natrijum hidroksid, isto tako može da proizvede alkil halide iz metil ketona, i srodnih jedinjenja. Hloroform se nekad proizvodio na taj način.
Hlor se može dodati u višestruke veze alkena i alkina, čime se formiraju di- ili tetra-hloro jedinjenja.
Reakcije sa hlorovodonikom
[уреди | уреди извор]Alkeni reaguju sa hlorovodonikom (HCl), čime se formiraju alkil hloridi. Na primer, industrijska proizvodnja hloroetana se odvija putem reakcije etilena sa HCl:
- H2C=CH2 + HCl → CH3CH2Cl
U oksihlorinaciji se koristi hlorovodonik umesto skupljeg hlora za istu svrhu:
- CH2=CH2 + 2 HCl + 1⁄2 O2 → ClCH2CH2Cl + H2O.
Sekundarni i tercijarni alkoholi reaguju sa hlorovodonikom i formiraju korespondirajuće hloride. U laboratorijskim uslovima se koristi srodna reakcija u kojoj učestvuje cink hlorid u koncentrovanoj hlorovodoničnoj kiselini:
Ova smeša, koja se naziva Lukasovim reagensom, je nekad je korišćena u kvalitativnoj organskoj analizi za klasifikaciju alkohola.
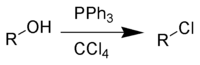
Drugi agensi za hlorinaciju
[уреди | уреди извор]Alkil hloridi se najlakše pripremaju putem tretiranja alkohola sa tionil hloridom (SOCl2) ili fosfor pentahloridom (PCl5), mada isto tako sa sumpor hloridom (SO2Cl2) i fosfor trihloridom (PCl3):
- ROH + SOCl2 → RCl + SO2 + HCl
- 3 ROH + PCl3 → 3 RCl + H3PO3
- ROH + PCl5 → RCl + POCl3 + HCl
U laboratorijskim uslovima, tionil hlorid je posebno podesan, zato što su njegovi nusproizvodi gasoviti. Alternativno se može koristiti Apelova reakcija:
Reakcije
[уреди | уреди извор]Alkil hloridi su svestrani gradivni blokovi u organskoj hemiji. Dok su alkil bromidi i jodidi reaktivniji, alkil hloridi su obično jeftiniji i dostupniji. Alkil hloridi lako podležu napadu nukleofila.
Zagrevanje alkil halida sa natrijum hidroksidom ili vodom daje alkohole. Reakcija sa alkoksidima ili aroksidima daje etre u Vilijamsonovoj etarskoj sintezi; reakcija sa tiolima daje tioetre. Alkil hloridi lako reaguju aminima i daju supstituisane amine. Alkil hloridi bivaju supstituisani težim halidima kao što su jodidi u Finkelstanovoj reakciji. Reakcije sa drugim pseudohalidima kao što su azidi, cijanidi, i tiocijanati su takođe moguće. U prisustvu jake baze, alkil hloridi podležu dehidrohalogenaciji čime se formiraju alkeni ili alkini.
Alkil hloridi reaguju sa magnezijumom i formiraju se Grignardovi reagensi, čime se transformiše elektrofilno u nukleofilno jedinjenje. Vurtzova reakcija reduktivno sparuje dva alkil halida posredstvom natrijuma.
- 2R–X + 2Na → R–R + 2Na+X−
Reference
[уреди | уреди извор]- ^ Metcalf, Robert L. (2000). „Insect Control”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a14_263.
- ^ а б Gribble, Gordon W. (1998). „Naturally Occurring Organohalogen Compounds”. Acc. Chem. Res. 31 (3): 141—152. doi:10.1021/ar9701777.
- ^ Gribble, Gordon W. (1999). „The diversity of naturally occurring organobromine compounds”. Chemical Society Reviews. 28 (5): 335—346. doi:10.1039/a900201d.
- ^ Engvild, Kjeld C. (1986). „Chlorine-Containing Natural Compounds in Higher Plants”. Phytochemistry. 25 (4): 7891—791. doi:10.1016/0031-9422(86)80002-4.
- ^ Gribble, G. W. (1994). „The Natural production of chlorinated compounds”. Environmental Science and Technology. 28 (7): 310A—319A. PMID 22662801. doi:10.1021/es00056a712.
- ^ Gribble, G. W. (1996). „Naturally occurring organohalogen compounds - A comprehensive survey”. Progress in the Chemistry of Organic Natural Products. 68 (10): 1—423. PMID 8795309. doi:10.1021/np50088a001.
- ^ Public Health Statement - Chloromethane, Centers for Disease Control, Agency for Toxic Substances and Disease Registry
- ^ Elizabeth Norton Lasley (децембар 1999). „Having Their Toxins and Eating Them Too Study of the natural sources of many animals' chemical defenses is providing new insights into nature's medicine chest”. BioScience. Oxford Journals. 45 (12): 945—950. Приступљено 06. 05. 2015.
- ^ M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz; Cook, Richard; Beck, Uwe; Lipper, Karl-August; Torkelson, Theodore R.; Löser, Eckhard; Beutel, Klaus K.; Mann, Trevor (2006). „Chlorinated Hydrocarbons”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3-527-30673-0. doi:10.1002/14356007.a06_233.pub2.

![{\displaystyle {\ce {{R-OH}+HCl->[{\ce {ZnCl2}}][\Delta ]\overbrace {R-Cl} ^{alkyl\ halide}+\ {H2O}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/908c64d139abae8fff0d3b7d1f888b3fc9a877ae)