Ароматично једињење

У органској хемији, структуре ароматичних једињења су неуобичајено стабилне. Ароматичност је хемијска особина којом конјуговани прстен незасићених веза, слободних парова, или празних орбитала показује стабилизацију јачу него што би се очекивало као последица саме конјугације. То се такође сматра манифестацијом цикличне делокализације и резонанце.[1][2][3]
Обично се сматра да је то зато што су електрони слободни да се крећу око кружног аранжмана атома који су алтернативно једноструко- и двоструко-везани један за другог. На те везе се може гледати као хибрид једноструких и двоструких веза, где је све веза у прстену идентичне. Овај уобичајени модел ароматичног прстена, заправо идеју да је бензен формиран од шесточланог угленичног прстена са наизменичним једноструким и двоструким везама (циклохексатриен), је развио Фридрих Кекуле. Модел бензена се састоји од две резонантне форме. Бензен је стабилнији молекул него што би се очекивало без узимања у обзир делокализације наелектрисања.
Теорија
[уреди | уреди извор]
Као што је стандардно за резонантне дијаграме, двоглава стрела се користи да се укаже да две структуре нису дистинктни ентитети, него само хипотетичне могућности. Ниједна од њих није прецизна репрезентација стварног једињења, које је најбоље приказано као хибрид (просек) тих структура, што се може видети са леве стране. C=C је краћа од C−C везе, док је бензен перфектно хексагоналан — свих шест угљеник-угљеник веза имају исту дужину, која је између једноструке и двоструке везе.[4][5]
Боља репрезентација је та са циркуларном π везом (Армстронгов унутрашњи круг), у којој је електронска густина равномерно дистрибуирана кроз π-везе изнад и испод прстена. Ова модел коректније представља локацију електронске густине унутар ароматичног прстена.
Једноструке везе су формиране са електронима у линији између два угљеника. Оне се називају σ-везама. Двоструке везе се састоје оф σ-везе и π-везе. π-везе се формирају преклапањем атомских п-орбитала изнад и испод равни прстена. Следећи дијаграм показује позиције тих п-орбитала:

Пошто су оне ван равни атома, те орбитале могу слободно да интерагују једна с другом, и да постану делокализоване. То значи да уместо да су везени за један атом угљеника, сви електрони се дели између свих шест атома у прстену. Пошто, нема довољно електрона да се формирају двоструке везе на свим угљениковим атомима, него "екстра" електрони појачавају све везе прстена подједнако. Резултујућа молекуларска орбитала има π симетрију.

Историја
[уреди | уреди извор]Термин „ароматичан”
[уреди | уреди извор]Прва позанта употреба речи „ароматичан” као хемијског термина, за означавање једињења која садрже фенил групу, јавила се у чланку који је објавио Аугуст Вилхелм Хофман 1855. године.[6][7] Ако је ово заиста најраније увођење термина, занимљиво је да Хофман не каже ниште о разлогу из ког је увео овај придев који указује на мирисно својство за описивање групе хемијских супстанци од којих само неке имају приметне ароме. Исто тако, многе од органских супстанци јаког мириса познатих као терпени, нису ароматична у хемијском смислу. Терпени и бензеноидне супстанце додуше имају заједничке хемијске карактеристике, као што је виши степен незасићености од већине алифатичних једињења, и могуће је да је Хофман желео да направи разлику између те две категорије. Многа рано позната ароматична једињења, као што су бензен и толуен, имала су препознатљиве пријатне мирисе. Ово својство је вероватно довело до тога да се термин „ароматичан” користи за ову класу једињења, и стога термин „ароматичност” за електронско својство које је касније откривено.[8]
Структура бензенског прстена
[уреди | уреди извор]

У 19. веку хемичари су сматрали да је збуњујуће да бензен може бити тако неактиван у погледу реакције адиције, имајући у виду његов претпостављени високи ступањ незасићености. Циклохексатриенску структуру бензена је први предложио Фридрих Кекуле 1865. године.[10][11] Већина хемичара је брзо прихватила ову структуру, јер је она задовољавала већину познатих изомерних односа ароматичне хемије. Хексагонална структура објашњава зашто постоји само један изомер бензена и зашто дисупституисана једињења имају три изомера.[7]
Између 1897. и 1906, Џ. Џ. Томсон, проналазач електрона је предложио три еквивалентна електрона између сваког пара атома угљеника у бензену. Заслуге за објашњавање изузетне стабилности бензена се конвенционално приписују Сер Роберту Робинсону, који је први (1925. године)[12] сковао термин ароматични секстет за групу од шест електрона отпорних на поремећаје.
Заправо, овај концепт се може пратити даље у прошлост, преко Ернеста Крокера из 1922,[13] до Хенрија Едварда Армстронга, који је 1890. године писао „(шест) центричних афинитета делују унутар круга ... бензен се може представити са двоструким прстеном (sic) ... и кад се адитивно једињење формира, унутарњи круг афинитета трпи поремећај, суседни атоми угљика на које ништа није везано нужно стичу етиленско стање”.[14] Овде је Армстронг описивао бар четири модерна концепта. Прво, његов „афинитет” је у данашње време познатији као електрон, којег је открио само седам година касније Џ. Џ. Томсон. Друго, он описује електрофилну ароматичну супституцију, пролазећи (треће) кроз Веландов интермедијар, у коме је (четврто) конјугација прстена нарушена. Он је увео симбол C центриран на прстену као ознаку за унутрашњи круг, тако антиципирајући нотацију Ериха Клара. Тврди се да је он такође предвидео природу таласне механике, будући да је препознао да његови афинитети имају смер, да нису само тачкасте честице, и да колективно имају дистрибуцију која се може променити увођењем супституената на бензенски прстен (као што се дистрибуција електричног набоја у телу мења кад му се приближава друго тело).
Квантно механичко порекло ове стабилности, или ароматичности, први је моделовао Хикел 1931. године. Он је први раздвојио везујуће електроне у сигма и пи електроне.
Ароматичност једног произвољног ароматичног једињења се може квантитативно мерити помоћу рачунарског метода хемијског померања независног од језгра (енгл. Nucleus-Independent Chemical Shift - NICS)[15] и метода процента ароматичности.[16]
Типови ароматичних једињења
[уреди | уреди извор]Велика већина ароматичних једињења су једињења угљеника, мада та једињења не морају да буди угљоводоници.
Хетероциклична једињења
[уреди | уреди извор]Код хетероцикличних ароматичних једињења (хетероаромата), један или више атома у ароматичном прстену није угљеник. То може да умањи ароматичност прстена, и тако (као што је то случај са фураном) повећа његову реактивност. Други примери су пиридин, пиразин, имидазол, пиразол, оксазол, тиофен, и њихови бензанилисани аналози (нпр. бензимидазол). Ароматаска хретероциклична једињења су хетероциклуси који испуњавају критериј ароматичности:имају планарну структуру, непрекинути низ п електрона, те непаран број парова п електрона у циклусу(двоструке везе и усамљени електронски парови. Најзначајнији су они са 5 или 6 атома у циклусу.
Полициклична једињења
[уреди | уреди извор]Полициклични ароматични угљоводоници су молекули који садрже два или више једноставна ароматична прстена везан путем заједничке везе, и.е. прстени деле два атома. Примери су нафтален, антрацен и фенантрен.
Супституисани ароматици
[уреди | уреди извор]Постоји велики број хемијских једињења која су ароматични прстенови са једним или више везаних супституената. Примери су тринитротолуен (ТНТ), ацетилсалицилна киселина (аспирин), парацетамол, и ДНК нуклеотиди.
Атипична ароматична једињења
[уреди | уреди извор]Ароматичност је исто тако нађена код јона: циклопропенилни катјон (2е систем), циклопентадиенилни ањон (6е систем), тропилијумски јон (6е) и циклооктатетраенски диањон (10е). Ароматичне особине су биле приписане не-бензеноидним једињењима као што је тропон. Гранични случај ароматичних особина поседује класа једињења званих циклофани.
Хетероарени
[уреди | уреди извор]Хетероарени су ароматична једињења, где је најмање једна метиленска или виниленска (-C= или -ЦХ=ЦХ-) група замењена хетероатомом: кисеоником, азотом или сумпором.[17] Примери небензенских једињења са ароматичним својствима су фуран, хетероциклично једињење са петочланим прстеном који укључује један атом кисеоника, и пиридин, хетероциклично једињење са шесточланим прстеном које садржи један атом азота. Угљоводоници без ароматичног прстена називају се алифатичним. Отприлике половина једињења познатих 2000. године описана је као ароматична у извесној мери.[18]



Апликације
[уреди | уреди извор]Ароматична једињења су распрострањена у природи и индустрији. Кључни индустријски ароматични угљоводоници су бензол, толуен, ксилен који се назива БТX. Многи биомолекули имају фенил групе укључујући такозване ароматичне аминокиселине.
Модел бензенског прстена
[уреди | уреди извор]

Бензен, C6Х6, је најмање сложен ароматични угљоводоник, и био је први који је дефинисан као такав.[20] Његову природу везивања први су независно препознали Џозеф Лошмит и Август Кекуле у 19. веку.[20] Сваки атом угљеника у хексагоналном прстену има четири електрона да подели. Један електрон формира сигма везу са атомом водоника, а један се користи у ковалентном везивању за сваки од два суседна угљеника. Ово оставља шест електрона, подједнако подељених око прстена у делокализованим пи молекуларним орбиталама величине самог прстена.[19] Ово представља шест еквивалентних веза угљеник-угљеник све од којих су 1,5 реда везе. Ова еквиваленција се такође може објаснити резонантним облицима.[19] Електрони су визуализовани као лебдећи изнад и испод прстена, а електромагнетна поља која генеришу делују тако да држе прстен у равни.[19]
Симбол круга за ароматичност увели су сер Роберт Робинсон и његов ученик Џејмс Армит 1925. године, а популаризовали су га почев од 1959. Морисон & Бојд својим уџбеником органске хемије.[21] О правилној употреби симбола се расправља: неке публикације га користе за било који циклични π систем, док га друге користе само за оне π системе који се повињавају Хикеловом правилу. Неки тврде да би, како би се остало у складу са Робинсоновим првобитно изнетим предлогом, употреба симбола круга требало да буде ограничена на моноцикличне 6 π-електронске системе.[22] На овај начин се симбол круга за везу са шест центара са шест електрона може упоредити са Y симболом за двоелектронску трицентарску везу.[22]
Бензен и деривати бензола
[уреди | уреди извор]
Деривати бензена имају од један до шест супституената везаних за централно језгро бензена. Примери једињења бензена са само једним супституентом су фенол, који носи хидроксилну групу, и толуен са метил групом. Када је на прстену присутно више од једног супституента, њихов просторни однос постаје важан за шта су осмишљени обрасци супституције арена орто, мета и пара.[23] Када реагују да би се формирали сложенији деривати бензена, супституенти на бензенском прстену се могу описати као активирани или деактивирани, а то су давање електрона, односно повлачење електрона.[23] Активатори су познати као орто-пара директори, а деактиватори су познати као мета директори.[23] Након реакције, супституенти ће бити додати на орто, пара или мета позицијама, у зависности од усмерености тренутних супституената да би се добили сложенији деривати бензена, често са неколико изомера. Проток електрона који води до реароматизације је кључан у обезбеђивању стабилности таквих производа.[23]
На пример, постоје три изомера за крезол јер се метил група и хидроксилна група (оба орто пара усмеривачи) могу поставити један поред другог (орто), једна позиција размака једно од другог (мета) или две позиције размака једно од другог (пара).[24] С обзиром да су метил и хидроксилна група орто-пара усмеривачи, орто и пара изомери су типично фаворизовани.[24] Ксиленол има две метил групе поред хидроксилне групе, и за ову структуру постоји 6 изомера.
- Репрезентативна једињења арена
Аренски прстенови могу стабилизовати наелектрисања, као што се види, на пример, у фенолу (C6Х5–ОХ), који је кисео на хидроксилу (ОХ), пошто је наелектрисање кисеоника (алкоксид –О−) делимично делокализовано у бензенски прстен.
Небензилни арени
[уреди | уреди извор]Иако су бензил арени уобичајени, небензилна једињења су такође изузетно важна. Свако једињење које садржи циклични део који је у складу са Хикеловим правилом и није дериват бензена може се сматрати небензилним ароматичним једињењем.[19]
Моноциклични арени
[уреди | уреди извор]Од анулена већих од бензена, [12]анулен и [14]анулен су слабо ароматична једињења, а [18]анулен, циклооктадеканонаен је ароматичан, иако напрезање унутар структуре изазива благо одступање од тачно равне структуре неопходне за ароматичну категоризацију.[25] Други пример небензилног моноцикличног арена је циклопропенил (циклопропенијум катјон), који задовољава Хикелово правило са н једнаким 0.[26] Треба имати на уму да је само катјонски облик овог цикличног пропенила ароматичан, с обзиром да би неутралност у овом једињењу прекршила било октетно правилок или Хикелово правило.[26]
Други небензилни моноциклични арени укључују горепоменуте хетероарене који могу заменити атоме угљеника другим хетероатомима као што су Н, О или С.[19] Уобичајени примери су шесточлани пирол и петочлани пиридин, од којих оба имају супституисани азот.[27]
Полициклични ароматични угљоводоници
[уреди | уреди извор]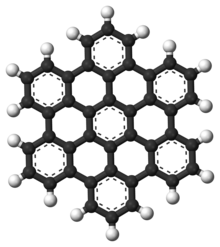
Полициклични ароматични угљоводоници, такође познати као полинуклеарна ароматична једињења (ПАХ) су ароматични угљоводоници који се састоје од кондензованих ароматичних прстенова и не садрже хетероатоме, нити носе супституенте.[28] Нафтален је најједноставнији пример ПАХ-а. ПАХ једињења се јављају у налазиштима нафте, угља и катрана и производе се као нуспроизводи сагоревања горива (било да се ради о фосилном гориву или биомаси).[29] Као загађивачи, они су узрок забринутости јер су нека једињења идентификована као канцерогена, мутагена и тератогена.[30][31][32][33] ПАХ једињења се такође налазе у термичких обрађеној храни.[29] Студије су показале да се високи нивои ПАХ-а налазе, на пример, у месу куваном на високим температурама као што је печење на роштиљу, и у димљеној риби.[29][30] Они су такође добри кандидати за молекуле да делују као основа за најраније облике живота.[34] У графену је ПАХ мотив проширен на велике 2Д листове.[35]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Сцхлеyер, Паул вон Рагуé (2001). „Интродуцтион: Ароматицитy”. Цхемицал Ревиеwс. 101 (5): 1115. ПМИД 11749368. дои:10.1021/цр0103221.
- ^ А. Т. Балабан, П. в. Р. Сцхлеyер анд Х. С. Рзепа (2005). „Цроцкер, Нот Армит анд Робинсон, Бегат тхе Сиx Ароматиц Елецтронс”. Цхемицал Ревиеwс. 105: 3436—3447. дои:10.1021/цр0300946.
- ^ Сцхлеyер, Паул вон Рагуé (2005). „Интродуцтион: ДелоцализатионПи анд Сигма”. Цхемицал Ревиеwс. 105: 3433. дои:10.1021/цр030095y.
- ^ „Бондинг ин бензене – тхе Кекулé струцтуре”. www.цхемгуиде.цо.ук. Приступљено 25. 12. 2015.
- ^ „Цхемицал Реацтивитy”. www2.цхемистрy.мсу.еду. Приступљено 25. 12. 2015.
- ^ Хофманн, А. W. (1855). „Он Инсолиниц Ацид”. Процеедингс оф тхе Роyал Социетy. 8: 1—3. дои:10.1098/рспл.1856.0002.
- ^ а б Роцке, А. Ј. (2015). „Ит Беган wитх а Даyдреам: Тхе 150тх Анниверсарy оф тхе Кекулé Бензене Струцтуре”. Ангеw. Цхем. Инт. Ед. 54: 46—50. ПМИД 25257125. дои:10.1002/ание.201408034.
- ^ МцМуррy, Јохн (2007). Органиц Цхемистрy (7тх изд.). Броокс-Цоле. стр. 515. ИСБН 978-0-495-11258-7.
- ^ Кекулé, Ф. А. (1872). „Уебер еиниге Цонденсатионспродуцте дес Алдехyдс”. Лиебигс Анн. Цхем. 162 (1): 77—124. дои:10.1002/јлац.18721620110.
- ^ Кекулé, Ф. А. (1865). „Сур ла цонститутион дес субстанцес ароматиqуес”. Буллетин де ла Социете Цхимиqуе де Парис. 3: 98—110.
- ^ Кекулé, Ф. А. (1866). „Унтерсуцхунген üбер ароматисцхе Вербиндунген Уебер дие Цонститутион дер ароматисцхен Вербиндунген. I. Уебер дие Цонститутион дер ароматисцхен Вербиндунген”. Лиебигс Анн. Цхем. 137 (2): 129—196. дои:10.1002/јлац.18661370202.
- ^ Армит, Јамес Wилсон; Робинсон, Роберт (1925). „ЦЦXИ. Полyнуцлеар хетероцyцлиц ароматиц тyпес. Парт II. Соме анхyдрониум басес”. Ј. Цхем. Соц. Транс. 127: 1604—1618. дои:10.1039/ЦТ9252701604.
- ^ Цроцкер, Ернест C. (1922). „Апплицатион Оф Тхе Оцтет Тхеорy То Сингле-Ринг Ароматиц Цомпоундс”. Ј. Ам. Цхем. Соц. 44 (8): 1618—1630. дои:10.1021/ја01429а002.
- ^ Армстронг, Хенрy Едwард (1890). „Тхе струцтуре оф цyцлоид хyдроцарбон”. Проц. Цхем. Соц. 6 (85): 95—106. дои:10.1039/ПЛ8900600095.
- ^ Сцхлеyер, Паул вон Рагуé; Маеркер, Цхристопх; Дрансфелд, Алк; Јиао, Хаијун; Ван Еикема Хоммес, Ницолаас Ј. Р. (1996). „Нуцлеус-Индепендент Цхемицал Схифтс: А Симпле анд Еффициент Ароматицитy Пробе”. Ј. Ам. Цхем. Соц. 118 (26): 6317—6318. дои:10.1021/ја960582д.
- ^ Муцси, З.; Висколцз, Б.; Цсизмадиа, I. Г. (2007). „А Qуантитативе Сцале фор тхе Дегрее оф Ароматицитy анд Антиароматицитy”. Ј. Пхyс. Цхем. А. 111 (6): 1123—1132. Бибцоде:2007ЈПЦА..111.1123М. ПМИД 17286363. дои:10.1021/јп0657686.
- ^ ИУПАЦ. Цомпендиум оф Цхемицал Терминологy, 2нд ед. (тхе "Голд Боок"). Цомпилед бy А. D. МцНаугхт анд А. Wилкинсон. Блацкwелл Сциентифиц Публицатионс, Оxфорд (1997). Онлине версион (2019-) цреатед бy С. Ј. Цхалк. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ^ Балабан, Алеxандру Т.; Онициу, Даниела C.; Катритзкy, Алан Р. (2004-05-01). „Ароматицитy ас а Цорнерстоне оф Хетероцyцлиц Цхемистрy”. Цхемицал Ревиеwс (на језику: енглески). 104 (5): 2777—2812. ИССН 0009-2665. ПМИД 15137807. дои:10.1021/цр0306790.
- ^ а б в г д ђ е ж з и ј Клеин, Давид Р. (2017). Органиц Цхемистрy (3рд изд.). Јохн Wилеy & Сонс. ИСБН 9781119444251.
- ^ а б „Бензене | Дефинитион, Дисцоверy, Струцтуре, Пропертиес, & Усес | Британница”. www.британница.цом (на језику: енглески). Приступљено 2023-11-06.
- ^ Армит, Јамес Wилсон; Робинсон, Роберт (1925). „ЦЦXИ.—Полyнуцлеар хетероцyцлиц ароматиц тyпес. Парт II. Соме анхyдрониум басес”. Ј. Цхем. Соц., Транс. (на језику: енглески). 127: 1604—1618. ИССН 0368-1645. дои:10.1039/ЦТ9252701604.
- ^ а б Јенсен, Wиллиам Б. (април 2009). „Тхе Оригин оф тхе Цирцле Сyмбол фор Ароматицитy”. Јоурнал оф Цхемицал Едуцатион (на језику: енглески). 86 (4): 423. Бибцоде:2009ЈЦхЕд..86..423Ј. ИССН 0021-9584. дои:10.1021/ед086п423.
- ^ а б в г „16.5: Ан Еxпланатион оф Субституент Еффецтс”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2015-05-03. Приступљено 2023-12-03.
- ^ а б „Цресол - ан овервиеw | СциенцеДирецт Топицс”. www.сциенцедирецт.цом. Приступљено 2023-12-03.
- ^ „Wхат доес "ароматиц" реаллy меан?”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2013-10-02. Приступљено 2023-11-06.
- ^ а б „Wхат доес "ароматиц" реаллy меан?”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2013-10-02. Приступљено 2023-11-29.
- ^ „4.2: Цовалент Бондс”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2020-07-30. Приступљено 2023-11-06.
- ^ Фетзер, Јохн C. (2007-04-16). „ТХЕ ЦХЕМИСТРY АНД АНАЛYСИС ОФ ЛАРГЕ ПАХс”. Полyцyцлиц Ароматиц Цомпоундс (на језику: енглески). 27 (2): 143—162. ИССН 1040-6638. С2ЦИД 97930473. дои:10.1080/10406630701268255.
- ^ а б в "Полyцyцлиц Ароматиц Хyдроцарбонс – Оццурренце ин фоодс, диетарy еxпосуре анд хеалтх еффецтс" (ПДФ). Еуропеан Цоммиссион, Сциентифиц Цоммиттее он Фоод. Децембер 4, 2002. Арцхивед (ПДФ) фром тхе оригинал он 2022-10-09.
- ^ а б Ларссон, Боннy К.; Сахлберг, Грегер П.; Ерикссон, Андерс Т.; Буск, Леиф А. (јул 1983). „Полyцyцлиц ароматиц хyдроцарбонс ин гриллед фоод”. Јоурнал оф Агрицултурал анд Фоод Цхемистрy (на језику: енглески). 31 (4): 867—873. ИССН 0021-8561. ПМИД 6352775. дои:10.1021/јф00118а049.
- ^ Сциентифиц Опинион оф тхе Панел он Цонтаминантс ин тхе Фоод Цхаин он а реqуест фром тхе Еуропеан Цоммиссион он Марине Биотоxинс ин Схеллфисх – Саxитоxин Гроуп. Тхе ЕФСА Јоурнал (2009) 1019, 1-76.
- ^ Кеитх, Лаwренце Х. (2015-03-15). „Тхе Соурце оф У.С. ЕПА'с Сиxтеен ПАХ Приоритy Поллутантс”. Полyцyцлиц Ароматиц Цомпоундс (на језику: енглески). 35 (2–4): 147—160. ИССН 1040-6638. дои:10.1080/10406638.2014.892886.
- ^ Тхомас, Пхилиппе Ј.; Неwелл, Емилy Е.; Еццлес, Кристин; Холлоwаy, Алисон C.; Идоwу, Ифеолуwа; Xиа, Зхе; Хассан, Елизабетх; Томy, Грегг; Qуенневилле, Цхерyл (2021-02-01). „Цо-еxпосурес то траце елементс анд полyцyцлиц ароматиц цомпоундс (ПАЦс) импацтс Нортх Америцан ривер оттер (Лонтра цанаденсис) бацулум”. Цхемоспхере. 265: 128920. ИССН 0045-6535. дои:10.1016/ј.цхемоспхере.2020.128920
 .
.
- ^ Ехренфреунд, Пасцале; Расмуссен, Стеен; Цлеавес, Јамес; Цхен, Лиаохаи (јун 2006). „Еxперименталлy Трацинг тхе Кеy Степс ин тхе Оригин оф Лифе: Тхе Ароматиц Wорлд”. Астробиологy (на језику: енглески). 6 (3): 490—520. Бибцоде:2006АсБио...6..490Е. ИССН 1531-1074. ПМИД 16805704. дои:10.1089/аст.2006.6.490.
- ^ Wанг, Xиао-Yе; Yао, Xуелин; Мüллен, Клаус (2019-09-01). „Полyцyцлиц ароматиц хyдроцарбонс ин тхе грапхене ера”. Сциенце Цхина Цхемистрy (на језику: енглески). 62 (9): 1099—1144. ИССН 1869-1870. С2ЦИД 198333072. дои:10.1007/с11426-019-9491-2
 . хдл:21.11116/0000-0004-Б547-0
. хдл:21.11116/0000-0004-Б547-0  .
.
Литература
[уреди | уреди извор]- Р.L. Схринер; C.К.Ф. Херманн; Т.C. Моррилл; D.Y. Цуртин & Р.C. Фусон Јохн (1997). Тхе Сyстематиц Идентифицатион оф Органиц Цомпоундс. Wилеy & Сонс. ИСБН 978-0-471-59748-3.
- Рицхард Ф. & Далеy, Саллy Ј. Органиц Цхемистрy, Онлине органиц цхемистрy теxтбоок.
- Робертс, Јохн D.; Цасерио, Марјорие C. (1964). Басиц Принциплес оф Органиц Цхемистрy. W. А. Бењамин, Инц.
- Стреитwиесер, Андреw; Хеатхцоцк, Цлаyтон Х.; Косоwер, Едwард M. (2017). Интродуцтион то Органиц Цхемистрy. Неw Делхипагес=3–4: Медтецх (Сциентифиц Интернатионал, репринт оф ревисед 4тх едитион, Мацмиллан, 1998). ИСБН 978-93-85998-89-8.
- Хенрy Марсхалл Леицестер; Херберт С. Клицкстеин (1951). А Соурце Боок ин Цхемистрy, 1400-1900. Харвард Университy Пресс. стр. 309.
- Ницолаоу, К.C.; Соренсен, Е.Ј. (1996). Цлассицс ин Тотал Сyнтхесис: Таргетс, Стратегиес, Метходс. Wилеy. ИСБН 978-3-527-29231-8.
Спољашње везе
[уреди | уреди извор]- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal – Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Khanacademy.org, Khan Academy - Organic Chemistry