Тропинон

| |

| |
| Називи | |
|---|---|
| IUPAC назив
8-Metil-8-azabiciklo[3.2.1]oktan-3-on
| |
| Други називи
3-Тропинон
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.007.756 |
| |
| Својства | |
| C8H13NO | |
| Моларна маса | 139,195 g/mol |
| Агрегатно стање | Смеђа чврста материја |
| Тачка топљења | 425 °C (797 °F; 698 K) |
| Тачка кључања | (razlaže se) |
| Opasnosti | |
| NFPA 704 | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Тропинон је алкалоид. Роберт Робинсон је 1917. извео чувену синтезу тропинона. Он је синтетички прекурзор атропина, дефицитарне робе током Првог светског рата.[3][4] Тропинон и алкалоиди кокаин и атропин имају заједничку тропанску основу.
Синтеза
[уреди | уреди извор]Прву синтезу тропинона је извео Ришард Вилстатер 1901. Почетни материјал је био наизглед сродни циклохептанон, али је било потребно много корака да се уведе азотни мост. Свеукупни принос синтезе је само 0,75%.[5] Вилстатер је раније синтетисао кокаин из тропинона, што је била прва синтеза и евалуација структуре кокаина.[6]
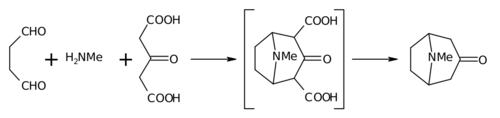
Робинсонова синтеза из 1917 се сматра класиком тоталне синтезе[7] због њене једноставности и биомиметичког приступа. Тропинон је бициклични молекул, док су реактанти за његову припрему релативно једноставни: сукциналдехид, метиламин и ацетондикарбоксилна киселина (или чак ацетон). Синтеза је добар пример биомеметичке реакције зато што биосинтеза користи исте градивне блокове. Она такође демонстрира тандем реакцију, синтезу у једној посуди. Принос синтезе је 17%, а са каснијим побољшањима премашује 90%.[5]
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Робинсон Р. (1917). „ЛXИИИ.?А сyнтхесис оф тропиноне”. Јоурнал оф тхе Цхемицал Социетy, Трансацтионс. 111: 762—768. дои:10.1039/ЦТ9171100762.
- ^ Ницолаоу К. C.; Воурлоумис, D.; Wинссингер Н.; Баран П. С. (2000). „Тхе Арт анд Сциенце оф Тотал Сyнтхесис ат тхе Даwн оф тхе Тwентy-Фирст Центурy”. Ангеwандте Цхемие Интернатионал Едитион. 39 (1): 44. ПМИД 10649349. дои:10.1002/(СИЦИ)1521-3773(20000103)39:1<44::АИД-АНИЕ44>3.0.ЦО;2-L.
- ^ а б „Органиц Сyнтхесис”. 1998. ИСБН 978-0-85404-544-0. дои:10.1039/9781847551573.
- ^ Хумпхреy А. Ј.; О'Хаган D. (2001). „Тропане алкалоид биосyнтхесис. А центурy олд проблем унресолвед”. Натурал Продуцт Репортс. 18 (5): 494—502. ПМИД 11699882. дои:10.1039/б001713м.
- ^ Бирцх А. Ј. (1993). „Инвестигатинг а Сциентифиц Легенд: тхе Тропиноне Сyнтхесис оф Сир Роберт Робинсон, Ф.Р.С”. Нотес анд Рецордс оф тхе Роyал Социетy оф Лондон (1938-1996). 47 (2): 277—226. ЈСТОР 531792. дои:10.1098/рснр.1993.0034.
Спољашње везе
[уреди | уреди извор]- МСДС за тропинон Архивирано на веб-сајту Wayback Machine (18. октобар 2020)
- Разне синтетичке процедуре тропинона