Glukoza
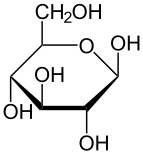
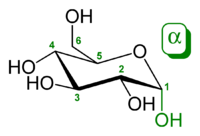 α-d-glukopiranoza (oblik stolice)
| |
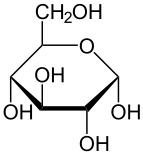
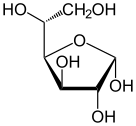
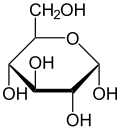 Havortova projekcija α-d-glukopiranoze
| |
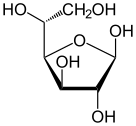
 Fišerova projekcija d-glukoze
| |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv
D-Glukoza | |
| Sistemski IUPAC naziv
(2R,3S,4R,5R)-2,3,4,5,6-Pentahidroksiheksanal | |
| Drugi nazivi
Krvni šećer
Dekstroza d-Glukoza Grožđani šećer | |
| Identifikacija | |
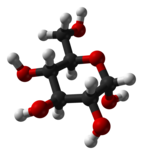
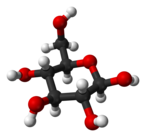
3D model (Jmol)
|
|
| 3DMet | B01203 |
| Abrevijacija | Glc |
| Bajlštajn | 1281604 |
| ChEBI | |
| ChemSpider | |
| EC broj | 200-075-1 |
| Gmelin Referenca | 83256 |
| KEGG[1] | |
| MeSH | Glucose |
| RTECS | LZ6600000 |
| UNII | |
| |
| |
| Svojstva | |
| C6H12O6 | |
| Molarna masa | 180,16 g·mol−1 |
| Agregatno stanje | Beli prah |
| Gustina | 1,54 g/cm3 |
| Tačka topljenja | α-d-glukoza: 146 °C (295 °F; 419 K) β-d-glukoza: 150°C (302°F; 423 K) |
| 909 g/L (25 °C (77 °F)) | |
| Magnetna susceptibilnost | −101,5×10−6 cm³/mol |
| Dipolni moment | 8,6827 |
| Termohemija | |
| Specifični toplotni kapacitet, C | 218,6 J K−1 mol−1[4] |
Standardna molarna
entropija (S |
209,2 J K−1 mol−1[4] |
Standardna entalpija
stvaranja (ΔfH |
−1271 kJ/mol[5] |
| 2.805 kJ/mol (670 kcal/mol) | |
| Farmakologija | |
| B05CX01 (WHO) V04CA02, V06DC01 | |
| Opasnosti | |
| Bezbednost prilikom rukovanja | ICSC 08655 |
| NFPA 704 | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Glukoza (od grč. γλυκύς — „sladak”) je najrasprostranjeniji monosaharid u prirodi,[6] međutim samo kao izomer koji se zove dekstroza ili grožđani šećer.[7] Može da se nađe u krvi svih sisara, kao i u medu i grožđu. Molekuli složenijih ugljenih hidrata, kao što su skrob i celuloza, nastaju od velikog broja molekula glukoze.[8] Glukoza ima vrlo sladak ukus, lako je rastvorljiva u vodi, a takođe je i neophodna za održavanje života, jer kad se razgradi u citoplazmi žive ćelije oslobađa velike količine energije potrebne za mnoge životne funkcije.
Glukozu uglavnom prave biljke i većina algi tokom fotosinteze iz vode i ugljen-dioksida, koristeći energiju sunčeve svetlosti. Ona se koristi za izradu celuloze u ćelijskim zidovima, koja je najzastupljeniji ugljeni hidrat.[9] U energetskom metabolizmu, glukoza je najvažniji izvor energije u svim organizmima. Glukoza za metabolizam se delimično čuva kao polimer, u biljkama uglavnom kao skrob i amilopektin, a kod životinja kao glikogen. Glukoza cirkuliše u krvi životinja kao šećer u krvi. Prirodno prisutan oblik glukoze je d-glukoza, dok je l-glukoza sintetički proizvedena u relativno malim količinama i manje je važna.
Glukoza, kao intravenski šećerni rastvor, nalazi se na spisku esencijalnih lekova Svetske zdravstvene organizacije, najvažnijih lekova neophodnih u osnovnom zdravstvenom sistemu.[10] Ime glukoza potiče preko francuskog izraza iz grčke reči γλυκός (glukós), sa značenjem „sladak”, u smislu šire, slatke, sveže ispresovane mase grožđa u pravljenju vina.[11][12] Sufiks „-oza” je hemijski klasifikator, koji označava šećer.
Istorija
[uredi | uredi izvor]Glukozu je prvi put izolovao nemački hemičar iz Andreas Margraf iz suvog grožđa 1747. godine.[13][14] Johan Tobijas Lovic je otkrio glukozu u grožđu 1792. godine i prepoznao je da se razlikuje od šećera iz šećerne trske (saharoze). Naziv glukoza je skovao Žan-Batist Duma 1838. godine, i taj naziv je prevladao u hemijskoj literaturi. Fridrih Kekule je predložio termin dekstroza (od lat. dexter — „desno”), jer u vodenim rastvorima glukoze, ravan linearno polarizovane svetlosti biva zakrenuta nadesno. U kontrastu s tim, d-fruktoza (ketoheksoza) i l-glukoza zaokreću linearno polarizovanu svetlost nalevo. Najranija notacija prema rotaciji ravni linearno polarizovane svetlosti (d i l-nomenklatura) je kasnije napuštena u korist d- i l-notacije, koja odražava apsolutne konfiguracije asimetričnog centra najudaljenijeg od karbonilne grupe, i u saglasnosti sa konfiguracijom d- ili l-gliceraldehida.[15][16]
Pošto je glukoza osnovna potreba mnogih organizama, pravilno razumevanje njenog hemijskog sastava i strukture uveliko je doprinelo opštem napretku u organskoj hemiji. Do ovog razumevanja je uglavnom došlo kao rezultat istraživanja nemačkog hemičara Emila Fišera, koji je za svoja otkrića primio Nobelovu nagradu za hemiju 1902. godine.[17] Sinteza glukoze uspostavila je strukturu organskog materijala i konsekventno formirala prvu definitivnu validaciju Jakobus Henrikus van’t Hofovih teorija o hemijskoj kinetici i rasporedu hemijskih veza u molekulima koji sadrže ugljenik.[18] Između 1891 i 1894, Fišer je uspostavio stereohemijsku konfiguraciju svih poznatih šećera i korektno je predvideo moguće izomere, primenjujući van't Hofovu teoriju asimetričnih atoma ugljenika. Imena su se u početku odnosila na prirodne supstance. Njihovi enantiomeri su dobili isto ime sa uvođenjem sistematskih nomenklatura, uzimajući u obzir apsolutnu stereohemiju (npr. Fišerova nomenklatura, d/l nomenklatura).
Za otkriće metabolizma glukoze Oto Fric Majerhof je dobio Nobelovu nagradu za fiziologiju ili medicinu 1922. godine.[19] Hans fon Ojler-Helpin je nagrađen Nobelovom nagradom za hemiju zajedno sa Arturom Hardenom 1929. godine za njihova „istraživanja fermentacije šećera i učešća enzima u tom procesu”.[20][21] Godine 1947, Bernardo Housaj (za njegovo otkriće uloge hipofize u metabolizmu glukoze i izvedenih ugljenih hidrata) kao i Karl i Gerti Kori (za njihovo otkriće konverzije glikogena u glukozu) dobili su Nobelovu nagradu za fiziologiju i medicinu.[22][23][24] Godine 1970, Luis Leluar je nagrađen Nobelovom nagadom za hemiju za otkriće iz glukoze izvedenih šećernih nukleotida u biosintezi ugljenih hidrata.[25]
Hemijske osobine
[uredi | uredi izvor]Sa svojih šest atoma ugljenika, glukoza se klasifikuje kao heksoza, potkategorija monosaharida. d-Glukoza je jedan od šesnaest stereoizomera aldoheksoznih stereoizomera. d-izomer, d-glukoza, takođe poznata kao dekstroza, široko je zastupljena u prirodi, dok l-izomer, l-glukoza, nije. Glukoza se može dobiti hidrolizom ugljenih hidrata kao što su mlečni šećer (laktoza), trščani šećer (saharoza), maltoza, celuloza, glikogen, itd. Obično se komercijalno proizvodi od kukuruznog skroba hidrolizom putem uparavanja pod pritiskom uz kontrolisani pH, čemu sledi dalja enzimatska depolimerizacija.[26] Nevezana glukoza je jedan od glavnih sastojaka meda. Sve forme glukoze su bezbojne i lako se rastvaraju u vodi, sirćetnoj kiselini, i nekoliko drugih rastvarača. One su veoma maloj meri rastvorne u metanolu i etanolu.
Struktura i nomenklatura
[uredi | uredi izvor]
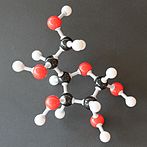
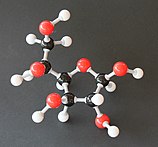
Glukoza je monosaharid sa formulom C6H12O6 ili H-(C=O)-(CHOH)5-H, čijih pet hidroksilnih (OH) grupa su raspoređene na specifičan način duž njenih šest-ugljenika u lancu. Glukoza je obično prisutna u čvrstoj formi kao monohidrat sa zatvorenim piranskim prstenom (dekstroza hidrat). U vodenom rastvoru, s druge strane, ona je otvorenog lanca u maloj meri i prisutna je pretežno kao α- ili β-piranoza, koji se delimično međusobno spajaju mutarotacijom. Iz vodenih rastvora, mogu se kristalisati tri poznata oblika: α-glukopiranoza, β-glukopiranoza i β-glukopiranozni hidrat.[8] Glukoza je gradivni blok disaharida laktoze i saharoze (šećera iz trske ili repe), oligosaharida kao što je rafinoza i polisaharida kao što su skrob i amilopektin, glikogen ili celuloza. Temperatura staklene tranzicije glukoze je 31 °C, a Gordon-Tejlorova konstanta (eksperimentalno određena konstanta za predviđanje temperature glasne tranzicije za različite masene frakcije smeše dve supstance)[27] je 4,5.[28]
| Poređenje različitih formi i projekcija d-glukoze | ||
|---|---|---|
| Nata projekcija | Havortova projekcija | |

|
 α-d-glukofuranoza |
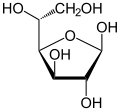 β-d-glukofuranoza |
 α-d-glukopiranoza |
 β-d-glukopiranoza | |
| α-d-Glukopiranoza u (1) Tolens/Fišerovoj- (2) Havortova projekcija (3) konformacija stolice (4) stereohemijski prikaz | ||

| ||
Forma s otvorenim lancem
[uredi | uredi izvor]
U svojoj nepostojanoj formi otvorenog lanca, molekul glukoze ima otvorenu (za razliku od ciklične) i nerazgranatu osnovu sa šest atoma ugljenika, C-1 do C-6; gde je C-1 deo aldehidne grupe H(C=O)-, a svaki od ostalih pet ugljenika nosi jednu hidroksilnu grupu -OH. Preostale veze ugljenične osnove su zadovoljene atomima vodonika -H. Stoga je glukoza heksoza i aldoza, ili aldoheksoza. Aldehidna grupa čini glukozu redukujućim šećerom dajući joj pozitivnu reakciju sa Felingovim reagensom.
Svaki od četiri ugljenika C-2 do C-5 je stereocentar, što znači da su njegove četiri veze povezane sa četiri različita supstituenta. (Ugljenik C-2, na primer, povezan je sa -(C=O)H, -OH, -H, i -(CHOH)4H.) U d-glukozi, ova četiri dela moraju da budu u specifičnom trodimenzionalnom aranžmanu. Naime, kad se prikazuje molekul u Fišerovoj projekciji, hidroksili na C-2, C-4, i C-5 moraju da budu s desne strane, dok onaj na C-3 mora da bude na levoj strani.
Pozicije ta četiri hidroksida su tačno obrnute u Fišerovom dijagramu l-glukoze. d- i l-glukoze su dva od 16 mogućih aldoheksoza; drugih 14 su aloza, altroza, galaktoza, guloza, idoza, manoza, i taloza, sa dva enantiomera, “d-” i “l-”.
Važno je napomenuti da linearni oblik glukoze čini manje od 0,02% molekula glukoze u vodenom rastvoru. Ostatak je jedan od dva ciklična oblika glukoze koji nastaju kada se hidroksilna grupa na ugljeniku 5 (C5) veže za aldehidni ugljenik 1 (C1).
Ciklična forma
[uredi | uredi izvor].
Sleva nadesno: Havortove projekcije i kuglično-štapne strukture α- i β- anomera D-glukopiranoze (gornji red) i D-glukofuranoze (donji red)
U rastvorima, forma glukoze sa otvorenim lancom (bilo „D-” ili „L-”) postoji u ravnoteži sa nekoliko cikličnih izomera, svaki sadrži prsten ugljenika zatvoren jednim atomom kiseonika. Međutim, u vodenom rastvoru, više od 99% molekula glukoze, u bilo kom trenutku, postoje kao piranozni oblici. Forma otvorenog lanca je ograničena na oko 0,25%, a furanozni oblici postoje u zanemarljivim količinama. Izrazi „glukoza” i „D-glukoza” se generalno koriste za ove ciklične oblike. Prsten nastaje iz forme otvorenog lanca intramolekularnom nukleofilnom adicionom reakcijom između aldehidne grupe (na C-1) i bilo C-4 ili C-5 hidroksilne grupe, formirajući hemiacetalnu vezu, -C(OH)H-O-.
Tromerov reagens
[uredi | uredi izvor]Reagens za dokazivanje glukoze zove se Tromerov reagens. To je bazni rastvor bakar(II)-sulfata. U dodiru s glukozom nastaje crvenkasto-smeđi talog.
Izvori
[uredi | uredi izvor]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b Boerio-Goates, Juliana (1991), „Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K”, J. Chem. Thermodynam., 23 (5): 403—09, Bibcode:1991JChTh..23..403B, doi:10.1016/S0021-9614(05)80128-4
- ^ Ponomarev, V. V.; Migarskaya, L. B. (1960), „Heats of combustion of some amino-acids”, Russ. J. Phys. Chem. (Engl. Transl.), 34: 1182—83
- ^ Domb, Abraham J.; Kost, Joseph; Wiseman, David (4. 2. 1998). Handbook of Biodegradable Polymers. CRC Press. str. 275. ISBN 978-1-4200-4936-7.
- ^ „dextrose”, Merriam-Webster Online Dictionary, 31. 10. 2024, Pristupljeno 2. 9. 2009
- ^ a b Schenck, Fred W. (2006). „Glucose and Glucose-Containing Syrups”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3527306732. doi:10.1002/14356007.a12_457.pub2.
- ^ Kamide, Kenji (2005). Cellulose and Cellulose Derivatives. Elsevier. str. 1. ISBN 978-0-080-45444-3.
- ^ „WHO Model List of Essential Medicines” (PDF). World Health Organization. oktobar 2013. Arhivirano (PDF) iz originala 23. 4. 2014. g. Pristupljeno 22. 4. 2014.
- ^ „Online Etymology Dictionary”. Etymonline.com. Arhivirano iz originala 26. 11. 2016. g. Pristupljeno 25. 11. 2016.
- ^ Thénard, Gay-Lussac, Biot, and Dumas (jul 1838). „Rapport sur un mémoire de M. Péligiot, intitulé: Recherches sur la nature et les propriétés chimiques des sucres”. Comptes rendus. 7: 106—13. Arhivirano iz originala 06. 12. 2015. g.
- ^ Encyclopedia of Food and Health (na jeziku: engleski). Academic Press. 2015. str. 239. ISBN 9780123849533. Arhivirano iz originala 23. 2. 2018. g.
- ^ Marggraf (1747). „Experiences chimiques faites dans le dessein de tirer un veritable sucre de diverses plantes, qui croissent dans nos contrées”. Histoire de l'Académie royale des sciences et des belles-lettres de Berlin: Avec les mémoires pour la même année, tirez des registres de cette Academie. str. 79. Arhivirano iz originala 24. 06. 2016. g. Pristupljeno 15. 06. 2019.
- ^ John F. Robyt (2012). Essentials of Carbohydrate Chemistry. Springer Science & Business Media. str. 7. ISBN 978-1-461-21622-3..
- ^ Rosanoff, M. A. (1906). „On Fischer's Classification of Stereo-Isomers.1”. Journal of the American Chemical Society. 28 (1): 114—121. Bibcode:1906JAChS..28..114R. doi:10.1021/ja01967a014.
- ^ Emil Fischer, Nobel Foundation, Arhivirano iz originala 3. 9. 2009. g., Pristupljeno 2. 9. 2009
- ^ Fraser-Reid, Bert, „van't Hoff's Glucose”, Chem. Eng. News, 77 (39): 8
- ^ „"Otto Meyerhof - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Hans von Euler-Chelpin - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Arthur Harden - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Bernardo Houssay - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Carl Cori - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Gerty Cori - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ „"Luis Leloir - Facts - NobelPrize.org"”. Pristupljeno 5. 9. 2018.. NobelPrize.org..
- ^ "glucose." The Columbia Encyclopedia, 6th ed.. 2015. Encyclopedia.com. 17 Nov. 2015 http://www.encyclopedia.com Arhivirano 2009-04-26 na sajtu Wayback Machine
- ^ Patrick F. Fox (1997). Advanced Dairy Chemistry Volume 3: Lactose, water, salts and vitamins. 3. Springer. str. 316. ISBN 9780412630200., 1992.
- ^ Benjamin Caballero; Paul Finglas; Fidel Toldrá (2016). Encyclopedia of Food and Health. 1. Academic Press. str. 76. ISBN 9780123849533.
Literatura
[uredi | uredi izvor]- Kamide, Kenji (2005). Cellulose and Cellulose Derivatives. Elsevier. str. 1. ISBN 978-0-080-45444-3.
- Encyclopedia of Food and Health (na jeziku: engleski). Academic Press. 2015. str. 239. ISBN 9780123849533. Arhivirano iz originala 23. 2. 2018. g.
- Ullmann Fred W. Schenck (2006). Glucose and Glucose-Containing Syrups in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_457.pub2.