Hipofosforasta kiselina

| |
| |
| Nazivi | |
|---|---|
| IUPAC nazivs
Fosfinska kiselina
dihidridohidroksido- oksidofosfor | |
| Identifikacija | |
| ECHA InfoCard | 100.026.001 |
| MeSH | Hypophosphorous+acid |
| Svojstva | |
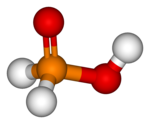
| H3PO2 | |
| Molarna masa | 66,00 g/mol |
| Gustina | 1,274 g/cm³, течност |
| Tačka topljenja | 26.5 °C (299,5 K) |
| Tačka ključanja | 106 °C (379 K) decomp. |
| pomešljiva | |
| Kiselost (pKa) | 1.2 |
| Struktura | |
| Oblik molekula (orbitale i hibridizacija) | pseudo-tetraedarna |
| Opasnosti | |
EU klasifikacija (DSD)
|
not listed |
| Srodna jedinjenja | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Hipofosforasta kiselina je fosforova kiseonična kiselina i vrlo jako redukciono sredstvo formule H3PO2. Neorganski hemičari ovu kiselinu zovu upravo tako (takođe „HPK") iako je IUPAC-ovo ime dihidridohidroksidooksidofosfor ili samo fosfinska kiselina. Ona je bezbojno jedinjenje koje se brzo topi, rastvara u vodi, dioksanu i alkoholima. Formula za hipofosforastu kiselinu je obično H3PO2 ali malo detaljniji zapis bi bio HOP(O)H2 koji pokazuje jednobazni karakter. Soli ove kiseline su fosfinati (hipofosfiti).[1][2]
HOP(O)H2 postoji zajedno sa manjim tautomerom HP(OH)2. Ponekad je taj tautomer tumačen kao hipofosforasta kiselina a glavni kao fosfinska kiselina.
Inače, hipofosforastoj kiselini pripada anhidrid fosfor(III)-oksid. Glavna kiselina u ovoj grupi je fosforasta kiselina.
Dobijanje
[uredi | uredi izvor]Industrijski, ova kiselina se dobija u dva koraka. Hipofosfiti alkalnih metala i zemnoalkalnih metala se dobijaju delovanjem fosfora sa rastvorom određenog hidroksida, npr. Ca(OH)2.
- P4 + 3OH− + 3H2O → 3H2PO2− + PH3
Čista kiselina se priprema delovanjem jakih kiselina na hipofosfitne soli.
- H2PO2− + H+ → H3PO2
Alternativno, H3PO2 se dobija oksidacijom fosfina sa jodom u vodi.
- PH3 + 2I2 + 2H2O → H3PO2 + 4I− + 4H+
Hipofosforasta kiselina je obično dostupna u obliku 50% rastvora.
Primena
[uredi | uredi izvor]Hipofosforasta kiselina se koristi u pravljenju farmaceutskih proizvoda, obezbojavanju polimera i u dobijanju plemenitih ili negvozdenih metala. Glavna upotreba joj je u neelektronom popločavanju. Drugim rečima, u izbacivanju odabranih metalnih premaza na osetljivim površinama. U organskoj hemiji, H3PO2 je najbolje znana po redukciji diazonijumskih soli pretvaranjem ArN2+ u Ar-H.[3][4] Kada je u diazotovanom koncentrovanom rastvoru hipofosforaste kiseline aminski supstituent, on se može ukloniti iz arena, uglavnom alkil-arena.
Neorganski i organski derivati
[uredi | uredi izvor]Razni derivati su poznati kod dva vodonikova atoma direktno vezana za fosfor jer mogu biti zamenjeni raznim organskim grupama. Ovi derivati su poznati pod nazivom fosfinskih kiselina a njihove soli pod nazivom fosfinata. Na primer, formaldehid i H3PO2 reaguju da bi dali (HOCH2)2PO2H. Proizvod reakcije je srodan onom kod dodavanja tiola i HCN aldehidima. Slično tome, dodaje se na Majklove primaoce, npr. sa akrilamidom daje H(HO)P(O)CH2CH2C(O)NH2.
Par kompleksa metala su nastali od H3PO2 a jedan primer je Ni(O2PH2)2.
Референце
[uredi | uredi izvor]- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0911910131.
- ^ Robison, M. M.; Robison, B. L. (1956). "2,4,6-Tribromobenzoic acid Arhivirano na sajtu Wayback Machine (30. septembar 2007)". Org. Synth. 36:94; Coll. Vol. 4:947.
- ^ Kornblum, N. (1941). "3,3'-Dimethoxybiphenyl and 3,3'-dimethylbiphenyl Arhivirano na sajtu Wayback Machine (30. septembar 2007)". Org. Synth. 21:30; Coll. Vol. 3:295.
Literatura
[uredi | uredi izvor]- ChemicalLand21 Listing
- D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" Elsevier: Amsterdam. (5th изд.). ISBN 978-0-444-89307-9..
- V. V. Popik, A. G. Wright, T. A. Khan, J. A. Murphy "Hypophosphorous Acid" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. . doi:10.1002/047084289. Недостаје или је празан параметар
|title=(помоћ). - D.W.Rich, M.C. Smith, Electroless Deposition of Nickel, Cobalt & Iron. IBM Corporation, Poughkeepsie, NY(1971)
