Živa(I) nitrat
Изглед
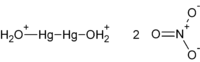
| |
| Nazivi | |
|---|---|
| IUPAC naziv
Živa(I) nitrat
| |
| Drugi nazivi
Živin nitrat
| |
| Identifikacija | |
| ECHA InfoCard | 100.202.814 |
| Svojstva | |
| Hg2(NO3)2 (anhydrous) Hg2(NO3)2·2H2O (dihydrate) | |
| Molarna masa | 525,19 g/mol (anhidrat) 561,22 g/mol (dihidrat) |
| Agregatno stanje | Beli kristali (anhidrat) bezvojni kristali (dihidrat) |
| Gustina | ? g/cm3 (anhidrat) 4,8 g/cm3 (dihidrat) |
| Tačka topljenja | ? (anhidrat) razlaže se na 70°C (dihidrat) |
| neznatno rastvoran, reaktivan | |
| Opasnosti | |
| NFPA 704 | |
| Srodna jedinjenja | |
Drugi anjoni
|
Živa(I) fluorid Živa(I) hlorid Živa(I) bromid Živa(I) jodid |
Drugi katjoni
|
Živa(II) nitrat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Živa(I) nitrat je hemijsko jedinjenje sa formulom Hg2(NO3)2. Ono se koristi u pripremi drugih živa(I) jedinjenja, i poput drugih živinih jedinjenje je toksično.
Reakcije
[уреди | уреди извор]Živa(I) nitrat se formira kombinovanjem žive sa razblaženom azotnom kiselinom (koncentrovana azotna kiselina bi proizvela živa(II) nitrat). Živa(I) nitrat je redukujući agens koji se oksiduje u kontaktu sa vazduhom.
Rastvori živa(I) nitrata su kiseli usled spore reakcije sa vodom:
- Hg2(NO3)2 + H2O → Hg2(NO3)(OH) + HNO3
Hg2(NO3)(OH) formira žuti talog.
Ako se rastvor zagreje do ključanja ili izloži svetlosti, živa(I) nitrat podleže reakciji disproporcionacije proizvodeći elementarnu živu i živa(II) nitrat[2]:
- 2Hg2(NO3)2 → Hg + Hg(NO3)2
Reference
[уреди | уреди извор]- ^ Lide, David R. (1998), Handbook of Chemistry and Physics (87 изд.), Boca Raton, FL: CRC Press, стр. 4—45, ISBN 978-0-8493-0594-8
- ^ а б Patnaik, Pradyot (2003), Handbook of Inorganic Chemical Compounds, McGraw-Hill Professional, стр. 573, ISBN 978-0-07-049439-8, Приступљено 20. 7. 2009

