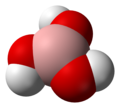
Borna kiselina
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC nazivs
Borna kiselina
Trihidroksidobor | |||
| Drugi nazivi
Ortoborna kiselina,
Borasična kiselina, Sasolit, Optibor, Borofaks | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.030.114 | ||
| E-brojevi | E284 (konzervansi) | ||
| |||
| |||
| Svojstva | |||
| BH3O3 | |||
| Molarna masa | 61,83 g·mol−1 | ||
| Agregatno stanje | Kristal bijele boje | ||
| Gustina | 1,435 g/cm3 | ||
| Tačka topljenja | 1.709 °C (3.108 °F; 1.982 K) | ||
| Tačka ključanja | 300 °C (572 °F; 573 K) | ||
| 2,52 g/100 mL (0°C) 4.72 g/100 mL (20°C) 5.7 g/100 mL (25°C) 19.10 g/100 mL (80°C) 27.53 g/100 mL (100°C) | |||
| Rastvorljivost u other solvents | Rastvorljiva u nižim alkoholima umjereno rastvorljiva u piridinu vrlo malo rastvorljiva u acetonu | ||
| Kiselost (pKa) | 5.2 | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Trigonalno-planarni | ||
| Dipolni moment | Nula | ||
| Opasnosti | |||
EU klasifikacija (DSD)
|
Škodljiva (Xn) Repr. Cat. 2 | ||
| R-oznake | R60 R61 | ||
| S-oznake | S53 S45 | ||
| NFPA 704 | |||
| Tačka paljenja | Nezapaljiva. | ||
| Smrtonosna doza ili koncentracija (LD, LC): | |||
LD50 (srednja doza)
|
2660 mg/kg, oral (rat) | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Bor trioksid Boraks | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Borna kiselina (hemijska formula H3BO3 ili B(OH)3) je supstanca koja spada u slabe neorganske kiseline.[3][4] Postoji u obliku bezbojnih kristala ili bijelog praha i rastvorljiva je u vodi. Može se naći i u mineralnom obliku i tada se naziva sasolit. U prirodi se može naći u nekim vulkanskim oblastima, u sastavu raznih minerala (npr. boraks), u morskoj vodi, u biljkama i voću.[5]
Kristalna struktura
[uredi | uredi izvor]Molekul borne kiseline B(OH)3 je planaran. Atom bora u molekulu borne kiseline je sp2 hibridizovan, tj. tri sp2 hibridne orbitale se nalaze u istoj ravni a ugao između njih je 120°. Bor sa kiseonikom gradi kovalentne veze (posredstvom sp2 orbitala) i zbog toga je cijeli molekul planaran. Borna kiselina se u čvrstom stanju sastoji od slojeva B(OH)3 molekula koje na okupu drži vodonična veza. Rastojanje između dva susjedna sloja je 318 pm.
 |
 |
dovodi da molekuli borne kiseline formiraju paralelne slojeve u čvrstom stanju |
Dobijanje
[uredi | uredi izvor]Borna kiselina se može dobiti u reakciji između boraksa i neke neorganske kiseline, kao npr. hlorovodonične kiseline:
- Na2B4O7·10H2O + 2 HCl → 4 B(OH)3 [или H3BO3] + 2 NaCl + 5 H2O.
Takođe nastaje kao nusproizvod hidrolize bor trihalida i diborana:[6]
- B
2H
6 + 6 H
2O → 2 B(OH)
3 + 6 H
2
- BX
3 + 3 H
2O → B(OH)
3 + 3 HX (X = Cl, Br, I)
Osobine
[uredi | uredi izvor]Piroliza
[uredi | uredi izvor]Borna kiselina je rastvorljiva u ključaloj vodi. Pri zagrevanju iznad 170 °C dolazi do reakcije dehidratacije pri čemu nastaje borična kiselina (HBO2):
- H3BO3 → HBO2 + H2O.
Borična kiselina je bela, kristalna supstanca i delimično je rastvorljiva u vodi. Topi se na 236 °C, a pri zagrevanju preko 300 °C dolazi do dalje dehidratacije, pri čemu se formira tetraborična kiselina ili piroborična kiselina:
- 4 HBO2 → H2B4O7 + H2O.
Daljim zagrevanjem dobija se bor(III)-oksid:
- H2B4O7 → 2 B2O3 + H2O.
Vodeni rastvor
[uredi | uredi izvor]Borna kiselina disosuje u vodenom rastvoru:
- B(OH)3 + H2O ⇌ B(OH)4- + H+ (Ka = 5.8x10−10 mol/l; pKa = 9.24).
Pri tome se borna kiselina ponaša kao Luisova kiselina, tj. reaguje sa molekulom vode i prima elektronski par od OH- grupe, što je čini kiselinom po Luisovoj teoriji. Nagrađeni B(OH)4- jon ima tetraedarski oblik, tj. tetraedarski raspored atomskih grupa oko atoma bora.
U rastvorima sa pH vrednošću 7—10, i ako je koncentracija bora veća od 0,025 mol/L dolazi do stvaranja poliboratnih jona. Najpoznatiji je tetraboratni jon koji se nalazi u mineralu boraksu:
- 4B(OH)4- + 2 H+ ⇌ B4O72- + 9 H2O.
Kada se ortoborna kiselina rastvori u vodi, ona se delimično disocira dajući metabornu kiselinu:
- B(OH)
3 ⇌ HBO
2 + H
2O
Rastvor je blago kiseo zbog jonizacije kiselina:
- B(OH)
3 + H
2O ⇌ [BO(OH)
2]−
+ H
3O+ - HBO
2 + H
2O ⇌ [BO
2]−
+ H
3O+
Međutim, Ramanova spektroskopija jako alkalnih rastvora je pokazala prisustvo [B(OH)
4]−
jona,[7] što je dovelo do zaključka da je kiselost isključivo posledica apstrakcije OH−
iz vode:[7]
- B(OH)
3 + HO−
⇌ B(OH)−
4
Ekvivalentno,
- B(OH)
3 + H
2O ⇌ B(OH)−
4 + H+ (K = 7.3×10−10; pK = 9.14)
Ili, tačnije,
- B(OH)
3 + 2 H
2O ⇌ B(OH)−
4 + H
3O+
Ova reakcija se odvija u dva koraka, sa neutralnim kompleksom akvatrihidroksiborom B(OH)
3(OH
2) kao intermedijerom:[8]
- B(OH)
3 + H
2O → B(OH)
3(OH
2) - B(OH)
3(OH
2) + H
2O + HO−
→ [B(OH)
4]−
+ H
3O+
Ova reakcija se može okarakterisati kao Luisova kiselost bora prema [HO]−
, a ne kao Brenstedova kiselost.[9][10][11] Međutim, neka od njenih ponašanja prema nekim hemijskim reakcijama sugerišu da je to i trobazna kiselina u Brenstedovom smislu.
Borna kiselina, pomešana sa boraksom Na
2B
4O
7·10H2O (tačnije Na
2B
4O
5(OH)
4·8H2O) u težinskom odnosu 4:5, veoma je rastvorljiva u vodi, iako nisu toliko rastvorljivi odvojeno.[12]
Rastvor sumporne kiseline
[uredi | uredi izvor]Borna kiselina se takođe rastvara u bezvodnoj sumpornoj kiselini prema jednačini[13]
- B(OH)
3 + 6 H
2SO
4 → [B(SO
4H)
4]−
+ 2 [HSO
4]−
+ 3 H
3O+
Esterifikacija
[uredi | uredi izvor]Borna kiselina reaguje sa alkoholima i formira boratne estre, B(OR)
3 gde je R alkil ili aril. Reakciju obično pokreće sredstvo za dehidrataciju, kao što je koncentrovana sumporna kiselina:[14]
- B(OH)
3 + 3 ROH → B(OR)
3 + 3 H
2O
Sa vicinalnim diolima
[uredi | uredi izvor]Kiselost rastvora borne kiseline je znatno povećana u prisustvu cis-vicinalnih diola (organska jedinjenja koja sadrže slično orijentisane hidroksilne grupe u susednim atomima ugljenika, (R
1,R
2)=C(OH)−C(OH)=(R
3,R
4)) kao što su glicerol i manitol).[15][13][16]
Tetrahidroksiboratni anjon nastao u rastvaranju spontano reaguje sa ovim diolima da bi se formirao relativno stabilan anjonski estar koji sadrži jedan ili dva petočlana −B−O−C−C−O− prstena. Na primer, reakcija sa manitolom H(HCOH)
6H, čija su dva srednja hidroksila u cis orijentaciji, može se napisati kao
- B(OH)
3 + H
2O ⇌ [B(OH)
4]−
+ H+ - [B(OH)
4]−
+ H(HCOH)
6H ⇌ [B(OH)
2(H(HCOH)
2(HCO−)
2(HCOH)
2H)]−
+ 2 H
2O - [B(OH)
2(H(HCOH)
2(HCO−)
2(HCOH)
2H)]−
+ H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO−)
2(HCOH)
2H)
2]−
+ 2 H
2O
dajući sveukupnu reakciju
- B(OH)
3 + 2 H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO−)
2(HCOH)
2H)
2]−
+ 3 H
2O + H+
Stabilnost ovih anjona estra manitoborata pomera ravnotežu udesno i na taj način povećava kiselost rastvora za 5 redova veličine u poređenju sa onom čistog bornog oksida, snižavajući pKa sa 9 na ispod 4 za dovoljnu koncentraciju manitola.[15][13][16] Dobijeni rastvor se naziva manitoborna kiselina.
Dodavanje manitola prvobitno neutralnom rastvoru koji sadrži bornu kiselinu ili jednostavne borate snižava pH dovoljno da se može titrovati jakom bazom kao NaOH, uključujući i automatizovani potenciometrijski titrator. Ovo svojstvo se koristi u analitičkoj hemiji za određivanje sadržaja borata u vodenim rastvorima, na primer za praćenje iscrpljivanja borne kiseline neutronima u vodi primarnog kola reaktora lake vode kada se jedinjenje dodaje kao neutronski otrov tokom operacije punjenja goriva.[13]
Primena
[uredi | uredi izvor]Borna kiselina nalazi primenu kao antiseptik, insekticid, za sprečavanje širenja vatre itd. U industriji nalazi primenu u proizvodnji fiberglasa, za pravljenje sredstava za podmazivanje drveta. Koristi se i u pirotehnici. U farmakologiji se koristi kao lek, odnosno, blagi antiseptik u vidu 3% rastvora, ili kao keratoplastik u obliku praška koji je 10% smeša sa talkom.[17]
Medicinska primena
[uredi | uredi izvor]Borna kiselina se može koristiti kao antiseptik za manje opekotine ili posekotine i ponekad se koristi u melemima i zavojima, kao što je boraksna vlakna. Borna kiselina se primenjuje u veoma razblaženom rastvoru kao sredstvo za ispiranje očiju. Razređena borna kiselina može da se koristi kao vaginalni tuš za lečenje bakterijske vaginoze usled prekomerne alkalnosti,[18] kao i kandidijaze zbog nealbikansne kandide.[19] Borna kiselina u velikoj meri pošteđuje laktobacile unutar vagine.[20] Kao TOL-463, to je u razvoju kao intravaginalni lek za lečenje bakterijske vaginoze i vulvovaginalne kandidijaze.[21][22][23] Kao antibakterijsko jedinjenje, borna kiselina se takođe može koristiti za lečenje akni. Koristi se i kao prevencija razvoja atletskog stopala, unosom pudera u čarape. Različiti preparati se mogu koristiti za lečenje nekih vrsta spoljašnjeg otitisa (infekcije uһa) i kod ljudi i kod životinja.[24] Konzervans u bocama za uzorke urina u UK je borna kiselina.[25]
Poznato je da su rastvori borne kiseline koji se koriste za ispiranje očiju ili na izgrebanoj koži toksični, posebno za odojčad nakon višekratne upotrebe; to je zbog njegove spore stope eliminacije.[26]
Borna kiselina je jedna od najčešće korišćenih supstanci koja može da spreči štetne efekte reaktivne fluorovodonične kiseline (HF) nakon slučajnog kontakta sa kožom. Ona deluje tako što forsira slobodne F−
anjone u inertni tetrafluoroboratni anjon. Ovaj proces poražava ekstremnu toksičnost fluorovodonične kiseline, posebno njenu sposobnost da sekvestrira jonski kalcijum iz krvnog seruma što može dovesti do zastoja srca i razgradnje kostiju; takav događaj može nastati samo od manjeg kontakta kože sa HF.[27]
Reference
[uredi | uredi izvor]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st izd.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Allen, A. H.; Tankard, Arnold R. (1904). „The determination of boric acid in cider, fruits, etc”. Analyst. 29: 301. Bibcode:1904Ana....29..301A. doi:10.1039/an9042900301.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). „Chapter 13: The Group 13 Elements”. Inorganic Chemistry (3rd izd.). Pearson. str. 340. ISBN 978-0-13-175553-6.
- ^ a b Jolly, W. L. (1984). Modern Inorganic Chemistry. McGraw-Hill. str. 198. ISBN 9780070327603.
- ^ Tachikawa, Masanori (2004). „A density functional study on hydrated clusters of orthoboric acid, B(OH)3(H2O) (N=1–5)”. Journal of Molecular Structure: Theochem. 710 (1–3): 139—150. doi:10.1016/j.theochem.2004.09.008.
- ^ Housecroft, C.E.; Sharpe, A.G. (2005). Inorganic Chemistry (2nd izd.). Pearson Prentice-Hall. str. 314—5.
- ^ MHE. Comprehensive Chemistry for JEE Advanced 2014. Tata McGraw-Hill Education. str. 15.5. ISBN 9781259064265 — preko Google Books.
- ^ Darpan, Pratiyogita (1. 5. 2000). Competition Science Vision. Pratiyogita Darpan — preko Internet Archive.
- ^ Tsuyumoto, I.; Oshio, T.; Katayama, K. (2007). „Preparation of highly concentrated aqueous solution of sodium borate”. Inorganic Chemistry Communications. 10 (1): 20—22. doi:10.1016/j.inoche.2006.08.019.
- ^ a b v g Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II izd.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Brown, Herbert C.; Mead, Edward J.; Shoaf, Charles J. (1956). „Convenient procedures for the preparation of alkyl borate esters”. J. Am. Chem. Soc. 78 (15): 3613—3614. doi:10.1021/ja01596a015.
- ^ a b Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000). Vogel's Quantitative Chemical Analysis (6th izd.). New York: Prentice Hall. str. 357. ISBN 0-582-22628-7.
- ^ a b NIST Special Publication. U.S. Government Printing Office. 1969.
- ^ Borna kiselina u medicini
- ^ Abercrombie, P. (2010). „Vaginitis”. Ur.: Maizes, V.; Low Dog, T. Integrative Women's Health. New York, NY: Oxford University Press. str. 192. ISBN 978-0-19-537881-8.
- ^ Iavazzo C, Gkegkes ID, Zarkada IM, Falagas ME (avgust 2011). „Boric acid for recurrent vulvovaginal candidiasis: the clinical evidence”. J Womens Health (Larchmt). 20 (8): 1245—55. PMID 21774671. doi:10.1089/jwh.2010.2708.
- ^ Sobel JD, Sobel R (avgust 2021). „Current and emerging pharmacotherapy for recurrent bacterial vaginosis”. Expert Opin Pharmacother. 22 (12): 1593—1600. PMID 33750246. S2CID 232325625. doi:10.1080/14656566.2021.1904890.
- ^ „TOL 463 – AdisInsight”.
- ^ Nyirjesy P, Brookhart C, Lazenby G, Schwebke J, Sobel JD (april 2022). „Vulvovaginal Candidiasis: A Review of the Evidence for the 2021 Centers for Disease Control and Prevention of Sexually Transmitted Infections Treatment Guidelines”. Clin Infect Dis. 74 (Suppl_2): S162—S168. PMID 35416967. doi:10.1093/cid/ciab1057.
- ^ Marrazzo JM, Dombrowski JC, Wierzbicki MR, Perlowski C, Pontius A, Dithmer D, Schwebke J (februar 2019). „Safety and Efficacy of a Novel Vaginal Anti-infective, TOL-463, in the Treatment of Bacterial Vaginosis and Vulvovaginal Candidiasis: A Randomized, Single-blind, Phase 2, Controlled Trial”. Clin Infect Dis. 68 (5): 803—809. PMC 6376090
 . PMID 30184181. doi:10.1093/cid/ciy554.
. PMID 30184181. doi:10.1093/cid/ciy554.
- ^ Adriztina, I.; Adenin, L. I.; Lubis, Y. M. (januar 2018). „Efficacy of Boric Acid as a Treatment of Choice for Chronic Suppurative Otitis Media and Its Ototoxicity”. Korean J Fam Med. 39 (1): 2—9. PMC 5788841
 . PMID 29383205. doi:10.4082/kjfm.2018.39.1.2.
. PMID 29383205. doi:10.4082/kjfm.2018.39.1.2.
- ^ UK standards for microbiology investigations (PDF). Public Health England. 2017-08-07.
- ^ Harvey, S. C. (1980). „Antiseptics and Disinfectants; Fungicides; Ectoparasiticides”. Ur.: Gilman, A. G.; Goodman, L. S.; Gilman, A. Goodman & Gillman's The Pharmacological Basis of Therapeutics (6th izd.). str. 971. ISBN 978-0-02-344720-4.
- ^ „Method 3052 microwave assisted acid digestion of siliceous and organically based matrices” (PDF). US EPA. 2015-06-22.
Literatura
[uredi | uredi izvor]- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd izd.). New York: McGraw-Hill. ISBN 978-0-07-112651-9.
- Goodman, L.; Gilman, A.; Brunton, L.; Lazo, J.; Parker, K. (2006). Goodman & Gilman's The Pharmacological Basis of Therapeutics. New York: McGraw Hill.
- Cordia JA, Bal EA, Mak WA and Wils ERJ (2003), Determination of some physico-chemical properties of Optibor EP. Rijswijk, The Netherlands: TNO Prins Maurits Laboratory, report PML 2002-C42rr, GLP, Unpublished, confidential data provided by Bor ax Europe Limited
Spoljašnje veze
[uredi | uredi izvor]- Boric Acid Technical Fact Sheet - National Pesticide Information Center
- Boric Acid General Fact Sheet - National Pesticide Information Center
- International Chemical Safety Card 0991
- US EPA Pesticide Reregistration Eligibility Decision
- National Pollutant Inventory - Boron and compounds
- Boric acid at ChemicalLand21
- European Chemicals Agency (ECHA)"New Public Consultation on Eight Potential Substances of Very High Concern" - includes Boric Acid. Closes 22 April 2010
- ChemSub Online: Boric acid