Нуклеофилно коњугатна адиција

Нуклеофилно коњугатна адиција је тип органска реакција. Обичне нуклеофилне адиције или 1,2-нуклеофилне адиције баве се углавном адицијама карбонилних једињења. Једноставна једињења алкена не показују 1,2 реактивност због недостатка поларитета, осим ако се алкен активира посебним супституентима. Са α,β-незасићеним карбонилним једињењима као што је циклохексенон може се закључити из резонантних структура да је β позиција електрофилно место које може да реагује са нуклеофилом. Негативни набој у овим структурама се чува као алкоксидни ањон. Таква нуклеофилна адиција се назива нуклеофилна коњугатна адиција или 1,4-нуклеофилна адиција. Најважнији активни алкени су горепоменути коњуговани карбонили и акрилонитрили.
Механизам реакције
[уреди | уреди извор]Коњуговано додавање је винилогни пандан директном нуклеофилном додавању. Нуклеофил реагује са α,β-незасићеним карбонилним једињењем на β позицији. Негативно наелектрисање које носи нуклеофил сада је делокализовано у алкоксидном ањону и α угљенику карбањона резонанцом. Протонација води кроз кето-енол таутомеризам до засићеног карбонилног једињења. У вициналној дифункционализацији протон је замењен другим електрофилом.
Реакције
[уреди | уреди извор]- Коњуговани карбонили реагују са секундарним аминима и формирају 3-аминокарбониле (3-кетоамине). На пример, додавањем коњугата метиламина циклохексен-2-ону добија се једињење 3-(Н-метиламино)-циклохексанон.
- Коњуговани карбонили реагују са цијановодоником у 1,4-кето-нитриле. Видети хидроцијанизацију незасићених карбонила. У Нагатиној реакцији извор цијанида је диетилалуминијум цијанид.
- Гилманов реагенс је ефикасан нуклеофил за 1,4-адиције коњугованим карбонилима.
- Мајклова реакција укључује коњуговане додатке енолата коњугованим карбонилима.
- Сторк енаминска реакција укључује коњуговано додавање енамина коњугованим карбонилима.
Опсег
[уреди | уреди извор]Додатак коњугата је ефикасан у стварању нових угљеник-угљеник веза уз помоћ органометалних реагенаса као што је реакција органоцинк јодида са метилвинилкетоном.[1]
![(4Р',5Р')-5-(5-етил-2,2-диметил-[1,3]-диоксолан-4-ил)-пентан-2-он](http://upload.wikimedia.org/wikipedia/commons/7/7b/Conjugateadditionexample.png)
Пример асиметричне синтезе додавањем коњугата је синтеза (Р)-3-фенил-циклохексанона из циклохексенона, фенилборне киселине, родијум ацац катализатора и хиралног лиганда БИНАП.[2]

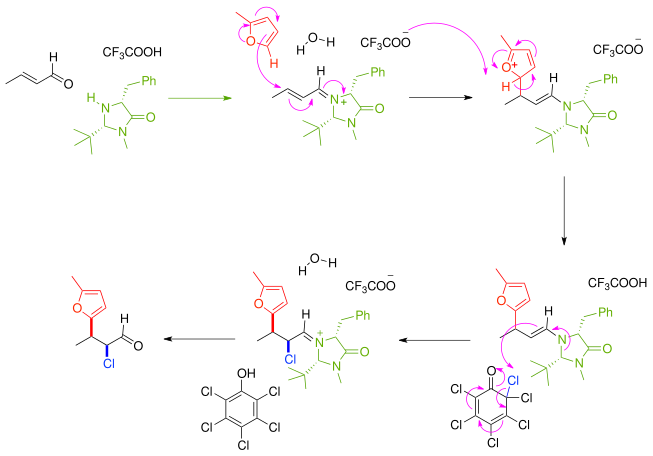
У другом примеру асиметричне синтезе α,β-незасићено карбонилно једињење прво реагује са хиралним имидазолидинонским катализатором и хиралним посредникаом за иминијум једињење у алкилимино-де-оксо-бисупституцији које затим реагује енантиоселективно са нуклеофилним фураном. Непосредни производ реакције је нуклеофилни енамин и реакција тече каскадно са апстракцијом хлора из хлорисаног хинона. Након уклањања аминског катализатора, кетон је ефикасно функционализован са нуклеофилом и електрофилом са син:анти односом од 8:1 и 97% енантиомерног вишка.[3]
Овај принцип се такође примењује у енантиоселективном вишекомпонентном домино коњугованом додавању нуклеофилних тиола као што су бензилмеркаптан и електрофилни ДЕАД.[4]

Референце
[уреди | уреди извор]- ^ Андрéа L. де Соуса; Инêс С. Ресцк (2002). „Асyмметриц Сyнтхесис оф еxо-Исобревицомин анд еxо-Бревицомин виа Цоњугатед Аддитион оф Примарy Алкyл Иодидес то α,β-Унсатуратед Кетонес”. Ј. Браз. Цхем. Соц. 13 (2): 233. дои:10.1590/С0103-50532002000200015
 .
. - ^ Тамио Хаyасхи; Макото Такахасхи; Yосхиаки Такаyа; Масамицхи Огасаwара (2004). „(Р)-3-пхенyл-цyцлохеxаноне”. Орг. Сyнтх.; Цолл. Вол., 10, стр. 609
- ^ Yонг Хуанг; Аббас M. Wаљи; Цатхарине Х. Ларсен; Давид W. C. МацМиллан (новембар 2005). „Енантиоселецтиве Органо-Цасцаде Цаталyсис” (ПДФ). Ј. Ам. Цхем. Соц. 127 (43): 15051—15053. ИССН 0002-7863. ПМИД 16248643. дои:10.1021/ја055545д. Супплементарy информатион.
- ^ Мауро Мариго; Тобиас Сцхулте; Јохан Франзéн; Карл Анкер Јоргенсен (новембар 2005). „Асyмметриц Мултицомпонент Домино Реацтионс анд Хигхлy Енантиоселецтиве Цоњугатед Аддитион оф Тхиолс то α,β-Унсатуратед Алдехyдес”. Ј. Ам. Цхем. Соц. 127 (45): 15710—15711. ИССН 0002-7863. ПМИД 16277506. дои:10.1021/ја055291w.
