Azot-suboksid
Appearance

| |
| |
| Nazivi | |
|---|---|
| Drugi nazivi
Azot (I)-oksid
| |
| Identifikacija | |
| ECHA InfoCard | 100.030.017 |
| E-brojevi | E942 (glazing agents, ...) |
| MeSH | Nitrous+oxide |
| Svojstva | |
| N2O | |
| Molarna masa | 44,0128 g/mol |
| Agregatno stanje | bezbojan gas |
| Gustina | 1222,8 kg m-3 (течност) 1.8 kg m-3 (гас) |
| Tačka topljenja | -90.86°C (182.29 K) |
| Tačka ključanja | -88.48°C (184.67 K) |
| Struktura | |
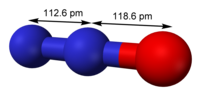
| Oblik molekula (orbitale i hibridizacija) | linearan |
| Dipolni moment | 0.166D |
| Termohemija | |
Standardna entalpija
stvaranja (ΔfH |
+82.05 |
| Farmakologija | |
| Načini upotrebe | Inhalacija |
| Farmakokinetika: | |
| 0,004% | |
| 5 minuta | |
| respiracija | |
| Opasnosti | |
| R-oznake | R8 |
| S-oznake | S38 |
| NFPA 704 | |
| Srodna jedinjenja | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Azot-suboksid (Nitro, NOS) je hemijsko jedinjenje.
Opšte karakteristike
[uredi | uredi izvor]- Molekulska formula mu je .
- Poznatiji je kao „gas smejavac“, jer izaziva takvu reakciju kod čoveka.
Osobine
[uredi | uredi izvor]- Azotsuboksid je bezbojan, netoksičan i nezapaljiv gas blago sladunjavog ukusa, teži od vazduha 1,5 puta.
- Na običnoj temperaturi je vrlo stabilan, ali na povišenim temperaturama ima jako oksidaciono dejstvo, jer se na temperaturama iznad 400 °C razlaže na kiseonik i azot.[1][2]
Primena
[uredi | uredi izvor]- Osnovna primena azot-suboksida je u medicini kao anestetika, jer je najmanje toksičan od svih poznatih opštih anestetika.
- Obično se primenjuje u oblicima kombinovane inhalacione anestezije.
- Pored osnovne primene u medicini, azot-suboksid se koristi i kao potisni gas (propelant) za aerosol pakovanja u prehrambenoj industriji (šlag, sirup, koncentrat kafe) kao i za farmaceutske i kozmetičke preparate.
- Ima primenu i u auto-trkama. Kod automobila sa motorom sa unutrašnjim sagorevanjem azot-suboksid se koristi kao sredstvo za povećanje performansi motora. On sam po sebi nije zapaljiv, ali se na visokim temperaturama lako raspada i tako u motor unosi više kiseonika, čime omogućava bolje i brže sagorevanje goriva. Međutim, pored toga što pomaže, on i odmaže, jer korišćenje azot-suboksida u običnim motorima može dovesti do njihovog uništenja. Samo dobro ojačani i modifikovani (frizirani) motori mogu podneti snagu koju im daje azot-suboksid.
Reference
[uredi | uredi izvor]- ^ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0911910131.
Spoljašnje veze
[uredi | uredi izvor]![]() Mediji vezani za članak Azot-suboksid na Vikimedijinoj ostavi
Mediji vezani za članak Azot-suboksid na Vikimedijinoj ostavi


