Oligosahariltransferaza
| STT3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||||
| Simbol | STT3 | ||||||||
| Pfam | PF02516 | ||||||||
| Pfam klan | CL0111 | ||||||||
| InterPro | IPR003674 | ||||||||
| OPM superfamilija | 273 | ||||||||
| OPM protein | 3rce | ||||||||
| CAZy | GT66 | ||||||||
| |||||||||
Oligosahariltransferaza ili OST (EC 2.4.1.119) je membranski proteinski kompleks koji prenosi 14-šećerni oligosaharid sa dolihola na novoformirani protein. Ovo je tip glikoziltransferaze. Šećer Glc3Man9GlcNAc2 (gde je Glc=glukoza, Man=manoza, i GlcNAc=N-acetilglukozamin) je vazan za asparaginski (Asn) ostatak sekvence Asn-X-Ser ili Asn-X-Thr, gde je X bilo koja aminokiselina izuzev prolina. Ova sekvenca se naziva glikozilacionim sekvonom. Reakcija koju katalizuje OST je centralni korak u putu N-vezane glikozilacije.
Location
[уреди | уреди извор]
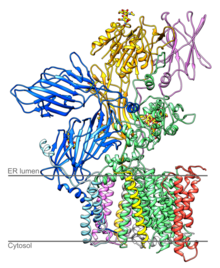
OST je komponenta translokona u membrani endoplazmatičnog retikuluma (ER). Za lipid vezani sržni oligosaharid se formira na membrani endoplazmičnog retikuluma i prenosi se do određenih asparaginskih ostataka novoformiranih polipeptidnih lanaca posredstvom oligosaharil transferaznog kompleksa.[3] OST aktivno mesto je locirano oko 4 nm od lumenalnog lica ER membrane.[4]
Ovaj enzim obično deluje tokom translacije pri ulazu novog proteina u ER, ali se ova kotranslaciona glikozilacija ipak naziva posttranslacionom modifikacijom. Poznato je nekoliko primera OST aktivnosti nakon završetka translacije.[5][6] Trenutno shvatanje je da do posttranslacione aktivnosti može doći ako je protein loše savijen ili se sporo savija.[6]
Struktura i funkcija
[уреди | уреди извор]Kvaščani OST se sastoji od osam različitih transmembranskih proteina unutar tri potkompleksa (jedan od kojih je OST4).[7][8] Ovi oktameri ne formiraju oligomer višeg reda, a tri od osam proteina su i sami glikozilovani.[7] Poznato je da OST kod sisara ima sličnu kompoziciju.[9][10]
Smatra se da se OST sastoji od mnoštva podjedinica zato što mora da:[11]
- Pozicionira sebe u blizini translokonske pore.
- Prepozna i veže oligosaharildolihol.
- Skenira novi protein da bi prepoznao i vezao sekvone.
- Pomera ta dva velika supstrata u njihove korektne lokacije i konformacije.
- Aktivira azotni atom Asn amida radi transfera oligosaharida.
- Oslobodi svoje supstrate.
Katalitički aktivna podjedinica OST se naziva STT3. Postoje dva paraloga kod eukariota, koji se nazivaju STT3A i STT3B. STT3A je prvenstveno odgovoran za kotranslacionu glikozilaciju novog polipeptida dok ulazi u lumen endoplazmičnog retikuluma, dok STT3B isto tako može da posreduje posttranslacionu glikozilaciju.[12] Struktura PglB, prokariotskog homologa STT3 je rešena.[13] Visok stepen sličnosti sekvenci prokariotskog i eukariotskog STT3 sugeriše da su njihove prostorne strukture slične.
Klinički značaj
[уреди | уреди извор]CDG sindromi su genetički poremećaji glikozilacionog puta. Oni se označavaju kao tip I ako je defektivan gen za enzim koji učestvuje u formiranju ili transferu Glc3Man9GlcNAc2-doliholnog prekurzora. Oni se svrstavaju u „tip II” ako se defektivni korak javlja nakon dejstva OST u putu N-vezane glikozilacije ili O-vezane glikozilacije.[14]
Reference
[уреди | уреди извор]- ^ Pfeffer S, Dudek J, Gogala M, Schorr S, Linxweiler J, Lang S, Becker T, Beckmann R, Zimmermann R, Förster F (2014). „Structure of the mammalian oligosaccharyl-transferase complex in the native ER protein translocon”. Nat. Commun. (5): 3072. doi:10.1038/ncomms4072.
- ^ Wild R, Kowal J, Eyring J, Ngwa EM, Aebi M, Locher KP (2018). „Structure of the yeast oligosaccharyltransferase complex gives insight into eukaryotic N-glycosylation”. Science. 359 (6375): 545—550. PMID 29301962. doi:10.1126/science.aar5140.
- ^ Zufferey R, Knauer R, Burda P, Stagljar I, te Heesen S, Lehle L, Aebi M (oktobar 1995). „STT3, a highly conserved protein required for yeast oligosaccharyl transferase activity in vivo”. EMBO J. 14 (20): 4949—60. PMC 394598
 . PMID 7588624.
. PMID 7588624.
- ^ Nilsson IM, von Heijne G (mart 1993). „Determination of the distance between the oligosaccharyltransferase active site and the endoplasmic reticulum membrane”. J. Biol. Chem. 268 (8): 5798—801. PMID 8449946.
- ^ Pless DD, Lennarz WJ; Lennarz (januar 1977). „Enzymatic conversion of proteins to glycoproteins”. Proc. Natl. Acad. Sci. U.S.A. 74 (1): 134—8. Bibcode:1977PNAS...74..134P. PMC 393212
 . PMID 264667. doi:10.1073/pnas.74.1.134.
. PMID 264667. doi:10.1073/pnas.74.1.134.
- ^ а б Duvet S, Op De Beeck A, Cocquerel L, Wychowski C, Cacan R, Dubuisson J (februar 2002). „Glycosylation of the hepatitis C virus envelope protein E1 occurs posttranslationally in a mannosylphosphoryldolichol-deficient CHO mutant cell line”. Glycobiology. 12 (2): 95—101. PMID 11886842. doi:10.1093/glycob/12.2.95.
- ^ а б Knauer R, Lehle L (januar 1999). „The oligosaccharyltransferase complex from yeast”. Biochim. Biophys. Acta. 1426 (2): 259—73. PMID 9878773. doi:10.1016/S0304-4165(98)00128-7.
- ^ Dempski RE, Imperiali B (decembar 2002). „Oligosaccharyl transferase: gatekeeper to the secretory pathway”. Curr Opin Chem Biol. 6 (6): 844—50. PMID 12470740. doi:10.1016/S1367-5931(02)00390-3.
- ^ Nilsson I, Kelleher DJ, Miao Y, Shao Y, Kreibich G, Gilmore R, von Heijne G, Johnson AE (maj 2003). „Photocross-linking of nascent chains to the STT3 subunit of the oligosaccharyltransferase complex”. J. Cell Biol. 161 (4): 715—25. PMC 2199356
 . PMID 12756234. doi:10.1083/jcb.200301043.
. PMID 12756234. doi:10.1083/jcb.200301043.
- ^ Karaoglu D, Kelleher DJ, Gilmore R (oktobar 2001). „Allosteric regulation provides a molecular mechanism for preferential utilization of the fully assembled dolichol-linked oligosaccharide by the yeast oligosaccharyltransferase”. Biochemistry. 40 (40): 12193—206. PMID 11580295. doi:10.1021/bi0111911.
- ^ Imperiali, B. (novembar 1997). „Protein Glycosylation: The Clash of the Titans”. Accounts of Chemical Research. 30 (11): 452—459. doi:10.1021/ar950226k.
- ^ Ruiz-Canada C, Kelleher DJ, Gilmore R (januar 2009). „Cotranslational and posttranslational N-glycosylation of polypeptides by distinct mammalian OST isoforms”. Cell. 136 (2): 272—83. PMC 2859625
 . PMID 19167329. doi:10.1016/j.cell.2008.11.047.
. PMID 19167329. doi:10.1016/j.cell.2008.11.047.
- ^ Lizak C, Gerber S, Numao S, Aebi M, Locher KP (jun 2011). „X-ray structure of a bacterial oligosaccharyltransferase”. Nature. 474 (7351): 350—5. PMID 21677752. doi:10.1038/nature10151.
- ^ Marquardt T, Denecke J (jun 2003). „Congenital disorders of glycosylation: review of their molecular bases, clinical presentations and specific therapies”. Eur. J. Pediatr. 162 (6): 359—79. PMID 12756558. doi:10.1007/s00431-002-1136-0.
Spoljašnje veze
[уреди | уреди извор]- oligosaccharyltransferase на US National Library of Medicine Medical Subject Headings (MeSH)
