Биохемија
| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Биохемија или биолошка хемија је хемија живота, мост између биологије и хемије, која проучава начин на који комплексне хемијске реакције стварају живот.[1] Биохемија је хибридни део хемије који проучава хемијске процесе у живим организмима.[2] Како сви облици живота имају заједничко порекло, они имају и сличне биохемије, као што су генетички код и стереохемија многих биомолекула. Контролом протока информација путем биохемијске сигнализације и протока хемијске енергије путем метаболизма, биохемијски процеси омогућавају постојање комплексности живота. Током задњих деценија двадесетог века, биохемија је постала у тој мери успешна у објашњавању процеса живих бића да у данашње време скоро све области науке о животу од ботанике до медицине до генетике учествују у биохемијским истраживањима.[3] Данашњи главни фокус чисте биохемије је на разумевању начина на који биолошки молекули производе процесе који се одвијају у живим ћелијама,[4] што је блиско повезано са изучавањем и разумевањем ткива, органа, и целих организама[5] — другим речима, целокупне биологије.
Биохемија је блиско сродна са молекуларном биологијом,[6] изучавањем молекуларних механизама којима генетичка информација кодирана[7][8] у ДНК доводи до процеса живота.[9][10] У зависности од дефиниције термина, молекуларна биологија се може сматрати граном биохемије, или биохемија оруђем којим се истражује и студира молекуларна биологија.
Биохемија се бави структурама, функцијама и интеракцијама ћелијских компоненти, као што су протеини, угљени хидрати, липиди, нуклеинске киселине и остали биомолекули, који производе ћелијску структуру и изводе многобројне функције везане за живот.[11] Иако постоји огроман број различитих биомолекула, они се често састоје од истих јединица које се понављају, мономера који се понављају у различитим секвенцама. Хемија ћелија исто тако зависи од реакција малих молекула и јона. Они могу да буду неоргански, на пример вода и јони метала, или органски, као што су аминокиселине, које се користе за синтезу протеина.[12] Биохемијске студије превасходно изучавају малу групу елемената: угљеник, водоник, азот, кисеоник, фосфор, и сумпор; који се често називају CHNOPS. Низ других елемената учествује у биохемијским процесима, али у знатно нижим концентрацијама. Механизми помоћу којих ћелије добијају енергију из свог окружења путем хемијских реакција се зову метаболизам. Биохемија метаболизма ћелије и биохемија ендокриног система су два домена која су интензивно студирана.
Друге области обухваћене појмом биохемије су генетички код (ДНК, РНК), синтеза протеина, транспорт кроз ћелијску мембрану и трансдукција сигнала. Резултати биохемијских истраживања налазе примену у медицини, исхрани, и пољопривреди. У медицини, биохемичари истражују узроке и лекове болести.[13] У пољу исхране, се изучава начин одржавања здравља и ефекти нутриционе дефицијенције.[14] У пољопривреди предмет истраживања су земљиште и ђубрива, и ради се на побољшању култивације усева, њиховог складиштења и контроле штеточина.
Развој биохемије
[уреди | уреди извор]

У почетку се веровало да на живе материје закони науке делују другачије од неживих материја. Веровало се да само жива бића могу да произведу молекуле живота (од претходно постојећих живих молекула). Међутим Фридрих Велер је 1828. објавио стручни рад који је за тему имао синтезу урее, притом доказавши да органска једињења могу бити створена вештачким путем. Синтеза урее, односно карбамида из амонијум-цијанида била је прва лабораторијска синтеза неког органског једињења.
У својој најширој дефиницији, биохемија се може сматрати студијом компоненти и композиције живих организама и начина на који оне формирају интеракције стварајући живот. Може се сматрати да историја биохемије започиње са античком Грчком.[15] Међутим, биохемија као специфична научна дисциплина има свој почетак током 19. века, или мало раније, у зависности од тога на којем аспекту биохемије је фокус. Неки извори заузимају становиште да почетак биохемије кореспондира са открићем првог ензима, диастазе (који се данас назива амилазом), 1833. од стране Анселма Пајена,[16] док други сматрају Бухнерову прву демонстрацију комплексног биохемијског процеса алкохолне ферментације у бешћелијским екстрактима 1897. године рођењем биохемије.[17][18] Исто тако се може сматрати почетком биохемије објављивање утицајног рада Јустуса фон Либига, Животињска хемија, или, органска хемија у њеној примени на физиологију и патологију 1842. године, у коме је представио хемијску теорију метаболизма,[15] или чак раније студије из 18. века о ферментацији и респирацији Антоана Лавоазјеа.[19][20] Многи други пионири поља који су помогли да се открију слојеви комплексности биохемије су били прокламисани оснивачима модерне биохемије, на пример Емил Фишер због његовог рада на хемији протеина,[21] и Ф. Гоуланд Хопкинс због рада на ензимима и динамичкој природи биохемије.[22]
Сам термин „биохемија“ је изведен из комбинације речи биологија и хемија. Године 1877, Феликс Хопе-Сејлер је користио овај термин (biochemie у Немачком) као синоним за физиолошку хемију у предговору првог издања Zeitschrift für Physiologische Chemie (часописа за физиолошку хемију), где се он залагао за успостављање институција посвећених том пољу истраживања.[23][24] Немачки хемичар Карл Нојберг се међутим често наводи у литератури као особа која је сковала реч биохемија 1903. године,[25][26][27] док неки извори наводе Франца Хофмајстера као творца речи.[28]

Некад је преовладавало мишљење да живот и његови материјали имају нека есенцијална својства или супстанце (што је често називано „виталним принципом”) која су различита од оних које су присутне у неживој материји, и постојало је веровање да само живи организми могу произвести молекуле живота.[30] Године 1828, Фридрих Велер је објавио чланак о синтези уреје, чиме је доказао да органска једињења могу да буду креирана вештачким путем.[31] Од тада је биохемија навелико напредовала, нарочито током средине 20. века, са открићем и развојем метода као што су хроматографија, рендгенска дифракција, нуклеарна магнетна резонанција (НМР), радиоизотопско обележавање, електронска микроскопија и симулације молекуларне динамике. Захваљујући овим методима научници су открили и детаљно анализирали многе молекуле као и активности у самим ћелијама на молекуларном нивоу, као што су путеви метаболизма у ћелијама, тј. гликолиза и Кребсов циклус (циклус лимунске киселине).
Још један значајни историјски догађај у биохемији је откриће гена и њихове улоге у трансферу информација у ћелији. Тај део биохемије се обично назива молекуларном биологијом.[32] Током 1950-их, Џејмс Д. Вотсон, Франсис Крик, Росалинд Франклин, и Морис Вилкинс су решили ДНК структуру и објаснили њену релацију са генетичким трансфером информација.[33] Године 1958, Џорџ Бидл и Едвард Тејтум су награђени Нобеловом наградом за рад на гљивама којим су показали да један ген производи један ензим.[34] Године 1988, Колин Пичфорк је био прва особа која је осуђена за убиство на бази ДНК доказа, чему је следио знатан развој форензике.[35] У ближој прошлости су Ендру Фајер и Крејг Мело награђени Нобеловом наградом 2006 за откриће улоге РНК интерференције (РНКи), у онемогућавању експресије гена.[36]
Хемијски елементи живота
[уреди | уреди извор]
Око 20-30 елемената од 92 елемента који се јављају у природи су есенцијални за разне врсте биолошког живота. Већина ретких елемената на Земљи нису неопходни за живот (изузеци су селен и јод). Исто тако неколико распрострањених елемената (алуминијум и титанијум) се не користе. Већина организама има истоветне потребе за елементима. Постоје извесне разлике између биљака и животиња. На пример, океанске алге користе бром, док не постоје индикације да је тај елемент неопходан копненим биљкама и животињама. Свим животињама је неопходан натријум, што није случај с биљкама. Биљкама је неопходан бор и силицијум, док они нису неопходни животињама (или су потребни у ултра-малим количинама).
Јединствена својства угљеника
[уреди | уреди извор]Само шест релативно малих елемената: угљеник, водоник, азот, кисеоник, калцијум, и фосфор сачињава скоро 99% масе живих ћелија, укључујући оне у људском телу. Осим тих шест главних елемената који сачињавају већину људског тела, људима су неопходне мале количине 18 других елемената.[37] Шест главних елемената лако формирају ковалентне везе. Они сачињавају 92% суве тежине живих бића (скоро сви организми су ~70% вода). Остатак се састоји од елемената који су углавном присутни као јони и који се највећим делом јављају само у траговима (они обично врше своје функције на активним местима ензима[38][39]). Међутим, треба имати у виду да нема познатих биолошких захтева за већином од 92 природна елемената. Гледано с друге стране, са изузетком кисеоника и калцијума, биолошки најзаступљенији елементи су само мање заступљени састојци Земљине коре (чије најизобилније компоненте су O 47%; Si 28%; Al 7,9%; Fe 4,5%; и Ca 3,5%).
Доминација угљеника у живој материји је без сумње резултат његове огромне хемијске свестраности у поређењу са свим осталим елементима. Угљеник има јединствену способност да формира практично бесконачан број једињења, као резултат његове способности да успостави чак четири врло стабилне ковалентне везе (укључујући једноструку, двоструку и троструку везу) у комбинацији са његовом способношћу да формира ковалентно повезане ланце неограничене дужине. Према томе, од скоро 40 милиона хемијских једињења која су тренутно позната, ~90% су органске супстанце (материје које садрже угљеник). Инспекцијом осталих елемената периодног система се може утврдити зашто они не поседују ову комбинацију својстава.
Само пет елемената, B, C, N, Si, и P, има способност формирања три или више веза, и да стога формирају ланце ковалентно повезаних атома који исто тако могу да имају бочне ланце. Други елементи су метали, који имају тенденцију формирања јона, пре него ковалентних веза; племенити гасови, који су есенцијално хемијски инертни; или атоми као што су H или O који могу да направе једну или две ковалентне везе. Међутим, мада B, N, Si, и P могу да имају бар три ковалентне везе, они су из разлога који су образложени испод, неподобни као база комплексне хемије.
Бор има мањи број валентних електрона (3) него валентних орбитала (4), те је електронски дефицитаран.[40] То у знатној мери ограничава број типова и стабилност једињења која B може да формира. Азот има супротни проблем; он има 5 валентних електрона, што га чини електронски богатим. Одбијања између усамљених парова електрона на ковалентно везаним атомима азота у знатној мери редукују енергију веза (171 kJ mol−1 vs 348 kJ mol−1 за једноструку везу) у односу на обично стабилну троструку везу N2 молекула (946 kJ mol−1). Чак и кратки ланци ковалентно везаних N атома су стога подложни декомпозицији, обично бурној, уз формирање N2.

Силицијум и угљеник су у истој периоди периодног система, и стога се може очекивати да имају сличне хемијске особине. Велики пречник атома силицијума, међутим, спречава два Si атома да приступе један другом довољно близу да би се остварило значајно преклапање орбитала. Последица тога су слабе једноструке везе (177 kJ mol−1), а кореспондирајуће вишеструке везе су ретко стабилне. За разлику од тога Si-O везе су веома стабилне (369 kJ mol−1), и ланци наизменичних Si и O атома су есенцијално инертни (силикатни минерали,[41] чији оквири се састоје од таквих веза, формирају Земљину кору). Писци научне фантастике су спекулисали да силикони, који су уљаста или гумаста органосилицијумска једињења са дугим основама од повезаних мономера, на пример, метил силикони, могу да формирају хемијску основу ванземаљских животних облика. Међутим инертност њихових везе чини то мало вероватним. Фосфор, који је испод N у периодном систему, формира још мање стабилне ланце ковалентно везаних атома.
Претходно речено не подразумева да су све хетеронуклеарне везе нестабилне. Напротив, протеини, угљени хидрати и нуклеинске киселине имају такве везе. Хетеронуклеарне везе су додуше често мање стабилне и оне су обично места хемијског разлагања при деградацији макромолекула, и обратно оне су везе које се формирају када се мономерне јединице повезују да би се формирали макромолекули. Један од изузетака су протеини, који садрже изузетно стабилне пептидне везе.[42]
Хемијска еволуција
[уреди | уреди извор]| Принос од искрења мешавине CH4, NH3, H2O, и H2.[43] | |
|---|---|
| Једињење | Принос (%) |
| Глицин | 2,1 |
| Гликолна киселина | 1,9 |
| Саркозин | 0,25 |
| Аланин | 1,7 |
| Млечна киселина | 1,6 |
| N-Метилаланин | 0,07 |
| α-Амино-n-бутирна киселина | 0,34 |
| α-Аминоизобутирна киселина | 0,007 |
| α-Хидроксибутирна киселина | 0,34 |
| β-Аланин | 0,76 |
| Сукцинска киселина | 0,27 |
| Аспарагинска киселина | 0,024 |
| Глутаминска киселина | 0,051 |
| Иминодисирћетна киселина | 0,37 |
| Иминосирћетнопропионска киселина | 0,13 |
| Мравља киселина | 4,0 |
| Сирћетна киселина | 0,51 |
| Пропионска киселина | 0,66 |
| Уреа | 0,034 |
| N-Метилуреа | 0,051 |
Сматра се да је Сунчев систем формиран гравитационо индукованим колапсом великог међузвезданог облака прашине и гаса. Највећи део овог облака, који је углавном био састављен од водоника и хелијума, кондензован је чиме је створено Сунце. Растућа температура и притисак у центру протосунца на крају су започели самоодрживу термонуклеарну реакцију која је од тада служила као извор енергије Сунца. Планете, које су настале из мањих агрегата прашине, нису биле довољно масивне да подрже такав процес. У ствари, мање планете, укључујући Земљу, састоје се углавном од тежих елемената, јер су њихове масе премале да би се гравитационо задржали H2 и He.
Примордијална Земљина атмосфера је била веома различита од данашње. Она није могла да садржи знатне количине O2, који је високо реактивна супстанца. Уместо тога, осим H2O, N2, и CO2 који су и сада присутни, атмосфера је вероватно садржала мање количине CO, CH4, NH3, SO2, као и H2. Ови молекули су спектроскопски детектовани у међузвезданом простору. Хемијска својства такве мешавине гаса чине је редукујућом атмосфером, што је контрасту са садашњом атмосфером Земље, која је оксидујућа атмосфера.
Током 1920-их, Александар Опарин[47][48] и Џ. Б. С. Холдејн[49][50] су независно предложили да су ултраљубичаста (УВ) радијација са Сунца (коју у данашње време у великој мери апсорбује озонски слој (O3) у вишим деловима атмосфере) или електрично испражњавање муња изазвали реакције молекула примордијалне редукционе атмосфере, и да су при том формирана једноставна органска једињења као што су аминокиселине, базе нуклеинских киселина и шећери. Да је овај процес могућ су први експериментално демонстрирали Стенли Милер и Харолд Јури 1953,[43] који су симулирали учинке олуја са муњама у примордијалној атмосфери путем излагања рефлуксне мешавине H2O, CH4, NH3, и H2 електричним пражњењима током једне недеље. (Мада постоје индикације да примордијална атмосфера Земље није имала високо редукујућу композицију попут оне коју су Милер и Јури претпоставили, могуће је да су постојале локализоване редукционе средине тог типа, нарочито у близини вулканских испуста.) Резултирајући раствор је садржао знатне количине у води растворних органских једињења, најзаступљенија од којих су дата у табели, заједно са знатном количином нерастворног катрана (полимеризованог материјала).[51][52][53] Неколико растворних једињења су аминокиселинске компоненте протеина, а многа друга исто тако имају биохемијски значај. Слични експерименти у којима су реакциони услови, композиција гасне смеше, и/или извор енергије варирани довели су до синтезе мноштва других аминокиселина. Ово, заједно са запажањем да угљенични метеорити садрже многе од тих истих аминокиселине, снажно сугеришу да су ове супстанце биле присутне у значајним количинама на примордијалној Земљи. Могуће је да су велике количине органских молекула испоручене примордијалној Земљи путем метеорита и прашине који су је веома тешко бомбардовали.
Базе нуклеинских киселина исто тако могу да буду синтетисане под претпостављеним пребиотским условима. Посебно аденин који се формира кондензацијом HCN, изобилног састојка пребиотичке атмосфере, у реакцији коју катализује NH3. Треба имати у виду да је хемијска формула аденина (HCN)5. Друге базе су исто тако биле синтетисане у сличним реакцијама уз учешће HCN и H2O. Шећери су били синтетисани полимеризацијом формалдехида (CH2O) у реакцијама катализованим дивалтентним катјонима, алуминијум оксидом, или глинама. Вероватно није случајно да су ова једињења основне компоненте биолошких молекула. Она су очигледно била најчешће органске супстанце у пребиотском добу.
Претходно описане пребиотске реакције вероватно су се одвијале током стотина милиона година. На крају, процењује се да су океани су стекли органски садржај сличан веома разблаженој бујонској супи. Могуће је да су постојала бројна места, као што су плимски базени и плитка језера, где је пребиотичка супа постала много концентрованија. У таквим окружењима њени саставни органски молекули могли су да се кондензују и да формирају, на пример, полипептиде и полинуклеотиде (нуклеинске киселине). Могуће је да су ове реакције биле катализоване адсорпцијом реактаната на минерале као што су глине. Међутим, ако би се живот формирао, стопе синтезе ових сложених полимера би морале бити веће од њихових стопа хидролизе. Према томе, „језеро” у којем је живот настао можда је било хладно, а не топло, чак и испод 0 °C (морска вода се чврсто замрзава тек испод -21 °C), пошто су реакције хидролизе у великој мери успорене на тако ниским температурама.
Живот
[уреди | уреди извор]Лако се може утврдити да ли је нешто живо или не. Жива бића деле многа заједничка својства, као што је способност издвајања енергије из хранљивих материја ради обављања различитих функција, способност да се активно одазову на промене у њиховом окружењу и способност раста, диференцирања и, вероватно оно што понајвише карактерише живот - способност да се репродукују. Наравно, дати организам не мора увек да има све ове особине. На пример, муле су очито живе, али се ретко репродукују. Насупрот томе, неживе материје могу да испољавају нека својства живота. На пример, кристали могу да се увећавају када се потопе у суперзасићени раствор кристалног материјала. Стога је живот, као и многи други комплексни феномени, можда немогуће прецизно дефинисати. Норман Хоровиц је предложио корисни сет критеријума живих система:[54][55] Живот поседује својства репликације, катализе и мутабилности. Биохемија је истраживање живота на молекуларном нивоу. Значај таквих студија значајно се повећава ако су повезане са биологијом одговарајућих организама или чак са заједницама таквих организама.
Прокариоте
[уреди | уреди извор]
Дуго времена је познато да се живот заснива на морфолошким јединицама познатим као ћелије. Формулација овог концепта обично се приписује чланку Матијаса Шлајдена и Теодора Швана из 1838. године,[56][57] док се његово порекло може се пратити до опажањима које су учинили рани микроскописти из XVII века као што је Роберт Хук.[58] Постоје две главне класификације ћелија: еукариоте (грчки: eu - добар или истински, и karyon - језгро), који имају мембраном затворено језгро у коме је инкапсулирана њихова ДНК (дезоксирибонуклеинска киселина); и прокариоте (грчки: pro, пре), којима недостаје ова органела. Прокариоте, које обухватају различите врсте бактерија, имају релативно једноставне структуре и увек су једноћелијске (иако могу да формирају филаменте или колоније независних ћелија). Процењује се да представљају око половине Земљине биомасе. Еукариоте, које могу бити вишећелијске, као и једноћелијске, знатно су сложеније од прокариота. Вируси, који су далеко једноставнији од ћелија, не класификују се као жива створења,[59][60] јер им недостаје метаболички апарат да се репродукују изван њихових ћелија домаћина. Они су у суштини велики молекули.
- Форма и функција
Прокариоте су најбројнији и најзаступљенији организми на Земљи. То је зато што их њихови разноврсни и често високо прилагодљиви метаболизми чине високо прилагодљивим енормном варијетету станишта. Осим насељавања умереног и аеробног окружења, одређене врсте бактерија могу да успевају или чак да захтевају услове који су непријатељски према еукариотама, као што су неуобичајена хемијска окружења, високе температуре (до 130 °C) и недостатак кисеоника. Штавише, велика репродуктивна брзина прокариота (оптимално 20 мин. по ћелијској деоби за многе врсте) дозвољава им да искористе подесне услове, а обратно, способност многих бактерија да формирају отпорне споре омогућава им да преживе неповољне услове.
- Анатомија прокариота
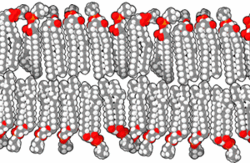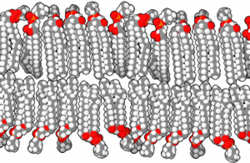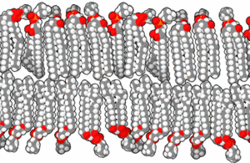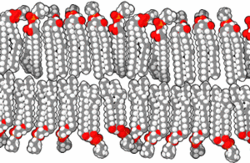
Прокариоте, које је први уочио изумитељ микроскопа Антони ван Левенхук 1683. године,[61][62] су углавном у опсегу величина од 1 до 10 μm. Оне имају три основна облика: сферични (cocci),[63][64] и хеликсно завијени (spirilla),[65][66][67] мада све имају исти општи дизајн. Оне су обавијене, као и све ћелије, са ~70 Å дебелом ћелијском мембраном (плазменом мембраном), која се састоји од липидног двослоја[68] у коме су смештени протеини[69] помоћу којих се контролише пролаз молекула у и из ћелије, и катализује мноштво различитих реакција. Ћелије већине прокариотских врста су окружене и крутим, 30 до 250 Å дебелим, полисахаридним ћелијским зидом који углавном функционише као ћелијска заштита од механичких повреда и онемогућава пуцање ћелија у медијима који су осмотски разблаженији од ћелијског садржаја. Неке бактерије се додатно облажу са желатинозном полисахаридном капсулом која их штити од одбрамбених механизама виших организама. Мада прокариотама недостају мембранске унутарћелијске органеле које су карактеристичне за еукариоте, њихова ћелијска мембрана може да буде исавијана са унутрашње стране, чиме се формирају вишеслојне структуре познате као мезозоми.[70][71][72] Сматра се да мезозоми служе као места репликације ДНК и других специјализованих ензимских реакција.[70][73]
Прокариотска цитоплазма (ћелијски садржај) није хомоген раствор. Њихов један хромозом (ДНК молекул, чијих неколико копија могу да буду присутне у брзо растућим ћелијама) је кондензован и формира тело познато као нуклеоид.[74] Цитоплазма исто тако садржи бројне копије РНК молекула (рибонуклеинске киселине), разне растворљиве ензиме (протеине који катализују специфичне реакције), и више хиљада честица са 250 Å пречником које су познате као рибозоми. Они су места на којима долази до синтезе протеина.
Многе бактеријске ћелије имају један или више додатака у облику бича познатих као флагеле, које се користе за кретање.[75][76][77] Поједине бактерије исто тако имају филаментне пројекције зване пили, неки типови којих функционишу као канали кроз које се размењује ДНК током сексуалне конјугације (процеса у коме се ДНК преноси из једне ћелије у другу; прокариоте се обично репродукују путем бинарне фисије) или као помоћ при везивању бактерија за ћелије организма домаћина. Бактерија Ешерихија коли[78][79] (скраћено E. coli која је добила име по свом откривачу, Теодору Ешериху[80]) најбоље је биолошки окарактерисан организам, што је исход интензивних биохемијских и генетичких студија током задњих 70 година. Ћелије овог нормалног становника црева виших сисара су типично 2 μm дугачки штапићи који су пречника 1 μm и имају тежину од ~2 × 1012 g. Њена ДНК, која има молекулску масу од 2,5 × 109 далтона (D), кодира ~4300 протеина (од који је само ~60 до 70% било идентификовано), мада је типично само ~2600 различитих протеина присутно у ћелији у било ком тренутку. Све заједно E. coli садржи 3 до 6 хиљада различитих типова молекула, укључујући протеине, нуклеинске киселине, полисахариде, липиде и разне мале молекуле и јоне.
| Молекуларна композиција E. coli | |
|---|---|
| Компонента | Тежински проценти |
| H2O | 70 |
| Протеини | 15 |
| ДНК | 1 |
| РНК | 6 |
| Полисахариди и прекурзори | 3 |
| Липиди и прекурзори | 2 |
| Други мали молекули | 1 |
| Неоргански јони | 1 |
- Прокариотски метаболички извори енергије
Нутрициони захтеви прокариота су енормно разноврсни. Аутотрофи (грчки: autos, сам + trophikos, хранити) могу да синтетишу све своје ћелијске конституенте из једноставних молекула као што су H2O, CO2, NH3, и H2S.[81] Да би то чинили као и да би извршавали друге функције потребан им је извор енергије. Хемолитотрофи (Greek: lithos, stone) добијају своју енергију путем оксидације органских једињења као што су NH3, H2S, и чак Fe2+:
- 2 NH3 + 4 O2 → 2 HNO3 + 2 H2O
- H2S + 2 O2 → H2SO4
- 4 FeCO3 + O2 + 6 H2O → 4 Fe(OH)3 + 4 CO2
Студије су указале на постојање екстензивних мада екстремно споро-растућих колонија хемолитотрофа који живе и до 5 km испод површине и чија агрегатна биомаса је упоредиве величине са организмима који обитавају на површини.[82]
Фотоаутотрофи су аутотрофи који добијају енергију путем фотосинтезе, процеса у коме светлосна енергија напаја трансфер електрона са неорганских донора на CO2 чиме се формирају угљени хидрати [(CH2O)n]. У најраспрострањенијем облику фотосинтезе, донор електрона у реакционој секвенци коју покреће светло је H2O.
- n CO2 + n H2O → CH2On + n O2
Овај процес спроводе цијанобактерије (нпр., зелени муљни организми који живе на зидовима акваријума; цијанобактерије које су раније биле познате као модрозелене бактерије), као и биљке.[83] Сматра се да је путем ове форме фотосинтезе генерисан O2 у Земљиној атмосфери. Неке врсте цијанобактерија имају способност конвертовања N2 из атмосфере у органска једињења азота. Ова способност фиксације азота[84] омогућава им да задовоље најосновније нутриционе захтеве свих организама: Са изузетком њихове потребе за малим количинама минералних материјала, ови организми дословно могу да живе од сунчеве светлости и ваздуха.
У примитивнијој форми фотосинтезе, супстанце као што су H2, H2S,[85] тиосулфат, или органска једињења су донори електрона у реакцијама које покреће светлост, као што је
- n CO2 + 2n H2S → CH2On + n H2O + 2n S
Пурпурне и зелене фотосинтетичке бактерије које користе ове процесе насељавају бескисеоничне хабитате попут плитких муљних језера у којима се H2S генерише из трулеће органске материје.
Хетеротрофи (грчки: hetero, другачије) добијају енергију путем оксидације органских једињења и стога су ултиматно зависни од аутотрофа као извора тих супстанци. Облигаторни аероби (у које се убрајају животиње) морају да користе O2,[86] док анаероби користе оксидујуће агенсе као што су сулфати (сулфатно редукујуће бактерије[87][88]) или нитрати (денитрификујуће бактерије[89][90]). Многи организми могу да парцијално метаболишу разна органска једињења путем интрамолекуларних оксидационо-редукционих процеса познатих као ферментација. Факултативни анаероби као што је E. coli могу да расту било у присуству или одсуству O2.[79][91] Облигатни анаероби, за разлику од тога, бивају отровани присуством O2.[86][92] Сматра се да њихови метаболизми наликују на метаболизме најранијих животних форми (које су се појавиле пре више од 3,8 милијарди година кад у Земљиној атмосфери није било O2. У сваком случају, постоји релативно мали број органских једињења која не могу да буду метаболизована путем неког прокариотског организма.
Еукариоте
[уреди | уреди извор]
Еукариотске ћелије су генерално 10 до 100 μm у пречнику и тако имају хиљаду до милион пута већу запремину од типичне прокариоте. Међутим најзначајнија разлика која најбоље карактерише еукариотске ћелије није њихова величина, већ изобиље органела уоквирених мембранама, сваки тип којих има специјализоване функције. Заправо, еукариотска структура и функције су сложенији од прокариотских на свим нивоима организације, од молекуларног нивоа навише. Еукариоти и прокариоти су се развили следећи фундаментално различите еволуционе стратегије.
Прокариоте су искористиле предности једноставности и минијатуризације.[93][94][95] Њихова брза стопа раста дозвољава им да заузимају еколошке нише[96] у којима може доћи до драстичних флуктуација расположивих хранљивих материја.[97][98] Насупрот томе, сложеност еукариота, која их чини већим и споријим у погледу раста од прокариота, пружа им конкурентну предност у стабилним окружењима са ограниченим ресурсима. Стога је погрешно разматрати прокариоте као еволутивно примитивне у односу на еукариоте. Оба типа организама су добро прилагођена њиховим животним стиловима.
Најстарији познати микрофосили еукариота потичу од пре ~1,4 милијарди година, неких 2,4 милијарди година након појаве живота. Ова опсервација подржава класичну идеју да су еукариоте потекле од високо развијених прокариота, вероватно микоплазме. Међутим, разлике између еукариота и модерних прокариота су тако дубоке да је ова хипотеза мало вероватна. Могуће је да су ране еукариотске ћелије, које су према Везеовим доказима еволуирале из примордијалне животне форме, биле релативно неуспешне и стога ретке.[99][100][101] Тек након што су развиле неке од комплексних органела, еукариотске ћелије су постале заступљене у довољној мери за стварање значајних фосилних остатака.
- Ћелијска архитектура

Еукариотске ћелије, попут прокариота, обавијене су ћелијском мембраном. Велика величина еукариотских ћелија доводи до тога да су њихови односи између површине и запремине знатно мањи од оних код прокариота (површина објекта се повећава као квадрат њеног радијуса, док запремина то чини као куб). Ово геометријско ограничење, заједно са чињеницом да су многи есенцијални ензими везани за мембрану, делимично рационализују велике количине интрацелуларних мембрана код еукариота (ћелијска мембрана обично чини <10% мембранског садржаја еукариотске ћелије). Пошто сва материја која улази или напушта ћелију мора на неки начин да прође кроз њену ћелијску мембрану, величина површине многих еукариотских ћелија је повећана бројним пројекцијама и/или инвагинацијама. Штавише, делови ћелијске мембране често досежу до унутрашњости, у процесу познатом као ендоцитоза,[102][103] Стога, еукариотске ћелије могу да „прогутају” и дигестирају честице хране као што су бактерије, док су прокариоте ограничене на апсорпцију појединачних молекула хранљивих материја. Супротно од ендоцитозе, процес који се назива егзоцитоза, чест је еукариотски секреторни механизам.[104]
- Једро

Једро, најупадљивија органела еукариотске ћелије, је спремиште њених генетских информација. Ове информације су кодиране у базним секвенцама молекула ДНК који формирају дискретан број хромозома, карактеристичан за сваку врсту. Хромозоми се састоје од хроматина, комплекса ДНА и протеина.[105][106] Количина генетичких информација које преносе еукариоти је огромна; на пример, људска ћелија има преко 700 пута више ДНК од E. coli [у смислу рачунарске меморије, геном (генетски садржај) у свакој људској ћелији садржи око 800 мегабајта информација]. Унутар једра се генетичка информација кодирана у ДНК молекулима транскрибује у РНК молекуле, који се након екстензивне обраде транспортују у цитоплазму (код еукариота, садржај ћелије без једра), где они учествују у рибозомској синтези протеина. Омотач једра се састоји од двоструке мембране која је перфорирана бројним порама ширине ~90 Å, које регулишу проток протеина и РНК између језгра и цитоплазме.
Једро већине еукариотских ћелија се састоји од бар једног тела које бива тамно обојено, познатог као нуклеолус, које је место рибозомског склопа.[107] Оно садржи хромозомске сегменте са вишеструким копијама гена који специфицирају рибозомну РНК. Ти гени се транскрибују у нуклеолусу, и резултирајућа РНК се комбинује са рибозомалним протеинима који су унети са места где су синтетисани у цитосолу.[108] Резултирајући непотпуно формирани рибозоми се затим враћају у цитосол, где се довршава њихово формирање. Синтеза протеина се скоро искључиво одвија у цитосолу.
- Ендоплазматични ретикулум и Голђијев апарат модификују мембранске и секреторне протеине
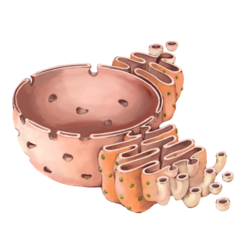
Најопсежнија мембранска конструкција у ћелији, коју је открио Кит Портер 1945. године,[109][110] формира лавиринтску творевину која се назива ендоплазматични ретикулум. Велики део ове органеле, који се назива храпавим ендоплазматичним ретикулумом, садржи знатан број рибозома који посредују синтезу мембранских и секреторних протеина.[111][112][113] Глатки ендоплазматични ретикулум, који не садржи рибозоме, је локација липидне синтезе.[114][115] Многи продукти који су синтетисани у ендоплазматичном ретикулуму затим бивају транспортовани у Голђијев апарат[116] (назван по Камилу Голђију,[117][118] који га је први описао 1898. године[119][120]), стог равних мембранских врећа у којима се ови производи даље обрађују.
- Митохондрија као место оксидативног метаболизма
Митохондрије (грчки: mitos, конац + chondros, гранула) су локације ћелијског дисања (аеробног метаболизма) код скоро свих еукариота.[121] Ове цитоплазмичне органеле, које су довољно велике да су их открили цитолози деветнаестог века, варирају у погледу величине и облика, али су углавном елипсоидне са димензијама од око 1,0 × 2,0 μm, попут бактерија. Еукариотске ћелије типично садрже око 2000 митохондрија, које заузимају око једне петине њихове тоталне запремине.[122]
Митохондрија, као што је првобитно показано електронско микроскопским изучавањима Ђеорга Палада[123] и Фритјофа Сјостранда,[124][125] има две мембране:[126] глатку спољашњу мембрану и веома наборану унутрашњу мембрану чије се инвагнације називају кристама[127][128] (латински: crests). Митохондрија садржи два прегратка, простор унутрашње мембране и простор унутрашњег матрикса. Ензими који катализују реакције дисања су компоненте било желатинозног матрикса или унутрашње митохондријске мембране. Ови ензими спрежу оксидацију нутријената којом се ослобађа енергија са синтезом аденозин трифосфата (АТП) при чему се конзумира енергија. Аденозин трифосфат, након преноса до остатка ћелије, користи се за напајање разних процеса у којима се конзумира енергија.[129]
Митохондрије наликују на бактерије, и то не само у погледу величине. Њихов матрични простор садржи за митохондрије специфичне ДНК, РНК и рибозоме који учествују у синтези неколико митохондријских компоненти. Штавише, оне се репродукују путем бинарне фисије, и респираторни процеси које оне посредују у знатној мери подсећају на оне које се одвијају у модерним аеробним бактеријама. Ова запажања су довела до широко прихваћене хипотезе коју је заговарала Лин Маргулис[130][131] да су митохондрије еволуирале из првобитно самосталних грам негативних аеробних бактерија, које су формирале симбиотички однос са примордијалним анаеробним еукариотама. Хранљиве материје које еукариоте прилажу за бактеријску конзумацију се сматра да су вишеструко надокнађене високо ефикасним оксидативним метаболизмом који бактерије пружају еукариотама. Ова хипотеза је подржана запажањем да amoeba Pelomyxa palustris, једна од малобројних еукариота без митохондрија, живи у перманентном симбиотичком односу сличне природе са аеробним бактеријама.
- Лизозоми и пероксизоми су контејнери деградативних ензима

Лизозоме је открио Кристијан де Див 1949. године.[133][134] Ове органеле су ограничене једноструком мембраном. Лизозоми могу да буду варијабилне величине и да имају различите морфологије, мада су њихови пречници углавном у опсегу 0,1 до 0,8 μm. Лизозоми, су есенцијално мембранске „вреће” које садрже мноштво различитих хидролитичких ензима, и стога они учествују у варењу материјала који су унети путем ендоцитозе и у рециклирању ћелијских компоненти.[135][136] Цитолошка истраживања су открила да се лизозоми формирају путем пупљења из Голђијевог апарата.
Пероксизоми (такође познати као микротела) органеле су окружене мембраном, са типично 0,5 μm у пречнику, које садрже оксидативне ензиме.[137][138] Оне су добиле име по пероксизомалним реакцијама којима се генерише водоник пероксид (H2O2), реактивна супстанца која се било користи у ензиматској оксидацији других супстанци или се деградира путем реакције диспропорционације посредоване ензимом каталаза:[139][140]
- 2 H2O2 → 2 H2O + O2
Сматра се да пероксизоми функционишу тако што штите сензитивне ћелијске компоненте од оксидативних напада H2O2. Поједине биљке садрже специјализовани тип пероксизома, глиоксизом,[141] који је тако назван јер је место на коме се одвијају серије реакција које се колективно називају глиоксилатни циклус.[142]
- Цитоскелетон

Цитосол је далеко од хомогеног раствора. То је високо организовани гел који може значајно да варира по свом саставу у разним деловима ћелије. Велики део његове унутрашње варијабилности произилази из дејства цитоскелета, опсежних мрежа филамента које дају ћелији њен облик и способност кретања, и које су одговорне за распоред и унутрашње кретање њених органела.[144][145]
Најупадљивије цитоскелетне компоненте су микротубуле, цеви са пречником од ~250 Å које се састоје од протеина тубулина.[146][147] Они чине потпорни оквир који наводи кретања органела унутар ћелије. На пример, митотско вретено је скуп микротубула и придружених протеина који учествују у раздвајању репликованих хромозома током дељења ћелија. Микротубуле су исто тако главни састојци цилија, додатака налик на длаке које многе ћелије имају, који се покрећу попут бичева чиме се помера околна течност или се крећу појединачне ћелије кроз раствор. Веома дуге цилије, као што су спермни репови, који се називају флагелама (прокариотске флагеле, које се састоје од протеина флагелина,[148][149] сасвим су различите и неповезане са онима код еукариота).

Микрофиламенти су влакна пречника од ~90 Å која се састоје од протеина актина.[150][151] Микрофиламенти, као и микротубуле, имају функцију механичког подржавања. Осим тога, путем њихове интеракције са протеином миозином, микрофиламенти формирају контрактилне конструкције које су одговорне за многе форме интрацелуларног кретања, као што је цитоплазмични проток и формирање ћелијских испупчења или инвагинација. Актин и миозин су главне протеинске компоненте мишића.
Трећа главна компонента цитоскелета су интермедијерни филаменти.[152][153][154] Они су протеинска влакна пречника од 100 до 150 Å. Њихова висока заступљеност у деловима ћелија који су подложни механичком стресу указује на то да имају носећу функцију. На пример, кожа код виших животиња садржи опсежну мрежу прелазних филамената израђених од протеина кератин, који је у највећој мери одговоран за жилавост ове заштитне спољашње покривке. За разлику од микротубула и микрофиламената, протеини који формирају прелазне филаменте значајно се разликују по величини и саставу, како међу различитим типовима ћелија унутар датог организма, тако и међу одговарајућим типовима ћелија у различитим организмима.
- Крути ћелијски зидови биљних ћелија

Биљне ћелије садрже све претходно описане органеле. Оне исто тако имају неколико додатних својстава, од којих је најочигледнији крути ћелијски зид који лежи изван ћелијске мембране. Ћелијски зидови, чија је главна компонента влакнаста полисахаридна целулоза, пружају структурну јачину биљкама.
Вакуола је простор затворен мембраном који је испуњен флуидом. Иако се и у животињским ћелијама јављају вакуоле, оне су најистакнутије у биљним ћелијама, где оне типично заузимају 90% запремине зреле ћелије. Вакуоле функционишу као складишта за храну, отпатке и специјализиране материјале као што су пигменти. Релативно висока концентрација раствора унутар вакуола узрокује да оне осмотски преузимају воду, чиме се подиже њихов унутрашњи притисак. Овај ефекат, у комбинацији са отпорношћу ћелијских зидова на пуцање, у великој мери је одговоран за крутост бездрвних биљака.
- Хлоропласти


Једна од дефинитивних карактеристика биљака је њихова способност да врше фотосинтезу. Место одвијања фотосинтезе су органеле познате као хлоропласти, који иако су генерално неколико пута већи од митохондрија, подсећају на њих у смислу да оба опа типа органела имају унутрашњу и спољашњу мембрану. Штавише, унутрашњи мембрански простор хлоропласта, строма,[157] сличан је митохондријалној матрици јер садржи мноштво растворних ензима.
Међутим, унутрашња хлоропластна мембрана није наборана у кристе. Уместо тога строма обухвата трећи мембрански систем који формира међусобно повезане свежњеве врећица у облику дискова који се називају тилакоиди,[158][159] које садрже фотосинтетички пигмент хлорофил.[160][161] Тилакоиди користе хлорофилом заробљену светлосну енергију за генерисање ATP молекула, који се затим користе у строми за погон биосинтетских реакција којима се формирају угљени хидрати и други производи.[162][163]
Хлоропласти, попут митохондрија, садрже њихове сопствене ДНК, РНК и рибозоме, и они се репродукују фисијом. Сматра се да су хлоропласти, слично митохондријама, еволуирали из древних цијанобактерија које су попримиле симбиотички вид кохабитације у нефотосинтетичким еукариотским прецима. Заправо, неколико данашњих нефотосинтетских еукариота има управо такав симбиотски однос са аутентичним цијанобактеријама. Због тога већина данашњих еукариота представља генетске „мешанце” у смислу да они истовремено имају једрене, митохондријске и, у случају биљака, хлоропластне линије наслеђивања.
Биомолекули
[уреди | уреди извор]Четири главне класе молекула у биохемији (које се често називају биомолекулима) су угљени хидрати, липиди, протеини, и нуклеинске киселине.[164] Многи биолошки молекули су полимери: у тој терминологији, мономери су релативно мали микромолекули који се повезују и тиме се креирају велики макромолекули познати као полимери. Кад се мономери повезују при синтези биолошког полимера, они подлежу процесу дехидрационе синтезе. Различити макромолекули могу да формирају веће комплексе, који су често потребни за биолошку активност.
Угљени хидрати
[уреди | уреди извор]Функције угљених хидрата су складиште енергије и структура. Шећери су угљени хидрати, међутим постоје и угљени хидрати који нису шећери. На Земљи угљени хидрати су најраспрострањенији биомолекули. Најједноставнији угљени хидрат је моносахарид, који се између осталог састоји од угљеника, водоника, и кисеоника, у односу 1:2:1 са генералном формулом CnH2nO где је n најмање 3. Глукоза, један од најбитнијих угљених хидрата, је пример моносахарида, као и фруктоза, шећер који даје воћу сладак укус.[165][a]
Моносахарид може да пређе из ацикличне форме отвореног ланца у цикличну форму, путем реакције нуклеофилне адиције између карбонилне групе и једне од хидроксилних група истог молекула. Реакција формира прстен од атома угљеника који је затворен кисеоничним мостом. Резултирајући молекул садржи хемиацеталну или хемикеталну групу, у зависности од тога да ли је линеарна форма била алдоза или кетоза. Ово је повратна реакција, те постоји равнотежа између цикличне и отворене форме молекула.[166]

У цикличним формама, прстен обично има 5 или 6 атома. Те форме се називају фуранозама и пиранозама — по аналогији са фураном и пираном, најједноставнијим једињењима са истим угљенично-кисеоничним прстеном (мада њима недостају двоструке везе које су присутне у та два молекула). На пример, алдохексозна глукоза може да формира хемиацеталну везу између хидроксила на угљенику 1 и кисеоника на угљенику 4, чиме настаје молекул са петочланим прстеном, који се назива глукофураноза. Иста реакција може да се одвије између угљеника 1 и 5 чиме се формира молекул са шесточланим прстеном, који се назива глукопираноза. Цикличне форме са седмочланим прстеном (попут оксепана), се ретко срећу, а називају се хептозама.
Два моносахарида могу бити спојена помоћу дехидрације, реакције у којој се на свака два спојена моносахарида добија један молекул воде. У тој реакцији са једног моносахарида се одваја један атом водоника, а са другог моносахарида се одваја хидроксилна група (-ОН) и таква два моносахарида се споје, док се њиховим спајањем добија један молекул воде H—OH тј. H2O. Новонастали молекул од два моносахарида се сада назива дисахарид. Обрнути процес, стварање два моносахарида од једног дисахарида се назива хидролиза, када молекул воде напада везу између два спојена шећера. Најпознатији дисахарид је сахароза, обични шећер, који се у научном контексту зове кухињски шећер како би се разликовао од осталих шећера. Сахароза се састоји од молекула глукозе и молекула фруктозе. Још један важан дисахарид је лактоза, који се састоји од спојених молекула глукозе и галактозе. Већина људи временом смањује производњу ензима лактазе који помоћу реакције хидролизе раздваја лактозу у моносахариде, глукозу и галактозу. Резултат смањивања заступљености лактазе у организму је настанак лактозне нетолеранције, односно код особа извесних старосних група које имају смањене концентрације лактазе конзумација млека и млечних производа постаје проблематична.

Када се неколико, нпр. 3 до 6 моносахарида споји, тај ланац молекула се зове олигосахарид (олиго значи више). Ови молекули се често користе у телу као маркери и сигнална једињења, а имају и низ других улога.
Дужи моносахаридни ланци се називају полисахаридима. Они се могу јавити у виду једног дугог линеарног ланца, или у облику разгранатог система. Два најзаступљенија полисахарида су целулоза и гликоген, оба се састоје од понављајућих мономера глукозе. Биљке стварају целулозу која је важна структурна компонента ћелијског зида. Људска бића не могу да произведе целулозу, и исто тако не могу да је сварују. Гликоген је угљени хидрат који људи и животиње користе као складиште енергије.
Глукоза је важан извор енергије у већини облика живота. Велики број катаболичких процеса (видети катаболизам) је могућ захваљујући глукози. Глукоза се употребљава у једном веома важном процесу - гликолизи, у којем је циљ да се од једног молекула глукозе добију два молекула пирувата, при чему се формирају два молекула ATP-а, ћелијске енергетске валуте, заједно са два редукована еквивалента у виду NAD-а који се претвара у NADH. Овај процес не захтева кисеоник. Ако кисеоник није доступан NADH се преводи у првобитан облик, NAD; конвертовањем пиривата у лактат (код човека на пример) или у етанол (код гљива).
У аеробним ћелијама са довољно кисеоника, као што су многе људске ћелије, пируват подлеже метаболизму при чему се неповратно трансформише у ацетил-КоА, уз отпуштање једног атома угљеника у виду нуспродуката, угљен-диоксида. Притом се ствара један молекул АТП-а и редукује један NAD молекул (NAD у NADH). Два молекула ацетил-КоА (настала из једног молекула глукозе) се затим укључују у Кребсов циклус, притом стварајући још два молекула ATP, 6 молекула NADH и два молекула FADH2. Укупан број молекула ATP-а који се добија овим путем је 32. Из овага се јасно види да комплетна оксидација глукозе пружа организму знатну количину енергије, и чега следи да се комплексан живот на Земљи појавио тек онда кад је атмосфера у себи имала велике количине кисеоника.
Код кичмењака током контрактовања мишића, на пример при трчању, дизању тегова, брзом ходању, организам не добија довољно кисеоника како би одржао ниво енергије којим би се омогућиле те радње. Када дође то тога, ћелије се пребацују са аеробног метаболизма (кад је кисеоник доступан) на анаеробни метаболизам (кад кисеоник није доступан) и претварају глукозу у лактат (млечну киселину). Јетра може да регенерише глукозу, процесом глуконеогенезе.
Липиди
[уреди | уреди извор]
Липиди сачињавају разноврсну групу молекула и у извесној мери се тај термин односи на сва једињења биолошког порекла која су релативно нерастворна у води или неполарна, укључујући воскове, масне киселине, из масних киселина изведене фосфолипиде, сфинголипиде, гликолипиде, и терпеноиде (нпр, ретиноиде и стероиде). Неки липиди су линеарни алифатични молекули, док други имају структуре прстена. Део липида су ароматична једињења, док преостали нису. Неки су флексибилни, док су други крути.[169]
Липиди се обично састоје од једног молекула глицерола и комбинације других молекула. У триглицеридима, који су најзаступљенија група липида, присутан је један молекул глицерола и три масне киселине. Масне киселине се сматрају мономером у овом случају, и могу да буду засићене (без двоструких веза у угљоводоничном ланцу) или незасићени (с једном или више двоструких веза на угљоводоничном ланцу).[168]
Већина липида има делом поларни карактер мада су углавном неполарни. Генерално, највећи део њихове структуре је неполаран или хидрофобан, и стога они избегавају интеракције са поларним растварачима попут воде. Други део њихове структуре је поларан или хидрофилан и има јаку тенденцију асоцирања са поларним растварачима попут воде. Присуство поларног и неполарног сегмента даје липидима амфифилни карактер. У случају холестерола, једина поларна група је -OH (хидроксил или алкохол), док су код фосфолипида, поларне групе знатно веће и поларније, као што је описано испод.[170]
Липиди су интегрални део људске исхране. Већина уља и млечних производа које се користе за кување и јело, попут маслаца, сира, топљеног масла итд., се састоји од масти. Биљна уља су богата разним полинезасићеним масним киселинама (PUFA). Храна која садржи липиде подлеже варењу у телу и бива разложена у масне киселине и глицерол, који су финални продукти деградације масти и липида. Липиди, а посебно фосфолипиди, се исто тако користе у разним фармацеутским производима, било као помоћна средства за побољшање растварања (нпр., у парентералним инфузијама) или као носеће компоненте лекова (нпр., у липозомима или трансферзомима).
Протеини
[уреди | уреди извор]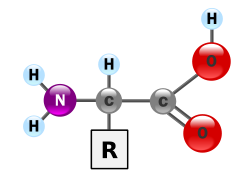
Протеини су веома велики молекули – макро-биополимери – направљени од мономера званих аминокиселине. Аминокиселина се састоји од атома угљеника за који је везана једна амино група, —NH2, једна карбоксилна група, —COOH (мада оне постоје као —NH3+ и —COO− под физиолошким условима), једног атома водоника, и једног бочног ланца, који се обично обележава са „—R”. Бочни ланац „R” је различит за сваку аминокиселину. Постоји двадесет протеиногених (стандардних) аминокиселина. „R”-групе чине сваку аминокиселину особеном, и својства бочног ланца имају велики утицај на свеукупну тродимензионалну конформацију протеина. Неке аминокиселине имају функције као самостални молекули или у модификованим формама; на пример, глутамат делује као важан неуротрансмитер. Аминокиселине се могу спојити путем пептидних веза.[171][172] У тој дехидратационој синтези, молекул воде се уклања и пептидна веза повезује азот једне аминокиселине са угљеником карбоксилне групе друге аминокиселине. Резултирајући молекул се назива дипептидом. Кратки ланци аминокиселина (обично са мање од тридесет аминокиселинских остатака) се називају пептидима или полипептидима. Дужи ланци се називају протеинима. На пример, важан протеин крвног серума је албумин, који се састоји од 585 аминокиселинских остатака.[173][174]


Протеини могу да имају структурне и/или функционалне улоге. На пример, кретања протеина актина и миозина су ултиматно одговорна за контракције скелеталних мишића. Једно својство које многи протеини имају је њихово специфично везивање за извесне класе молекула—они могу да буду екстремно селективни у погледу тога за шта се везују. Антитела су један пример протеина који се везује за један специфичан тип молекула. Антитела се састоје од тешких и лаких ланаца. Два тешка ланца могу да буду повезана са два лака ланца путем дисулфидних веза између њихових аминокиселина. Антитела остварују специфичност путем варијација базираних на разлика у N-терминалним доменима.[179][180]
Заправо, имуносорбентни тест повезан са ензимом (ELISA),[181][182] који користи антитела, је један од најсензитивнијих тестова које модерна медицина користи за детектовање разних биомолекула. Вероватно најважнији протеини, међутим, су ензими. Виртуално све реакције у живим ћелијама захтевају посредовање ензима ради снижавања енергије активације реакције. Ти молекули препознају специфичне молекуле реактаната који се називају супстратима; они затим катализују реакцију између њих. Путем снижавања енергије активације,[183] ензим може да убрза стопу одвијања реакције и за 1011 или више пута; реакције којима би требало преко 3.000 година да се спонтано окончају могу да се одвију за секунду у присуству ензима.[184][185] Сам ензим се при томе не уграђује у реакционе продукте, већ је остаје слободан да катализује исту реакцију са новим сетом супстрата. Користећи разне модификаторе, активност ензима може да буде регулисана, чиме се омогућава контрола биохемијских процеса у ћелији као целини.[186][187]
Структура протеина традиционално се описује у виду хијерархије са четири нивоа. Примарна структура протеина се састоји од линеарне секвенце аминокиселина;[188][189][190] на пример, „аланин-глицин-триптофан-серин-глутамат-аспарагин-глицерин-лизин-…”. Секундарна структура протеина се односи на локалну морфологију (морфологија је проучавање структуре).[191][192][193] Поједине комбинације аминокиселина имају тенденцију да попримају облик завојнице, која се назива α-хеликс или да се групишу у равни које се називају β-равнима; примери α-хеликса се могу видети у горњем шематском приказу хемоглогина. Терцијарна структура протеина се односи на целокупни тродимензионални облик протеина.[194][195][196] Тај облик је превасходно одређен секвенцом аминокиселина. Заправо, промена појединачне аминокиселине може да промени целокупну структуру. Алфа ланац хемоглобина садржи 146 аминокиселинских остатака; заменом глутаматног остатка у позицији 6 са валинским остатком мења се понашање хемоглобина у тој мери да то доводи до српасте анемије. Коначно, кватернарна структура протеина се односи на структуру протеина са вишеструким пептидним подјединицама, као што је хемоглобин са своје четири подјединице.[197][198] Немају сви протеини више од једне подјединице.[199]

Протеини који се уносе као храна обично прво бивају разложени до појединачних аминокиселина и дипептида у танком цреву, и затим апсорбовани. Они могу да буду поново састављени чиме се формирају нови протеини. Интермедијерни производи гликолизе, циклуса лимунске киселине, и пута пентозног фосфата могу да буду кориштени за формирање свих двадесет аминокиселина, и већина бактерија и биљки поседује све неопходне ензиме за синтезу свих протеиногених аминокиселина. Људи и други сисари, међутим, могу да синтетишу само око половине њих. Они не могу да синтетишу изолеуцин, леуцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. То су есенцијалне аминокиселине, јер је есенцијално да се унесу путем исхране.[204][205] Сисари поседују ензиме за синтезу аланина, аспарагина, аспартата, цистеина, глутамата, глутамина, глицина, пролина, серина, и тирозина, које су стога неесенцијалне аминокиселине. Они додуше могу да синтетишу аргинин и хистидин, али не могу да произведу довољне количине да се задовоље потребе младих и растућих животиња, тако да се оне често исто тако сматрају есенцијалним аминокиселинама.
Ако се амино група уклони са аминокиселине, она оставља за собом угљенични скелетон такозване α-кетокиселине. Ензими који се називају трансаминазе могу да са лакоћом пренесу амино групу са једне аминокиселине (претварајући је у α-кетокиселину) на другу α-кетокиселину (правећи од ње аминокиселину).[206][207][208] Ово је важна способност при биосинтези аминокиселина, јер се у многим синтетичким путевима, интермедијери из других биохемијских путева конвертују до α-киселинског скелетона, путем трансаминације.[209] Аминокиселине се затим могу повезати чиме се формира протеин.[210]
Сличан процес се користи за разлагање протеина. Они се прво хидролизују у његове саставне аминокиселине. Слободни амонијак (NH3), који постоји као амонијум јон (NH4+) у крви, је токсичан за животне форме. Подесан метод за његово излучивање стога мора да постоји. Различите тактике су развијене у процесу еволуције у различитим животињама, у зависности од потреба животиње. Једноћелијски организми једноставно испуштају амонијак у окружење. Слично томе, кошљорибе могу да испусте амонијак у воду, где брзо бива разблажен. Сисари генерално претварају амонијак у уреју, путем циклуса уреје.[211]
Да би се утврдило да ли су два протеина повезана, или другим речима да би се одлучило да ли су хомологни или не, научници користе методе поређења секвенци. Методе као што су поравнавање секвенци[212][213] и структурно поравнавање[214][215] су моћна оружја која помажу научницима да идентифкују хомологе међу сродним молекулима.[216] Релевантност налажења хомолога међу протеинима иде изван опсега формирања еволуционих патерна протеинских фамилија. Путем одређивања у којој мери су две протеинске секвенце сличне,[217] стиче се знање о њиховој потенцијалној структури и у извесној мери о њиховој функцији.
Нуклеинске киселине
[уреди | уреди извор]
Нуклеинске киселине, које се тако називају због њихове преваленције у ћелијском једру (нуклеусу), су генеричко име за фамилију биополимера. Оне су комплексни, биохемијски макромолекули велике молекулске тежине који имају способност преноса генетичких информација у свим живим ћелијама и вирусима.[3] Њихови мономери се називају нуклеотидима, и сваки се састоји од три компоненте: азотне хетероцикличне базе (било пурина или пиримидина), пентозног шећера,[220] и фосфатне групе.[221]

Најзаступљеније нуклеинске киселине су дезоксирибонуклеинске киселине (ДНК) и рибонуклеинске киселине (РНК).[222] Фосфатна група и шећер сваког нуклеотида се међусобно везују и формирају основу нуклеинске киселине, док се информације складиште у виду секвенци азотних база. Далеко највише кориштене азотне базе су аденин, цитозин, гуанин, тимин, и урацил. Азотне базе једног нуклеинско киселинског ланца формирају водоничне везе са азотним базама комплементарног ланца (попут рајсфершлуса). Аденин се везује са тимином и урацилом, тимин само са аденином, а цитозин и гуанин се међусобно везују. У погледу заступљености: аденин, цитозин и гуанин се јављају у ДНК и РНК, док се тимин јавља само у ДНК, а урацил само у РНК.
Осим што су генетички материјал ћелије, нуклеинске киселине често играју улогу секундарног гласника,[223][224] и формирају основу молекула аденоозин трифосфата (АТП),[225][226] молекула који је примарни носицац енергије у свим живим организмима.[227]
Метаболизам
[уреди | уреди извор]Живи организми нису у равнотежи. Напротив, они захтевају континуирани прилив слободне енергије за одржавање реда у окружењу настројеном максимизирању нереда. Метаболизам је комплексан процес путем која живи системи стичу и користе слободну енергију која им је неопходна за обављање њихових различитих функција. Они то раде спрезањем ексергонских реакција оксидације храњивих материја са ендергонским процесима који су потребни за одржавање стања живота, као што је извођење механичког рада, активни транспорт молекула насупрот концентрацијског градијента и биосинтеза комплексних молекула.
Фототрофи (биљке и поједине бактерије; стичу слободну енергију од Сунца путем фотосинтезе, процеса у коме светлосна енергија напаја ендергонску реакцију CO2 и H2O чиме се формирају угљени хидрати и O2. Хемотрофи добијају своју слободну енергију путем оксидације органских једињења (угљених хидрата, липида, протеина) преузетих од других организама, који су ултиматни фототрофи. Ова слободна енергија се најчешће спреже са ендергоним реакцијама путем посредничке синтезе високо енергетских фосфатних једињења као што је аденозин трифосфат. Осим што бивају у потпуности оксидовани, нутријенти се разлажу у серији метаболичких реакција до заједничких интермедијера који се користе као прекурзори у синтези других биолошких молекула.
Изузетна особина живих система је да, упркос сложености њихових унутрашњих процеса, они одржавају стабилно стање.[228][229] То се уверљиво доказује на пример запажањем да у временском периоду од 40 година нормална одрасла особа конзумира дословно тоне храњивих материја и преко 20.000 литара воде, али да то чини без значајне промене тежине. Ово стабилно стање се одржава путем софистицираног сета метаболичких регулаторних система.[230][231]
Метаболички путеви
[уреди | уреди извор]Метаболички путеви су серија консекутивних ензимских реакција којима се формирају специфични производи. Њихови реактанти, интермедијери и продукти се називају метаболитима. Организам користи мноштво метаболита, и стога има знатан број метаболичких путева.[232] Метаболичка мапа типичне ћелије садржи мноштво међусобно повезаних путева.[233][234][235] Свака реакција на мапи је катализована специфичним ензимом. Садашња ензимска класификација садржи више од пет хиљада типова ензима.[236][237] На први поглед ова мрежа реакција изгледа веома комплексно, међутим стављањем фокуса на главне области, као што су путеви глукозне оксидације, комплексни систем се може лакше разумети.[238]
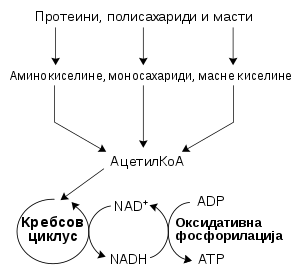
Реакциони путеви који сачињавају метаболизам обично су деле у две категорије:
- Катаболизам, или деградација, при чему се нутријенти и ћелијски конституенти разлажу уз ослобађање енергије да би се искористили њихови састојци и/или генерисала слободна енергија.[239]
- Анаболизам, или биосинтеза, при чему се биомолекули синтетишу из једноставнијих компоненти.[240] Слободна енергија ослобођена катаболичким процесима се конзервира путем синтезе ATP из ADP и фосфата, или путем редукције коензима NADP+ до NADPH. ATP i NADPH су главни извори слободне енергије за анаболичке путеве.[241]
Упадљива карактеристика деградативног метаболизма јесте претварање великог броја различитих супстанци (угљених хидрата, липида и протеина) у заједничке интермедијере. Ови међупроизводи се даље метаболишу у централном оксидативном путу који се завршава у неколико крајњих производа. Хранљиве материје се прво разлажу до њихових мономерних јединица, и затим до заједничког интермедијера, ацетил-коензима А. Биосинтеза се одвија у супротном смеру. Релативно мали број метаболита, углавном пирувати, ацетил-КоА, и интермедијери циклуса лимунске киселине, служе као почетни материјали за мноштво различитих биосинтетичких производа.
Пет главних карактеристика метаболичких путева проистичу из њихове функције генерисања продуката за потребе ћелије:
- Метаболички путеви су иреверзибилни. Високо егзотермне реакције (које имају велике негативне промене слободне енергије) су иреверзибилне. Оне другим речима теку до завршетка. Ако је таква реакција први корак вишестепеног пута, она одређује смер пута, и чини целокупан пут неповратним.
- Катаболички и анаболички путеви се разликују. Ако су два метаболита метаболички разменљива, путања од првог до другог мора се разликовати од путање од другог до првог. То је зато што ако се метаболит 1 претвара у метаболит 2 ексергонским процесом, конверзија метаболита 2 у метаболит 1 захтева да се обезбеди слободна енергија како би се омогућило одвијање ендергонског процеса. Из тог разлога се две путање морају разликовати у бар једној од њихових реакција. Постојање независних путева интерконверзије представља важну особину метаболичких путева, јер омогућава независну контролу оба процеса. Ако је метаболит 2 неопходан за ћелију, неопходно је да се искључи путања која води од метаболита 2 до метаболита 1, и активира путања супротног смера. Таква независна контрола би била немогућа без различитих путања.
- Сваки метаболички пут има први усмеравајући корак. Иако су метаболички путеви неповратни, већина њихових компонентних реакција функционише близу равнотежних услова. Међутим, на почетку сваког пута постоји иреверзибилна (ексергонска) реакција која „усмерава” интермедијере који су њени продукти да наставе секвенцу хемијских промена следећи дату путању.[242]
- Сви метаболички путеви су регулисани. Метаболички путеви су регулисани законима потражње и понуде.[243] Да би се вршила контрола флукса метаболита дуж метаболичког пута, неопходно је да се регулише њихов метаболички корак којим се ограничава свеукупна брзина. Први усмеравајући корак, који је иреверзибилан, одвија се превише споро да би се омогућило његовим супстратима и продуктима да се уравнотеже (ако би реакције биле у равнотежи, оне не би могле да буду неповратне). Већина других реакција путање функционише у близини равнотеже, и стога је усмеравајући корак онај који ограничава брзину. Већина метаболичких путева је контролисана регулацијом ензима који катализује први усмеравајући корак или кораке. То је ефикасан начин вршења контроле, јер се тиме спречава беспотребна синтеза метаболита у даљим деловима путање, ако они нису неопходни.
| Метаболичке функције еукариотских органела | |
|---|---|
| Органела | Функција |
| Митохондрија | Циклус лимунске киселине, електронски транспорт и оксидативна фосфорилација, оксидација масних киселина, разлагање аминокиселина |
| Цитосол | Гликолиза, пут пентоза фосфата, синтеза масних киселина, многе реакције глуконеогенеза |
| Лизозоми | Ензиматско варење ћелијских компоненти и унетих материја |
| Једро | Репликација и транскрипција ДНК, посттранскирпционе модификације РНК |
| Голђијев апарат | Посттранслациона модификација мембранских и секреторних протеина; формирање ћелијске мембране и секреторних везикула |
| Грануларни ендоплазматични ретикулум | Синтеза мембранских и секреторних протеина |
| Глатки ендоплазматични ретикулум | Биосинтеза липида и стероида |
| Пероксизоми (глиоксизоми код биљака) | Оксидативне реакције посредоване аминокиселинским оксидазама и каталазама; реакције глиоксилатног циклуса у биљкама |
- Метаболички путеви у еукариотским ћелијама се одвијају на специфичним ћелијским локацијама. Компартментализација еукариотске ћелије омогућава да се различити метаболички путеви одвијају на различитим локацијама, као што је наведено у табели. На пример, ATP се превасходно генерише у митохондријама, док се углавном користи у цитоплазми. Синтеза метаболита у специфичним мембрански ограниченим потћелијским компартманима чини њихов транспорт између компартмана виталном компонентом еукариотског метаболизма. Услед неполарне природе биолошких мембрана оне су у великој мери непропусне за већину јонских и поларних супстанци, тако да те материје могу да пролазе кроз мембране једино уз помоћ специфичних протеина. Биолошке мембране су селективно пермеабилне за метаболите услед присуства специфичних транспортних протеина у мембранама. Такви протеини су неопходни за посредовање свог трансмембранског кретања јона, као што су Na+, K+, Ca2+, и Cl-, као и метаболита као што су пируват, аминокиселине, шећери и нуклеотиди, па чак и воде (упркос њене релативно високе пермеабилности у двослоју). Транспортни протеини су исто тако одговорни за све биолошке електрохемијске феномене, као што је на пример неуротрансмисија. Синтеза и употреба ацетил-КоА су исто тако компартментализовани. Овај метаболички интермедијер се користи у цитосолној синтези масних киселина, али се синтетише у митохондријама. У вишећелијским организмима, компартментализација се јавља и на вишим нивоима ткива и органа. Сисарска јетра, на пример, у великој мери је одговорна за синтезу глукозе из прекурзора који нису угљено хидратне природе (глуконеогенеза),[244] како би се одржао релативно константан ниво глукозе у циркулацији,[245] док је масно ткиво специјализовано за складиштење и мобилизацију триацилглицерола.[246]
Угљени хидрати као извори енергије
[уреди | уреди извор]Глукоза је извор енергије многих животних форми. На пример, полисахариди се разлажу у њихове мономере (гликогенска фосфорилаза[247][248][249] уклања глукозни остатак са гликогена). Дисахариди као што су лактоза или сахароза се разлажу у њихова два саставна моносахарида.
Анаеробна гликолиза
[уреди | уреди извор]Глукоза се углавном метаболизује путем веома важног метаболичког пута са десет корака који се назива гликолиза,[250][251] нето резултат чега је разлагање једног молекула глукозе у два молекула пирувата. Овим се исто тако производе нето два молекула ATP, енергетске валуте ћелије, заједно са два редукујућа еквивалента конвертовања NAD+ (никотинамид аденин динуклеотид: оксидованог облика) у NADH (никотинамид аденин динуклеотид: редукованог облика). Овај процес не захтева учешће кисеоника; ако кисеоник није доступан (или ако ћелија не може да користи кисеоник), NAD се обнавља конвертовањем пурувата до лактата (млечне киселине) (нпр., код људи) или до етанола и угљен-диоксида (нпр., код квасца). Други моносахариди као што су галактоза и фруктоза се могу конвертовати у интермедијере гликолитичког пута.[252]
Аеробна гликолиза
[уреди | уреди извор]У аеробним ћелијама са довољним приступом кисеонику, као што је случај са већином људских ћелија, пируват се даље метаболизује. Он се иреверзибилно конвертује у ацетил-КоА, при чему се одваја један атом угљеника као отпадни производ угљен-диоксид, чиме се генерише још један редукујући еквивалент NADH. Два молекула ацетил-КоА (из једног молекула глукозе) затим улазе у циклус лимунске киселине,[253][254][255][256] производећи још два молекула АТП, шест NADH молекула и два редукована убихинона (путем FADH2 као кофактора везаног за ензим), и долази до отпуштања преосталог атома угљеника у виду угљен-диоксида. Формиране NADH и хинолне молекуле затим преузимају ензимски комплекси респираторног ланца, ланца транспорта електрона[257][258] који преносе електроне ултиматно до кисеоника и конзервирају ослобођену енергију у виду протонског градијента кроз мембрану (унутрашње митохондријске мембране код еукариота). На тај начин кисеоник се редукује до воде, а оригинални акцептор електрона NAD+ и хинон се регенеришу. Из тог разлога људи, као и низ других организама, удишу кисеоник и издишу угљен-диоксид. Енергија ослобођена преносом електрона из високо енергетских стања у NADH и хинолу је конзервирана прво као протонски градијент, а затим се конвертује до ATP помоћу ATP синтазе.[259][260][261] Овим се генерише додатних 28 молекула ATP (24 из 8 NADH + 4 из 2 хинола), тако да се укупно добија 32 молекула ATP по деградираном молекулу глукозе (рачунајући два из гликолизе и два из цитратног циклуса).[262] Јасно је да коришћење кисеоника за комплетну оксидацију глукозе пружа организму далеко више енергије неко било које средство које је независно од кисеоника. То се сматра разлогом из кога су се комплексне животне форме појавиле тек након што је Земљина атмосфера акумулирала велике количине кисеоника.
Глуконеогенеза
[уреди | уреди извор]Код кичмењака, енергично контрахујући скелетални мишићи (током дизања тегова, или спринтовања, на пример) не добијају довољно кисеоника да задовоље потражњу за енергијом, и стога они прелазе на анаеробни метаболизам, при чему конвертују глукозу у лактат.[263][264] Јетра регенерише глукозу, користећи процес који се назива глуконеогенеза.[265][266][267] Овај процес не стоји у потпуној супротности са гликолизом, и њиме се заправо троши три пута већа количина енергије него што се добија гликолизом (шест молекула ATP се користи, у поређењу са два која се добијају гликолизом). Аналогно горњим реакцијама, произведена глукоза може затим да подлегне гликолизи у ткивима којима је неопходна енергија, да буде ускладиштена у виду гликогена (или скроба у биљкама), или може да буде конвертована у друге моносахариде или уграђена у ди- или олигосахариде. Комбиновани путеви гликолизе током физичке активности, пренос лактата путем крвотока до јетре, накнадна гликонеогенеза и отпуштање глукозе у крвоток се називају Коријев циклус.[268][269]
Однос са другим биолошким наукама „молекулске скале”
[уреди | уреди извор]
Биохемијски истраживачи користе специфичне технике које су устаљене у пољу биохемије, мада у све већој мери долази до њиховог комбиновања са техникама и идејама које су развијене у пољима генетике, молекуларне биологије и биофизике. Никада није постојало оштро разграничење између тих дисциплина у погледу садржаја и техника. У данашње време, термини молекуларна биологија и биохемија скоро да су узајамно синонимни. Следећа слика је шематски приказ који приказује једно могуће гледиште односа између поља:
- Биохемија је студија хемијских супстанци и виталних процеса који се одвијају у живим организмима. Биохемичари стављају примарни фокус на улози, функцији и структури биомолекула. Изучавање хемије у основи биолошких процеса и синтеза биолошки активних молекула су примери биохемијских активности.
- Генетика је студија утицаја генетичких разлика на организме. Ове разлике се често могу уочити путем одсуства нормалне компоненте (нпр, једног гена), у студијама „мутаната” – организама са промењеним геном што доводи до тога да се организам разликује у односу на такозвани „дивљи тип” или нормални фенотип. Генетичке интеракције (епистазе) често могу да отежају једноставна тумачења таквих „нокаут” студија (уклањања или додавања гена).
- Молекуларна биологија је студија молекуларне основе процеса репликације, транскрипције и транслације генетичког материјала. Централна догма молекуларне биологије према којој се генетичким материјал транскрибује у РНК и затим транслира у протеин, упркос тога што је прекомерно поједностављен приказ молекуларне биологије, још увек пружа добру почетну тачку за разумевање поља. Ово гледиште, међутим, подлеже ревизијама у светлу открића нових улога улога РНК.[270]
- Хемијска биологија настоји да развије нове алате на бази малих молекула који омогућавају минималне пертурбације биолошких система уз пружање детаљних информација о њиховој функцији. Осим тога, хемијска биологија примењује биолошке системе да креира вештачке хибриде између биомолекула и синтетичких конструкција (на пример пражњење вирусних капсида којим се може испоручити генска терапија или молекул лека).[271]
Напомене
[уреди | уреди извор]a. ^ Фруктоза није једини шећер присутан у воћу. Глукоза и сахароза су исто тако присутне у варирајућим количинама у разном воћу, и у немим случајевима количински надмашују присутну фруктозу. На пример, 32% јестиве порције порције датуле је глукоза, у поређењу са 23,70% фруктозе и 8,20% сахарозе. Брескве садрже више сахарозе (6,66%) него фруктозе (0,93%) или глукозе (1,47%).[272]
Види још
[уреди | уреди извор]- Часопис Biochemistry
- Часопис Biological Chemistry
- Биофизика
- Хемијска екологија
- Моделовање биолошких система
- ЕЦ број
- Хипотетични типови биохемије
- Међународна унија за биохемију и молекуларну биологију
- Метаболом
- Метаболомика
- Молекуларна биологија
- Молекуларна медицина
- Физиологија биљака
- Протеолиза
- Мали молекули
- Структурна биологија
- Кребсов циклус
Референце
[уреди | уреди извор]- ^ „Biochemistry”. acs.org.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert; Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert. Biochemistry (5th изд.). W H Freeman. ISBN 978-0-7167-3051-4.chapter 1
- ^ а б Voet & Voet 2005, стр. 3 harvnb грешка: више циљева (2×): CITEREFVoetVoet2005 (help)
- ^ Karp 2009, стр. 2
- ^ Miller & Spoolman 2012, стр. 62
- ^ Astbury, W.T. (1961). „Molecular Biology or Ultrastructural Biology?” (PDF). Nature (на језику: енглески). 190 (4781): 1124. PMID 13684868. doi:10.1038/1901124a0. Приступљено 4. 8. 2008.
- ^ Shu, Jian-Jun (2017). „A new integrated symmetrical table for genetic codes”. BioSystems. 151: 21—26. PMID 27887904. arXiv:1703.03787
 . doi:10.1016/j.biosystems.2016.11.004.
. doi:10.1016/j.biosystems.2016.11.004.
- ^ Turanov AA, Lobanov AV, Fomenko DE, Morrison HG, Sogin ML, Klobutcher LA, Hatfield DL, Gladyshev VN (јануар 2009). „Genetic code supports targeted insertion of two amino acids by one codon”. Science. 323 (5911): 259—61. PMC 3088105
 . PMID 19131629. doi:10.1126/science.1164748.
. PMID 19131629. doi:10.1126/science.1164748.
- ^ Astbury 1961, стр. 1124 harvnb грешка: више циљева (2×): CITEREFAstbury1961 (help)
- ^ Lodish et al. 2000.
- ^ Solomon, Berg & Martin 2007, стр. 45
- ^ Peet 2012, Chapter 14.
- ^ Finkel, Cubeddu & Clark 2009, стр. 1–4.
- ^ UNICEF 2010, стр. 61, 75
- ^ а б Helvoort 2000, стр. 81
- ^ Hunter 2000, стр. 75.
- ^ Hamblin 2005, стр. 26.
- ^ Hunter 2000, стр. 96–98.
- ^ Clarence 1980, стр. 1–2. sfn грешка: више циљева (2×): CITEREFClarence1980 (help)
- ^ Holmes 1987, стр. xv
- ^ Feldman 2001, стр. 206.
- ^ Rayner-Canham & Rayner-Canham 2005, стр. 136.
- ^ Ziesak & Cram 1999, стр. 169.
- ^ Kleinkauf 1988, стр. 116.
- ^ Ben-Menahem (2009). pp. 2982.
- ^ Amsler 1986, стр. 55.
- ^ Horton 2013, стр. 36.
- ^ Kleinkauf, Döhren & Lothar 1988, стр. 43.
- ^ Edwards 1992, стр. 1161–1173.
- ^ Fiske 1890, стр. 491–420.
- ^ Kauffman & Chooljian 2001, стр. 121–133
- ^ Tropp 2012, стр. 22.
- ^ Tropp 2012, стр. 19–20.
- ^ Krebs 2012, стр. 32
- ^ Butler 2009, стр. 5
- ^ Chandan 2007, стр. 193–194
- ^ Nielsen 1999, стр. 283-303.
- ^ Bugg 2004, стр. 19.
- ^ Shanmugam 2009, стр. 48
- ^ H. C. Longuet-Higgins (1957). „The structures of electron-deficient molecules”. Quarterly Reviews, Chemical Society. 11 (2): 121—133. doi:10.1039/QR9571100121.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Muller, P (1. 1. 1994). „Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077—1184. ISSN 1365-3075. doi:10.1351/pac199466051077.
- ^ а б Miller, S.J. and Orgel, L.E., The Origins of Life on Earth, p. 85, Prentice-Hall (1974)
- ^ Hill HG, Nuth JA (2003). „The catalytic potential of cosmic dust: implications for prebiotic chemistry in the solar nebula and other protoplanetary systems”. Astrobiology. 3 (2): 291—304. PMID 14577878. doi:10.1089/153110703769016389.
- ^ Balm, S. P.; Hare J.P.; Kroto, HW (1991). „The analysis of comet mass spectrometric data”. Space Science Reviews. 56: 185—9. Bibcode:1991SSRv...56..185B. doi:10.1007/BF00178408.
- ^ Bada, Jeffrey L. (2000). „Stanley Miller's 70th Birthday” (PDF). Origins of Life and Evolution of the Biosphere. Netherlands: Kluwer Academic Publishers. 30: 107—12. doi:10.1023/A:1006746205180. Архивирано из оригинала (PDF) 27. 2. 2009. г. Приступљено 21. 6. 2011.
- ^ Britannica Encyclopedia - Aleksandr Oparin
- ^ Oparin 1967, стр. 199–234.
- ^ Pirie, N. W. (1966). „John Burdon Sanderson Haldane. 1892–1964”. Biographical Memoirs of Fellows of the Royal Society. 12: 218—249. doi:10.1098/rsbm.1966.0010.
- ^ Yount 2003, стр. 113–115.
- ^ Miller, Stanley L. (1953). „Production of Amino Acids Under Possible Primitive Earth Conditions” (PDF). Science. 117 (3046): 528. PMID 13056598. doi:10.1126/science.117.3046.528.
- ^ Miller, Stanley L.; Urey, Harold C. (1959). „Organic Compound Synthesis on the Primitive Earth”. Science. 130 (3370): 245. PMID 13668555. doi:10.1126/science.130.3370.245.
- ^ Lazcano, A.; Bada, J. L. (2004). „The 1953 Stanley L. Miller Experiment: Fifty Years of Prebiotic Organic Chemistry”. Origins of Life and Evolution of Biospheres. 33 (3): 235—242. PMID 14515862. doi:10.1023/A:1024807125069.
- ^ Horowitz, N. H. (1945). „On the Evolution of Biochemical Syntheses”. Proceedings of the National Academy of Sciences of the United States of America. 31 (6): 153—157. Bibcode:1945PNAS...31..153H. PMC 1078786
 . PMID 16578152. doi:10.1073/pnas.31.6.153.
. PMID 16578152. doi:10.1073/pnas.31.6.153.
- ^ Horowitz, Norman Harold (1986). To utopia and back: the search for life in the solar system. San Francisco: W.H. Freeman. ISBN 978-0-7167-1766-9.
- ^ https://archive.org/details/b30379805/page/n3. Недостаје или је празан параметар
|title=(помоћ) (1838) - ^ Creekmore, Trisha. „The Science Channel :: 100 Greatest Discoveries: Biology”. Discovery Communications. Архивирано из оригинала 24. 10. 2006. г. Приступљено 17. 10. 2006.
- ^ Masters 2008.
- ^ Here a virus, there a virus, everywhere the same virus?. Trends in Microbiology. 2005;13(6):278–84. doi:10.1016/j.tim.2005.04.003.
- ^ Viral metagenomics. Nature Reviews Microbiology. 2005;3(6):504–10. doi:10.1038/nrmicro1163.
- ^ Chung & Liu 2017
- ^ „Life at the Edge of Sight — Scott Chimileski, Roberto Kolter | Harvard University Press”. www.hup.harvard.edu (на језику: енглески). Приступљено 26. 1. 2018.
- ^ Pommerville 2013
- ^ Sayers; et al. „Bacilli”. National Center for Biotechnology Information (NCBI) taxonomy database. Приступљено 20. 7. 2018.
- ^ Garrity, George M.; Brenner, Don J.; Krieg, Noel R.; Staley, James T. (eds.). Bergey's Manual of Systematic Bacteriology, Volume Two: The Proteobacteria, Part C: The Alpha-, Beta-, Delta-, and Epsilonproteobacteria. New York, New York: Springer. 2005. стр. 354—361. ISBN 978-0-387-24145-6.
- ^ Spirillum на US National Library of Medicine Medical Subject Headings (MeSH)
- ^ Jean, Euzeby. „Spirillum”. List of Prokaryotic names with Standing in Nomenclature. Приступљено 5. 11. 2014.
- ^ Andersen, Olaf S.; Koeppe, II, Roger E. (јун 2007). „Bilayer Thickness and Membrane Protein Function: An Energetic Perspective”. Annual Review of Biophysics and Biomolecular Structure. 36 (1): 107—130. PMID 17263662. doi:10.1146/annurev.biophys.36.040306.132643. Архивирано из оригинала 09. 08. 2019. г. Приступљено 12. 12. 2014.
- ^ Divecha, Nullin; Irvine, Robin F (27. 1. 1995). „Phospholipid signaling” (PDF, 0.04 MB). Cell. 80 (2): 269—278. PMID 7834746. S2CID 14120598. doi:10.1016/0092-8674(95)90409-3.
- ^ а б Robertson, J. D. (1959). „The ultra structure of cell membranes and their derivatives, Biochem”. Soc. Syrup: 3.
- ^ Suganuma, A. (1966). „Studies on the fine structure of Staphylococcus aureus”. J Electron Microsc (Tokyo). 15 (4): 257—61. PMID 5984369.
- ^ Pontefract RD, Bergeron G, Thatcher FS (1969). „Mesosomes in Escherichia coli”. J. Bacteriol. 97 (1): 367—75. PMC 249612
 . PMID 4884819. doi:10.1002/path.1710970223.
. PMID 4884819. doi:10.1002/path.1710970223.
- ^ Nanninga, N. (1971). „The mesosome of Bacillus subtilis as affected by chemical and physical fixation”. J. Cell Biol. 48 (1): 219—24. PMC 2108225
 . PMID 4993484. doi:10.1083/jcb.48.1.219.
. PMID 4993484. doi:10.1083/jcb.48.1.219.
- ^ Thanbichler M, Wang S, Shapiro L (2005). „The bacterial nucleoid: a highly organized and dynamic structure”. J Cell Biochem. 96 (3): 506—21. PMID 15988757. S2CID 25355087. doi:10.1002/jcb.20519.
- ^ Wang Q, Suzuki A, Mariconda S, Porwollik S, Harshey RM (јун 2005). „Sensing wetness: a new role for the bacterial flagellum”. The EMBO Journal. 24 (11): 2034—42. PMC 1142604
 . PMID 15889148. doi:10.1038/sj.emboj.7600668.
. PMID 15889148. doi:10.1038/sj.emboj.7600668.
- ^ Bardy SL, Ng SY, Jarrell KF (фебруар 2003). „Prokaryotic motility structures”. Microbiology. 149 (Pt 2): 295—304. PMID 12624192. doi:10.1099/mic.0.25948-0.
- ^ Silflow CD, Lefebvre PA (децембар 2001). „Assembly and motility of eukaryotic cilia and flagella. Lessons from Chlamydomonas reinhardtii”. Plant Physiology. 127 (4): 1500—7. PMC 1540183
 . PMID 11743094. doi:10.1104/pp.010807.
. PMID 11743094. doi:10.1104/pp.010807.
- ^ Tenaillon O, Skurnik D, Picard B, Denamur E (март 2010). „The population genetics of commensal Escherichia coli”. Nature Reviews. Microbiology. 8 (3): 207—17. PMID 20157339. S2CID 5490303. doi:10.1038/nrmicro2298.
- ^ а б Singleton 1999
- ^ Castellani A, Chalmers AJ (1919). Manual of Tropical Medicine (3rd изд.). New York: Williams Wood and Co.
- ^ Schurr, Sam H. (19. 1. 2011). Energy, economic growth, and the environment. New York. ISBN 9781617260209. OCLC 868970980.
- ^ Voet & Voet 2011, стр. 5
- ^ Smith 2007.
- ^ Postgate 1998
- ^ Chi Chung, Ribbe & Yilin 2014, стр. 147–174
- ^ а б Prescott, Harley & Klein, стр. 130–131
- ^ Muyzer et al. 2004
- ^ Schulze, Ernst-Detlef; Mooney, Harold A. (1993). Biodiversity and ecosystem function. Springer-Verlag. стр. 88—90. ISBN 9783540581031.
- ^ Zumft, W. G (1997). „Cell biology and molecular basis of denitrification.”. Microbiology and Molecular Biology Reviews. 61 (4): 533—616.
- ^ Ji, Bin; Yang, Kai; Zhu, Lei; Jiang, Yu; Wang, Hongyu; Zhou, Jun; Zhang, Huining (август 2015). „Aerobic denitrification: A review of important advances of the last 30 years”. Biotechnology and Bioprocess Engineering (на језику: енглески). 20 (4): 643—651. ISSN 1226-8372. S2CID 85744076. doi:10.1007/s12257-015-0009-0.
- ^ Ryan, KJ; Ray, CG, ур. (2004). Sherris Medical Microbiology (4th изд.). McGraw Hill. стр. 261–271, 273–296. ISBN 978-0-8385-8529-0.
- ^ Brooks et al. 2007
- ^ Brown JR (фебруар 2003). „Ancient horizontal gene transfer”. Nature Reviews. Genetics. 4 (2): 121—32. PMID 12560809. doi:10.1038/nrg1000.
- ^ Forterre P, Philippe H (октобар 1999). „Where is the root of the universal tree of life?”. BioEssays. 21 (10): 871—9. PMID 10497338. doi:10.1002/(SICI)1521-1878(199910)21:10<871::AID-BIES10>3.0.CO;2-Q.
- ^ Poole A, Jeffares D, Penny D (октобар 1999). „Early evolution: prokaryotes, the new kids on the block”. BioEssays. 21 (10): 880—9. PMID 10497339. doi:10.1002/(SICI)1521-1878(199910)21:10<880::AID-BIES11>3.0.CO;2-P.
- ^ „Niche”. Merriam-Webster Dictionary. Merriam-Webster. Приступљено 30. 10. 2014.
- ^ Pocheville 2015, стр. 547–586
- ^ Schoener, Thomas W (2009). „§I.1 Ecological niche”. Ур.: Levin, Simon A.; Carpenter, Stephen R.; H. Charles J. Godfray; Kinzig, Ann P.; Loreau, Michel; Losos, Jonathan B.; Walker, Brian; Wilcove, David S. The Princeton Guide to Ecology. Princeton University Press. ISBN 9781400833023.
- ^ Woese, Carl R.; Kandler, O; Wheelis, M (1990). „Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya” (PDF). Proc Natl Acad Sci USA. 87 (12): 4576—9. Bibcode:1990PNAS...87.4576W. PMC 54159
 . PMID 2112744. doi:10.1073/pnas.87.12.4576. Архивирано из оригинала (PDF) 07. 11. 2017. г. Приступљено 22. 11. 2018.
. PMID 2112744. doi:10.1073/pnas.87.12.4576. Архивирано из оригинала (PDF) 07. 11. 2017. г. Приступљено 22. 11. 2018.
- ^ Woese, C.R.; Magrum, L.J.; Fox, G.E. (1978). „Archaebacteria”. J Mol Evol. 11 (3): 245—51. Bibcode:1978JMolE..11..245W. PMID 691075. doi:10.1007/BF01734485.
- ^ Woese, C. R.; Fox, G. E. (1. 11. 1977). „Phylogenetic structure of the prokaryotic domain: The primary kingdoms”. Proceedings of the National Academy of Sciences. 74 (11): 5088—5090. Bibcode:1977PNAS...74.5088W. ISSN 0027-8424. PMC 432104
 . PMID 270744. doi:10.1073/pnas.74.11.5088.
. PMID 270744. doi:10.1073/pnas.74.11.5088.
- ^ Marsh 2001
- ^ Irajizad, E.; Agrawal, A. (2017). „Clathrin polymerization exhibits high mechano-geometric sensitivity”. Soft matter. 13: 1455—1462. PMC 5452080
 . PMID 28124714. doi:10.1039/C6SM02623K.
. PMID 28124714. doi:10.1039/C6SM02623K.
- ^ Boron, WF & Boulpaep, EL (2012), Medical Physiology. A Cellular and Molecular Approach, 2, Philadelphia: Elsevier[мртва веза]
- ^ Monday, Tanmoy (јул 2010). „Characterization of the RNA content of chromatin”. Genome Res. 20 (7): 899—907. PMC 2892091
 . PMID 20404130. doi:10.1101/gr.103473.109.
. PMID 20404130. doi:10.1101/gr.103473.109.
- ^ Dame, R. T. (мај 2005). „The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin”. Molecular Microbiology. 56 (4): 858—870. PMID 15853876. doi:10.1111/j.1365-2958.2005.04598.x.
- ^ Hernandez-Verdun, Daniele (2006). „Nucleolus: from structure to dynamics”. Histochem. Cell. Biol. 125 (1–2): 127—137. PMID 16328431. doi:10.1007/s00418-005-0046-4.
- ^ Lamond, Angus I.; Sleeman, Judith E. (октобар 2003). „Nuclear substructure and dynamics”. Current Biology. 13 (21): R825—828. PMID 14588256. doi:10.1016/j.cub.2003.10.012.
- ^ Porter KR, Claude A, Fullam EF (1945). „A Study of Tissue Culture Cells by Electron Microscopy”. J Exp Med. 81 (3): 233—246. PMC 2135493
 . PMID 19871454. doi:10.1084/jem.81.3.233.
. PMID 19871454. doi:10.1084/jem.81.3.233.
- ^ Cooper 2000
- ^ Shibata Y, Voeltz GK, Rapoport TA (август 2006). „Rough sheets and smooth tubules”. Cell. 126 (3): 435—9. PMID 16901774. doi:10.1016/j.cell.2006.07.019.
- ^ Terasaki M, Shemesh T, Kasthuri N, Klemm RW, Schalek R, Hayworth KJ, Hand AR, Yankova M, Huber G, Lichtman JW, Rapoport TA, Kozlov MM (јул 2013). „Stacked endoplasmic reticulum sheets are connected by helicoidal membrane motifs”. Cell. 154 (2): 285—96. PMC 3767119
 . PMID 23870120. doi:10.1016/j.cell.2013.06.031.
. PMID 23870120. doi:10.1016/j.cell.2013.06.031.
- ^ Guven J, Huber G, Valencia DM (октобар 2014). „Terasaki spiral ramps in the rough endoplasmic reticulum”. Physical Review Letters. 113 (18): 188101. PMID 25396396. doi:10.1103/PhysRevLett.113.188101.
- ^ „Functions of Smooth ER”. University of Minnesota Duluth.
- ^ Maxfield FR, Wüstner D (октобар 2002). „Intracellular cholesterol transport”. The Journal of Clinical Investigation. 110 (7): 891—8. PMC 151159
 . PMID 12370264. doi:10.1172/JCI16500.
. PMID 12370264. doi:10.1172/JCI16500.
- ^ Davidson, MW (13. 12. 2004). „The Golgi Apparatus”. Molecular Expressions. Florida State University. Архивирано из оригинала 7. 11. 2006. г. Приступљено 20. 9. 2010.
- ^ Mazzarello, Paolo (1999). „Camillo Golgi's Scientific Biography”. Journal of the History of the Neurosciences. 8 (2): 121—131. PMID 11624293. doi:10.1076/jhin.8.2.121.1836.
- ^ „The Nobel Prize in Physiology or Medicine 1906”. www.nobelprize.org. Приступљено 22. 12. 2017.
- ^ Pavelk M, Mironov AA (2008). The Golgi Apparatus: State of the art 110 years after Camillo Golgi's discovery. Berlin: Springer. стр. 580. ISBN 978-3-211-76310-0.
- ^ Fabene PF, Bentivoglio M (1998). „1898–1998: Camillo Golgi and "the Golgi": one hundred years of terminological clones”. Brain Res. Bull. 47 (3): 195—8. PMID 9865849. doi:10.1016/S0361-9230(98)00079-3.
- ^ Henze K, Martin W (новембар 2003). „Evolutionary biology: essence of mitochondria”. Nature. 426 (6963): 127—128. Bibcode:2003Natur.426..127H. PMID 14614484. doi:10.1038/426127a.
- ^ Wiemerslage L, Lee D (март 2016). „Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters”. Journal of Neuroscience Methods. 262: 56—65. PMC 4775301
 . PMID 26777473. doi:10.1016/j.jneumeth.2016.01.008.
. PMID 26777473. doi:10.1016/j.jneumeth.2016.01.008.
- ^ „Prof. George Palade: Nobel prize-winner whose work laid the foundations for modern molecular cell biology”. The Independent. 22. 10. 2008. Архивирано из оригинала 19. 10. 2010. г. Приступљено 9. 2. 2011. Archived. (Internet Archive copy)
- ^ „Leaders in American science”. 1963.
- ^ „Fritiof S. Sjöstrand - Biografi”. Архивирано из оригинала 18. 07. 2011. г., Karolinska Institutet 200 years
- ^ „Hur anatomiska institutionen blev internationellt centrum för elektronmikroskopi”. Архивирано из оригинала 18. 07. 2011. г.
- ^ Griparic, L; van der Bliek, AM (август 2003). „The many shapes of mitochondrial membranes.”. Traffic (Copenhagen, Denmark). 2 (4): 235—44. PMID 11285133. doi:10.1034/j.1600-0854.2001.1r008.x.
- ^ Sjostrand, F (3. 1. 1953). „Systems of double membranes in the cytoplasm of certain tissue cells” (PDF). Nature. 171: 31—32. doi:10.1038/171031a0. Приступљено 11. 1. 2015.
- ^ Campbell, Williamson & Heyden 2006. sfn грешка: више циљева (2×): CITEREFCampbellWilliamsonHeyden2006 (help)
- ^ Schaechter, M (2012). „Lynn Margulis (1938–2011)”. Science. 335 (6066): 302. Bibcode:2012Sci...335..302S. PMID 22267805. doi:10.1126/science.1218027.
- ^ Sagan, Dorion, ур. (2012). Lynn Margulis: The Life and Legacy of a Scientific Rebel. White River Junction: Chelsea Green. ISBN 978-1603584470.
- ^ Holtzclaw, Fred W., et al. AP Biology: to Accompany Biology, Campbell, Reece, 8e AP Edition. Pearson Benjamin Cummings, 2008.
- ^ „The Nobel Prize in Physiology or Medicine 1974”. Nobelprize.org. Nobel Media AB. Приступљено 31. 12. 2014.
- ^ Blobel, Günter (2013). „Christian de Duve (1917–2013) Biologist who won a Nobel prize for insights into cell structure”. Nature. 498 (7454): 300. PMID 23783621. doi:10.1038/498300a.
- ^ Mindell JA (2012). „Lysosomal Acidification Mechanisms”. Annual Review of Physiology. 74 (1): 69—86. PMID 22335796. doi:10.1146/annurev-physiol-012110-142317.
- ^ Settembre C, Fraldi A, Medina DL, Ballabio A (мај 2013). „Signals from the lysosome: a control centre for cellular clearance and energy metabolism”. Nature Reviews Molecular Cell Biology. 14 (5): 283—96. PMC 4387238
 . PMID 23609508. doi:10.1038/nrm3565.
. PMID 23609508. doi:10.1038/nrm3565.
- ^ „Peroxisome”. Online DIctionary. Merriam-Webster. Приступљено 19. 6. 2013.
- ^ Gabaldón T (март 2010). „Peroxisome diversity and evolution”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 765—73. PMC 2817229
 . PMID 20124343. doi:10.1098/rstb.2009.0240.
. PMID 20124343. doi:10.1098/rstb.2009.0240.
- ^ Chelikani P, Fita I, Loewen PC (јануар 2004). „Diversity of structures and properties among catalases”. Cellular and Molecular Life Sciences. 61 (2): 192—208. PMID 14745498. doi:10.1007/s00018-003-3206-5.
- ^ Goodsell, D. S. (1. 9. 2004). „Catalase”. Molecule of the Month. RCSB Protein Data Bank. Приступљено 23. 8. 2016.
- ^ Evert RF, Eichhorn SE (2006). Esau's Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. John Wiley & Sons. ISBN 9780471738435.
- ^ Bednarek P, Pislewska-Bednarek M, Svatos A, Schneider B, Doubsky J, Mansurova M, Humphry M, Consonni C, Panstruga R, Sanchez-Vallet A, Molina A, Schulze-Lefert P (јануар 2009). „A glucosinolate metabolism pathway in living plant cells mediates broad-spectrum antifungal defense”. Science. 323 (5910): 101—6. PMID 19095900. doi:10.1126/science.1163732.
- ^ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (јун 2015). „The evolution of compositionally and functionally distinct actin filaments”. Journal of Cell Science. 128 (11): 2009—19. PMID 25788699. doi:10.1242/jcs.165563.
- ^ Hardin, Jeff; Bertoni, Gregory; Kleinsmith, Lewis J. (2015). Becker's World of the Cell (8th изд.). New York: Pearson. стр. 422–446. ISBN 978013399939-6.
- ^ McKinley 2015.
- ^ Findeisen, P.; Mühlhausen, S.; Dempewolf, S.; Hertzog, J.; Zietlow, A.; Carlomagno, T.; Kollmar, M. (2014). „Six subgroups and extensive recent duplications characterize the evolution of the eukaryotic tubulin protein family”. Genome Biology and Evolution. 6 (9): 2274—2288. PMC 4202323
 . PMID 25169981. doi:10.1093/gbe/evu187.
. PMID 25169981. doi:10.1093/gbe/evu187.
- ^ Turk, Erin; Wills, Airon A.; Kwon, Taejoon; Sedzinski, Jakub; Wallingford, John B.; Stearns, Tim (2015). „Zeta-Tubulin is a Member of a Conserved Tubulin Module and is a Component of the Centriolar Basal Foot in Multiciliated Cells”. Current Biology : Cb. 25 (16): 2177—2183. Bibcode:2015CBio...25.2177T. PMC 4546511
 . PMID 26234217. doi:10.1016/j.cub.2015.06.063.
. PMID 26234217. doi:10.1016/j.cub.2015.06.063.
- ^ Steiner, Theodore S. (21. 11. 2006). „How Flagellin and Toll-Like Receptor 5 Contribute to Enteric Infection”. Infection and Immunity. American Society for Microbiology. 75 (2): 545—552. PMC 1828527
 . doi:10.1128/IAI.01506-06. Архивирано из оригинала (PDF) 22. 04. 2020. г. Приступљено 27. 11. 2018.
. doi:10.1128/IAI.01506-06. Архивирано из оригинала (PDF) 22. 04. 2020. г. Приступљено 27. 11. 2018.
- ^ Vonderviszt, Ferenc; Namba, Keiichi. „Structure, Function and Assembly of Flagellar Axial Proteins”. Austin, TX: Madame Curie Bioscience Database.
- ^ Gunning, P. W.; Ghoshdastider, U; Whitaker, S; Popp, D; Robinson, R. C. (2015). „The evolution of compositionally and functionally distinct actin filaments”. Journal of Cell Science. 128 (11): 2009—19. PMID 25788699. doi:10.1242/jcs.165563.
- ^ Fuchs E, Cleveland DW (јануар 1998). „A structural scaffolding of intermediate filaments in health and disease”. Science. 279 (5350): 514—9. PMID 9438837. doi:10.1126/science.279.5350.514.
- ^ Herrmann H, Bär H, Kreplak L, Strelkov SV, Aebi U (јул 2007). „Intermediate filaments: from cell architecture to nanomechanics”. Nat. Rev. Mol. Cell Biol. 8 (7): 562—73. PMID 17551517. doi:10.1038/nrm2197.
- ^ Karabinos, Anton, Dieter Riemer, Andreas Erber, and Klaus Weber. "Homologues of Vertebrate Type I, II and III Intermediate Filament (IF) Proteins in an Invertebrate: The IF Multigene Family of the Cephalochordate Branchiostoma." FEBS Letters 437.1-2 (1998): 15-18. Web.
- ^ Traub, P. (2012), Intermediate Filaments: A Review, Springer Berlin Heidelberg, стр. 33, ISBN 9783642702303
- ^ Woodward, R. B.; Ayer, W. A.; Beaton, J. M.; Bickelhaupt, F.; Bonnett, R.; Buchschacher, P.; Closs, G. L.; Dutler, H.; Hannah, J.; et al. (јул 1960). „The total synthesis of chlorophyll” (PDF). Journal of the American Chemical Society. 82 (14): 3800—3802. doi:10.1021/ja01499a093.
- ^ Fleming, Ian (14. 10. 1967). „Absolute Configuration and the Structure of Chlorophyll”. Nature. 216 (5111): 151—152. Bibcode:1967Natur.216..151F. doi:10.1038/216151a0.
- ^ Campbell, Williamson & Heyden 2006 harvnb грешка: више циљева (2×): CITEREFCampbellWilliamsonHeyden2006 (help)
- ^ "Photosynthesis" McGraw Hill Encyclopedia of Science and Technology, 10th ed. 2007. Vol. 13 p. 469
- ^ Spraque, S. G. (1987). „Structural and functional organization of galactolipids on thylakoid membrane organization”. J Bioenerg Biomembr. 19 (6): 691—703. PMID 3320041. doi:10.1007/BF00762303.
- ^ Speer, Brian R. (1997). „Photosynthetic Pigments”. UCMP Glossary (online). University of California Museum of Paleontology. Приступљено 17. 7. 2010.
- ^ Muneer, Sowbiya; Kim, Eun Jeong; Park, Jeong Suk; Lee, Jeong Hyun (17. 3. 2014). „Influence of Green, Red and Blue Light Emitting Diodes on Multiprotein Complex Proteins and Photosynthetic Activity under Different Light Intensities in Lettuce Leaves (Lactuca sativa L.)”. International Journal of Molecular Sciences. 15 (3): 4657—4670. ISSN 1422-0067. PMC 3975419
 . PMID 24642884. doi:10.3390/ijms15034657.
. PMID 24642884. doi:10.3390/ijms15034657.
- ^ Mustárdy, L.; Buttle, K.; Steinbach, G.; Garab, G. (2008). „The Three-Dimensional Network of the Thylakoid Membranes in Plants: Quasihelical Model of the Granum-Stroma Assembly”. Plant Cell. 20 (10): 2552—2557. PMC 2590735
 . PMID 18952780. doi:10.1105/tpc.108.059147.
. PMID 18952780. doi:10.1105/tpc.108.059147.
- ^ Aseeva, Elena; Ossenbühl, Friederich; Sippel, Claudia; Cho, Won K.; Stein, Bernhard; Eichacker, Lutz A.; Meurer, Jörg; Wanner, Gerhard; Westhoff, Peter; Jürgen Soll; Ute C. Vothknecht (2007). „Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes”. Plant Physiol Biochem. 45 (2): 119—28. PMID 17346982. doi:10.1016/j.plaphy.2007.01.005.
- ^ Slabaugh 2007, стр. 3–6
- ^ Whiting 1970, стр. 1–31
- ^ Voet & Voet 2005, стр. 358–359. sfn грешка: више циљева (2×): CITEREFVoetVoet2005 (help)
- ^ Stryer 2007, стр. 328.
- ^ а б Voet & Voet 2005. sfn грешка: више циљева (2×): CITEREFVoetVoet2005 (help)
- ^ Fromm & Hargrove 2012, стр. 22–27.
- ^ Voet & Voet 2005, стр. 385–389. sfn грешка: више циљева (2×): CITEREFVoetVoet2005 (help)
- ^ „Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983”. European Journal of Biochemistry. 138 (1): 9—37. 1984. ISSN 0014-2956. doi:10.1111/j.1432-1033.1984.tb07877.x. Архивирано из оригинала 17. 04. 2020. г. Приступљено 19. 11. 2018.
- ^ Muller, P (1. 1. 1994). „Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077—1184. ISSN 1365-3075. doi:10.1351/pac199466051077.
- ^ Metzler 2001, стр. 58
- ^ Universal protein resource accession number P02768 for "Serum albumin" at UniProt.
- ^ Steinberg 2001, стр. 95
- ^ Hardison, RC (1996). „A brief history of hemoglobins: plant, animal, protist, and bacteria”. Proc Natl Acad Sci USA. 93 (12): 5675—79. Bibcode:1996PNAS...93.5675H. PMC 39118
 . PMID 8650150. doi:10.1073/pnas.93.12.5675.
. PMID 8650150. doi:10.1073/pnas.93.12.5675.
- ^ Maton et al. 1993
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). „Is hemoglobin an essential structural component of human erythrocyte membranes?”. J Clin Invest. 42 (4): 581—88. PMC 289318
 . PMID 13999462. doi:10.1172/JCI104747.
. PMID 13999462. doi:10.1172/JCI104747.
- ^ Costanzo 2007
- ^ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). „How antibodies fold”. Trends in Biochemical Sciences. 35 (4): 189—198. PMC 4716677
 . PMID 20022755. doi:10.1016/j.tibs.2009.11.005.
. PMID 20022755. doi:10.1016/j.tibs.2009.11.005.
- ^ Weiland, G. (3. 11. 1978). „[The enzyme-linked immunosorbent assay (ELISA)--a new serodiagnostic method for the detection of parasitic infections (author's transl)]”. MMW, Munchener Medizinische Wochenschrift. 120 (44): 1457—1460. ISSN 0341-3098. PMID 100702.
- ^ Lequin, R. M. (2005). „Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)”. Clinical Chemistry. 51 (12): 2415—8. PMID 16179424. doi:10.1373/clinchem.2005.051532.
- ^ Fersht 1985, стр. 50–2
- ^ Radzicka A, Wolfenden R (јануар 1995). „A proficient enzyme”. Science. 267 (5194): 90—931. Bibcode:1995Sci...267...90R. PMID 7809611. doi:10.1126/science.7809611.
- ^ Callahan BP, Miller BG (децембар 2007). „OMP decarboxylase—An enigma persists”. Bioorganic Chemistry. 35 (6): 465—9. PMID 17889251. doi:10.1016/j.bioorg.2007.07.004.
- ^ Krauss 2003, стр. 89–114
- ^ Changeux JP, Edelstein SJ (јун 2005). „Allosteric mechanisms of signal transduction”. Science. 308 (5727): 1424—8. Bibcode:2005Sci...308.1424C. PMID 15933191. doi:10.1126/science.1108595.
- ^ Sanger 1952, стр. 1–67
- ^ Aasland, Rein; Abrams, Charles; Ampe, Christophe; Ball, Linda J.; Bedford, Mark T.; Cesareni, Gianni; Gimona, Mario; Hurley, James H.; Jarchau, Thomas (20. 2. 2002). „Normalization of nomenclature for peptide motifs as ligands of modular protein domains”. FEBS Letters. 513 (1): 141—144. ISSN 1873-3468. doi:10.1016/S0014-5793(01)03295-1.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T, Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (1. 7. 1968). „A One-Letter Notation for Amino Acid Sequences*”. European Journal of Biochemistry. 5 (2): 151—153. ISSN 1432-1033. PMID 11911894. doi:10.1111/j.1432-1033.1968.tb00350.x.
- ^ Linderstrøm-Lang KU (1952). Lane Medical Lectures: Proteins and Enzymes. Stanford University Press. стр. 115. ASIN B0007J31SC.
- ^ Schellman JA, Schellman CG (1997). „Kaj Ulrik Linderstrøm-Lang (1896–1959)”. Protein Sci. 6 (5): 1092—100. PMC 2143695
 . PMID 9144781. doi:10.1002/pro.5560060516. „He had already introduced the concepts of the primary, secondary, and tertiary structure of proteins in the third Lane Lecture (Linderstram-Lang, 1952)”
. PMID 9144781. doi:10.1002/pro.5560060516. „He had already introduced the concepts of the primary, secondary, and tertiary structure of proteins in the third Lane Lecture (Linderstram-Lang, 1952)”
- ^ Bottomley, Steven (2004). „Interactive Protein Structure Tutorial”. Архивирано из оригинала 19. 12. 2010. г. Приступљено 9. 1. 2011.
- ^ IUPAC. „tertiary structure”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Branden C. and Tooze J. "Introduction to Protein Structure" Garland Publishing, New York. 1990 and 1991.
- ^ Kyte, J. "Structure in Protein Chemistry." Garland Publishing. . New York. 1995. ISBN 978-0-8153-1701-2. Недостаје или је празан параметар
|title=(помоћ) - ^ Clarke 2002
- ^ Chou, Kuo-Chen; Cai, Yu-Dong (1. 11. 2003). „Predicting protein quaternary structure by pseudo amino acid composition”. Proteins: Structure, Function, and Bioinformatics. 53 (2): 282—289. PMID 14517979. doi:10.1002/prot.10500.
- ^ Fromm and Hargrove (2012), pp. 35–51.
- ^ Berman, H. M. (јануар 2008). „The Protein Data Bank: a historical perspective” (PDF). Acta Crystallographica Section A. A64 (1): 88—95. PMID 18156675. doi:10.1107/S0108767307035623.
- ^ Laskowski RA, Hutchinson EG, Michie AD, Wallace AC, Jones ML, Thornton JM (децембар 1997). „PDBsum: a Web-based database of summaries and analyses of all PDB structures”. Trends Biochem. Sci. 22 (12): 488—90. PMID 9433130. doi:10.1016/S0968-0004(97)01140-7.
- ^ Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes. New York: Academic Press. 1979. ISBN 9780323144605.
- ^ McNaught 1997
- ^ Young, V. R. (1994). „Adult amino acid requirements: the case for a major revision in current recommendations”. J. Nutr. 124 (8 Suppl): 1517S—1523S. PMID 8064412.
- ^ „Dietary Reference Intakes: The Essential Guide to Nutrient Requirements”. Архивирано из оригинала 05. 07. 2014. г.. Institute of Medicine's Food and Nutrition Board. usda.gov
- ^ Karmen A, Wroblewski F, Ladue JS (1955). „Transaminase activity in human blood”. The Journal of Clinical Investigation. 34 (1): 126—31. PMC 438594
 . PMID 13221663. doi:10.1172/jci103055.
. PMID 13221663. doi:10.1172/jci103055.
- ^ Karmen A (1955). „A note on the spectrometric assay of glutamic-oxalacetic transaminase in human blood serum”. The Journal of Clinical Investigation. 34 (1): 131—3. PMC 438594
 . PMID 13221664. doi:10.1172/JCI103055.
. PMID 13221664. doi:10.1172/JCI103055.
- ^ Ladue JS, Wroblewski F, Karmen A (1954). „Serum glutamic oxaloacetic transaminase activity in human acute transmural myocardial infarction”. Science. 120 (3117): 497—9. PMID 13195683. doi:10.1126/science.120.3117.497.
- ^ Voet & Voet 2005 harvnb грешка: више циљева (2×): CITEREFVoetVoet2005 (help)
- ^ Fromm & Hargrove 2012, стр. 279–292.
- ^ Sherwood 2012, стр. 558
- ^ Mount 2004
- ^ „Clustal FAQ #Symbols”. Clustal. Архивирано из оригинала 24. 10. 2016. г. Приступљено 8. 12. 2014.
- ^ Lee, Hui Sun; Im, Wonpil (2013). „Ligand Binding Site Detection by Local Structure Alignment and Its Performance Complementarity”. Journal of Chemical Information and Modeling. 53 (9): 2462—2470. PMC 3821077
 . doi:10.1021/ci4003602.
. doi:10.1021/ci4003602.
- ^ Konc, Janez; Janežič, Dušanka (2010). „ProBiS algorithm for detection of structurally similar protein binding sites by local structural alignment”. Bioinformatics. 26 (9): 1160—1168. PMC 2859123
 . PMID 20305268. doi:10.1093/bioinformatics/btq100.
. PMID 20305268. doi:10.1093/bioinformatics/btq100.
- ^ Fariselli 2007, стр. 78–87
- ^ Alexandra Shulman-Peleg; Shatsky, Maxim; Nussinov, Ruth; Wolfson, Haim J (2007). „Spatial chemical conservation of hot spot interactions in protein-protein complexes”. BMC Biology. 5 (43).
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Molecular Biology of the Cell (6th изд.). Garland. стр. Chapter 4: DNA, Chromosomes and Genomes. ISBN 9780815344322. Архивирано из оригинала 14. 07. 2014. г. Приступљено 20. 11. 2018.
- ^ Purcell A. „DNA”. Basic Biology. Архивирано из оригинала 05. 01. 2017. г. Приступљено 20. 11. 2018.
- ^ C.Michael Hogan. 2010. Deoxyribonucleic acid. Encyclopedia of Earth. National Council for Science and the Environment. eds. S.Draggan and C.Cleveland. Washington DC
- ^ Saenger 1984, стр. 84
- ^ Tropp 2012, стр. 5–9
- ^ Kimball, J. „Second messengers”. Архивирано из оригинала 7. 2. 2006. г. Приступљено 8. 1. 2011.
- ^ Second+Messenger+Systems на US National Library of Medicine Medical Subject Headings (MeSH)
- ^ Knowles, J. R. (1980). „Enzyme-catalyzed phosphoryl transfer reactions”. Annu. Rev. Biochem. 49: 877—919. PMID 6250450. doi:10.1146/annurev.bi.49.070180.004305.
- ^ Törnroth-Horsefield, S.; Neutze, R. (децембар 2008). „Opening and closing the metabolite gate”. Proc. Natl. Acad. Sci. USA. 105 (50): 19565—19566. PMC 2604989
 . PMID 19073922. doi:10.1073/pnas.0810654106.
. PMID 19073922. doi:10.1073/pnas.0810654106.
- ^ Knowles 1980, стр. 877–919 harvnb грешка: више циљева (2×): CITEREFKnowles1980 (help)
- ^ Gordon 2017, стр. 9.
- ^ Martin, Elizabeth (2008). A dictionary of biology (6th изд.). Oxford: Oxford University Press. стр. 315–316. ISBN 978-0-19-920462-5.
- ^ Cannon 1932, стр. 177–201
- ^ Cannon, W. B. (1926). „Physiological regulation of normal states: some tentative postulates concerning biological homeostatics”. Ур.: A. Pettit. A Charles Riches amis, ses collègues, ses élèves (на језику: француски). Paris: Les Éditions Médicales. стр. 91.
- ^ Nicholson, Donald E. (март 1971). An Introduction to Metabolic Pathways by S. DAGLEY (Vol. 59, No. 2 изд.). Sigma Xi, The Scientific Research Society. стр. 266.
- ^ „Roche Biochemical Pathways”. Архивирано из оригинала 30. 04. 2011. г. Приступљено 29. 11. 2018.
- ^ „International Union of Biochemistry & Molecular Biology (IUBMB)”.
- ^ „Metabolic pathways - Reference pathway”.
- ^ Moss, G. P. „Recommendations of the Nomenclature Committee”. International Union of Biochemistry and Molecular Biology on the Nomenclature and Classification of Enzymes by the Reactions they Catalyse. Приступљено 14. 3. 2006.
- ^ Webb, E. C. (1992). Enzyme nomenclature 1992: recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes. San Diego: Published for the International Union of Biochemistry and Molecular Biology by Academic Press. ISBN 978-0-12-227164-9.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert; Gatto, Gregory J. (2012). Biochemistry (7th изд.). New York: W.H. Freeman. стр. 429. ISBN 978-1-4292-2936-4.
- ^ Reece 2011, стр. 143
- ^ de Bolster, M.W.G. (1997). „Glossary of Terms Used in Bioinorganic Chemistry: Anabolism”. International Union of Pure and Applied Chemistry. Приступљено 30. 10. 2007.
- ^ Nicholls D.G.; Ferguson S.J. (2002). Bioenergetics (3rd изд.). Academic press. ISBN 978-0-12-518121-1.
- ^ Hunter T (1995). „Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling”. Cell. 80 (2): 225—36. PMID 7834742. doi:10.1016/0092-8674(95)90405-0.
- ^ Suzuki 2015, стр. 53–74
- ^ Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y (март 2004). „Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase”. Structure. 12 (3): 429—38. PMID 15016359. doi:10.1016/j.str.2004.02.005.
- ^ Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, Lesage S, Stoffel M, Takeda J, Passa P (1993). „Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus”. The New England Journal of Medicine. 328 (10): 697—702. PMID 8433729. doi:10.1056/NEJM199303113281005.
- ^ Aarsland A, Chinkes D, Wolfe RR (1997). „Hepatic and whole-body fat synthesis in humans during carbohydrate overfeeding”. The American Journal of Clinical Nutrition. 65 (6): 1774—82. PMID 9174472.
- ^ Baum, H. & Gilbert, G. A. (1953). „A simple method for the preparation of crystalline potato phosphorylase and Q-enzyme”. Nature. 171: 983—984. PMID 13063502.
- ^ Cowgill, R. W. (1959). „Lobster muscle phosphorylase: purfication and properties”. J. Biol. Chem. 234: 3146—3153. PMID 13812491.
- ^ Fischer, Pocker & Saari 1970, стр. 23–68.
- ^ Romano, AH; Conway, T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ Keller; Ralser; Turchyn (април 2014). „Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean”. Mol Syst Biol. 10 (4): 725. PMC 4023395
 . PMID 24771084. doi:10.1002/msb.20145228.
. PMID 24771084. doi:10.1002/msb.20145228.
- ^ Fromm and Hargrove (2012), pp. 163–180.
- ^ Lowenstein 1969
- ^ Kay J, Weitzman PD (1987). Krebs' citric acid cycle: half a century and still turning. London: Biochemical Society. стр. 25. ISBN 978-0-904498-22-6.
- ^ Wagner 2014, стр. 100
- ^ Lane 2009
- ^ Murray, Robert K.; Granner, Daryl K.; Mayes, Peter A.; Rodwell, Victor W. (2003). Harper's Illustrated Biochemistry. New York, NY: Lange Medical Books/ MgGraw Hill. стр. 96. ISBN 978-0-07-121766-8.
- ^ Karp 2009, стр. 194.
- ^ Boyer, P. D. (1993). „The binding change mechanism for ATP synthase - some probabilities and possibilities”. Biochim. Biophys. Acta. 1140: 215—250. PMID 8417777.
- ^ Abrahams, J. P.; Leslie, A.G.W.; Lutter, R.; Walker, J. F. (1994). „Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria”. Nature. 375: 621—628. PMID 8065448.
- ^ Blair, A.; Ngo, L.; Park, J.; Paulsen, I. T.; Saier M.H., Jr. (1996). „Phylogenetic analyses of the homologous transmembrane channel-forming proteins of the FoF1-ATPases of bacteria, chloroplasts and mitochondria”. Microbiology. 142: 17—32. PMID 8581162.
- ^ Voet 2005, Ch. 17 Glycolysis.
- ^ Klein, Lansing & Harley 2006
- ^ Bowen, Richard. „Microbial Fermentation”. Hypertexts for biological sciences. Colorado State University. Архивирано из оригинала 02. 12. 2019. г. Приступљено 29. 4. 2018.
- ^ Silva, Pedro. „The Chemical Logic Behind Gluconeogenesis”. Архивирано из оригинала 26. 8. 2009. г. Приступљено 8. 9. 2009.
- ^ Young, JW (1977). „Gluconeogenesis in cattle: significance and methodology”. J. Dairy Sci. 60 (1): 1—15. PMID 320235. doi:10.3168/jds.S0022-0302(77)83821-6.
- ^ Hundal RS, Krssak M, Dufour S, Laurent D, Lebon V, Chandramouli V, Inzucchi SE, Schumann WC, Petersen KF, Landau BR, Shulman GI (2000). „Mechanism by Which Metformin Reduces Glucose Production in Type 2 Diabetes”. Diabetes. 49 (12): 2063—69. PMC 2995498
 . PMID 11118008. doi:10.2337/diabetes.49.12.2063.
. PMID 11118008. doi:10.2337/diabetes.49.12.2063.
- ^ Fromm and Hargrove (2012), pp. 183–194.
- ^ "„Cori Cycle”. Архивирано из оригинала 23. 04. 2008. г. Приступљено 3. 5. 2008."., from Elmhurst, pp. 1–3.
- ^ Ulveling 2011, стр. 633–644
- ^ Rojas-Ruiz (2011), pp. 2672–2687.
- ^ Whiting, G.C. (1970). pp. 5.
Литература
[уреди | уреди извор]- Wagner, Andreas (2014). Arrival of the Fittest (first изд.). PenguinYork. стр. 100. ISBN 9781591846468.
- Kay J, Weitzman PD (1987). Krebs' citric acid cycle: half a century and still turning. London: Biochemical Society. стр. 25. ISBN 978-0-904498-22-6.
- Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert; Gatto, Gregory J. (2012). Biochemistry (7th изд.). New York: W.H. Freeman. стр. 429. ISBN 978-1-4292-2936-4.
- Klein, Donald W.; Lansing, M.; Harley, John (2006). Microbiology (6th изд.). New York: McGraw-Hill. ISBN 978-0-07-255678-0.
- Reece, Jane B. (2011). Campbell biology / Jane B. Reece ... [et al.]. (9th изд.). Boston: Benjamin Cummings. стр. 143. ISBN 978-0-321-55823-7.
- Suzuki, H. (2015). „Chapter 4: Effect of pH, Temperature, and High Pressure on Enzymatic Activity”. How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. стр. 53—74. ISBN 978-981-4463-92-8.
- Webb, E. C. (1992). Enzyme nomenclature 1992: recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes. San Diego: Published for the International Union of Biochemistry and Molecular Biology by Academic Press. ISBN 978-0-12-227164-9.
- Nicholson, Donald E. (март 1971). An Introduction to Metabolic Pathways by S. DAGLEY (Vol. 59, No. 2 изд.). Sigma Xi, The Scientific Research Society. стр. 266.
- Lane, Nick (2009). Life Ascending: The Ten Great Inventions of Evolution. New York: W.W. Norton & Co. ISBN 978-0-393-06596-1.
- Cannon, W. B. (1926). „Physiological regulation of normal states: some tentative postulates concerning biological homeostatics”. Ур.: A. Pettit. A Charles Riches amis, ses collègues, ses élèves (на језику: француски). Paris: Les Éditions Médicales. стр. 91.
- Cannon, W.B. (1932). The Wisdom of the Body. New York: W. W. Norton. стр. 177—201.
- Lowenstein, J. M. (1969). Methods in Enzymology, Volume 13: Citric Acid Cycle. Boston: Academic Press. ISBN 978-0-12-181870-8.
- Nicholls D.G.; Ferguson S.J. (2002). Bioenergetics (3rd изд.). Academic press. ISBN 978-0-12-518121-1.
- Martin, Elizabeth (2008). A dictionary of biology (6th изд.). Oxford: Oxford University Press. стр. 315–316. ISBN 978-0-19-920462-5.
- Chung, King-thom; Liu, Jong-kang (2017). Pioneers in Microbiology: The Human Side of Science. World Scientific Publishing. ISBN 978-9813202948.
- Mount, D.M. (2004). Bioinformatics: Sequence and Genome Analysis (2nd изд.). Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY. ISBN 978-0-87969-608-5.
- Chi Chung, Lee; Ribbe, Markus W.; Yilin, Hu (2014). „Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane”. Ур.: Kroneck, Peter M. H.; Sosa Torres, Martha E. The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. 14. Springer. стр. 147—174. ISBN 978-94-017-9268-4. PMID 25416393. doi:10.1007/978-94-017-9269-1_6.
- McNaught AD (1997). Compendium of Chemical Terminology (2nd изд.). Oxford: Blackwell Scientific Publications. ISBN 978-0-9678550-9-7.
- Voet, Donald; Voet, Judith G. (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500. Архивирано из оригинала 11. 9. 2007. г. Приступљено 9. 2. 2017.
- Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes. New York: Academic Press. 1979. ISBN 9780323144605.
- Clarke, Jeremy M. Berg; John L. Tymoczko; Lubert Stryer. Web content by Neil D. (2002). „Section 3.5Quaternary Structure: Polypeptide Chains Can Assemble Into Multisubunit Structures”. Biochemistry (5. ed., 4. print. изд.). New York, NY [u.a.]: W. H. Freeman. ISBN 978-0-7167-3051-4.
- Linderstrøm-Lang KU (1952). Lane Medical Lectures: Proteins and Enzymes. Stanford University Press. стр. 115. ASIN B0007J31SC.
- Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0781773119.
- Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- Fersht, A. (1985). Enzyme Structure and Mechanism. San Francisco: W.H. Freeman. стр. 50–2. ISBN 978-0-7167-1615-0.
- Hardin, Jeff; Bertoni, Gregory; Kleinsmith, Lewis J. (2015). Becker's World of the Cell (8th изд.). New York: Pearson. стр. 422–446. ISBN 978013399939-6.
- Krauss, G. (2003). „The Regulations of Enzyme Activity”. Biochemistry of Signal Transduction and Regulation (3rd изд.). Weinheim: Wiley-VCH. стр. 89—114. ISBN 9783527605767.
- Maton, Anthea; Hopkins, Jean; McLaughlin, Charles William; Johnson, Susan; Warner, Maryanna Quon; LaHart, David; Wright, Jill D. (1993). Human Biology and Health. Englewood Cliffs, New Jersey, US: Prentice Hall. ISBN 978-0139811760.
- Evert RF, Eichhorn SE (2006). Esau's Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. John Wiley & Sons. ISBN 9780471738435.
- Sagan, Dorion, ур. (2012). Lynn Margulis: The Life and Legacy of a Scientific Rebel. White River Junction: Chelsea Green. ISBN 978-1603584470.
- Campbell NA, Williamson B, Heyden RJ (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- Pavelk M, Mironov AA (2008). The Golgi Apparatus: State of the art 110 years after Camillo Golgi's discovery. Berlin: Springer. стр. 580. ISBN 978-3-211-76310-0.
- Cooper, Geoffrey M. (2000). „Ch. 1: Section: Electron Microscopy”. The Cell — A Molecular Approach (2nd изд.). Sunderland MA: Sinauer Associates. ISBN 978-0-87893-106-4.
- Marsh, Mark (2001). Endocytosis. Oxford University Press. стр. vii. ISBN 978-0-19-963851-2.
- Schoener, Thomas W (2009). „§I.1 Ecological niche”. Ур.: Levin, Simon A.; Carpenter, Stephen R.; H. Charles J. Godfray; Kinzig, Ann P.; Loreau, Michel; Losos, Jonathan B.; Walker, Brian; Wilcove, David S. The Princeton Guide to Ecology. Princeton University Press. стр. 3. ISBN 9781400833023.
- Schulze, Ernst-Detlef; Mooney, Harold A. (1993). Biodiversity and ecosystem function. Springer-Verlag. стр. 88—90.
- Oparin, A. I. (1967). Bernal, John Desmond, ур. The origin of life. World Pub. Co. стр. 199—234.
- Pocheville, Arnaud (2015). „The Ecological Niche: History and Recent Controversies”. Ур.: Heams, Thomas; Huneman, Philippe; Lecointre, Guillaume; et al. Handbook of Evolutionary Thinking in the Sciences. Dordrecht: Springer. стр. 547—586. ISBN 978-94-017-9014-7.
- Brooks GF, Carroll KC, Butel JS, Morse SA (2007). Jawetz, Melnick & Adelberg's Medical Microbiology (24th изд.). McGraw Hill. стр. 307–312. ISBN 978-0-07-128735-7.
- Ryan, KJ; CG, Ray, ур. (2004). Sherris Medical Microbiology (4th изд.). McGraw Hill. стр. 261–271, 273–296. ISBN 978-0-8385-8529-0.
- Prescott LM, Harley JP, Klein DA (1996). Microbiology (3rd изд.). Wm. C. Brown Publishers. стр. 130–131. ISBN 978-0-697-29390-9.
- Chi Chung, Lee; Markus W., Ribbe; Yilin, Hu (2014). „Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane”. Ур.: Kroneck, Peter M. H.; Sosa Torres, Martha E. The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. 14. Springer. стр. 147—174. ISBN 978-94-017-9268-4. PMID 25416393. doi:10.1007/978-94-017-9269-1_6.
- Clarence, Peter Berg (1980). The University of Iowa and Biochemistry from Their Beginnings. University of Iowa. ISBN 9780874140149.
- Postgate, J. (1998). Nitrogen Fixation (3rd изд.). Cambridge: Cambridge University Press.
- Smith, Gilbert M. (2007). A Textbook of General Botany. READ BOOKS. стр. 148. ISBN 978-1-4067-7315-6.
- Castellani A, Chalmers AJ (1919). Manual of Tropical Medicine (3rd изд.). New York: Williams Wood and Co.
- Singleton, P. (1999). Bacteria in Biology, Biotechnology and Medicine (5th изд.). Wiley. стр. 444–454. ISBN 978-0-471-98880-9.
- Steinberg, MH (2001). Disorders of Hemoglobin: Genetics, Pathophysiology, and Clinical Management. Cambridge University Press. стр. 95. ISBN 978-0521632669.
- Amsler, Mark (1986). The Languages of Creativity: Models, Problem-solving, Discourse. University of Delaware Press. ISBN 978-0874132809.
- Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert; Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (15. 2. 2002). Biochemistry (5th изд.). W H Freeman. ISBN 978-0-7167-3051-4.
- Horowitz, Norman Harold (1986). To utopia and back: the search for life in the solar system. San Francisco: W.H. Freeman. ISBN 978-0-7167-1766-9.
- Ludwig, Wolfgang; Schleifer, Karl-Heinz; Whitman, William B. (2015). „Bacilli class. Nov”. Bergey's Manual of Systematics of Archaea and Bacteria. стр. 1. ISBN 9781118960608. doi:10.1002/9781118960608.cbm00033.
- Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). Molecular cell biology (4th изд.). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- Masters, Barry R (2008). „History of the Optical Microscope in Cell Biology and Medicine” (PDF). eLS (formerly Encyclopedia of Life Sciences) (на језику: енглески). John Wiley & Sons, Ltd. стр. 3. ISBN 9780470015902. doi:10.1002/9780470015902.a0003082.
- Pommerville, J.C. (2013). Fundamentals of Microbiology (10th изд.). Sudbury, MA: Jones & Bartlett. стр. 106. ISBN 9781449647964.
- Watson, James D.; Baker, Tania A.; Bell, Stephen P. (2005). Molecular Biology of the Gene. ISBN 978-0-8053-4642-8.
- Yount, Lisa (2003). A to Z of Biologists. New York, NY: Facts on File, Inc. стр. 113—115. ISBN 978-1-4381-0917-6. Архивирано из оригинала 7. 3. 2017. г.
- Astbury, W.T. (1961). „Molecular Biology or Ultrastructural Biology?” (PDF). Nature. 190 (4781): 1124. Bibcode:1961Natur.190.1124A. PMID 13684868. S2CID 4172248. doi:10.1038/1901124a0. Приступљено 4. 1. 2016.
- Ben-Menahem, Ari (2009). Historical Encyclopedia of Natural and Mathematical Sciences. Springer. стр. 2982. ISBN 978-3-540-68831-0.
- Butler, John M. (2009). Fundamentals of Forensic DNA Typing. Academic Press. ISBN 978-0-08-096176-7.
- Feldman, Burton (2001). The Nobel Prize: A History of Genius, Controversy, and Prestige. Arcade Publishing. ISBN 978-1559705929.
- Chandan, Sen K.; Roy, Sashwati (2007). „miRNA: Licensed to kill the messenger”. DNA Cell Biology. 26 (4): 193—194. PMID 17465885. S2CID 10665411. doi:10.1089/dna.2006.0567.
- Clarence, Peter Berg (1980). The University of Iowa and Biochemistry from Their Beginnings. University of Iowa. ISBN 9780874140149.
- Edwards K.J.; Brown D.G.; Spink, N.; Skelly J.V.; Neidle, S. (1992). „Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution”. J.Mol.Biol. 226 (4): 1161—1173. PMID 1518049. doi:10.1016/0022-2836(92)91059-x.
- Solomon, Eldra P.; Berg, Linda R.; Martin, Diana W. (2007). Biology, 8th Edition, International Student Edition. Thomson Brooks/Cole. ISBN 978-0495317142. Архивирано из оригинала 4. 3. 2016. г. Приступљено 9. 2. 2017.
- Fariselli, Piero; Rossi, Ivan; Capriotti, Emidio; Casadio, Rita (2007). „The WWWH of remote homolog detection: the state of the art”. Briefings in Bioinformatics. 8 (2): 78—87. PMID 17003074. doi:10.1093/bib/bbl032.

- Fiske, John (1890). Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1. Boston and New York: Houghton, Mifflin. Приступљено 16. 2. 2015.
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). Lippencott's Illustrated Reviews: Pharmacology (4th изд.). Lippencott Williams & Wilkins. ISBN 978-0-7817-7155-9.
- Fromm, Herbert J.; Hargrove, Mark (2012). Essentials of Biochemistry. Springer. ISBN 978-3-642-19623-2.
- Hamblin, Jacob Darwin (2005). Science in the Early Twentieth Century: An Encyclopedia. ABC-CLIO. ISBN 978-1-85109-665-7.
- Helvoort, Ton van (2000). Hessenbruch, Arne, ур. Reader's Guide to the History of Science. Fitzroy Dearborn Publishing. ISBN 978-1-884964-29-9.
- Holmes, Frederic Lawrence (1987). Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity. University of Wisconsin Press. ISBN 978-0299099848.
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). Essential Genes. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Horton, Derek, ур. (2013). Advances in Carbohydrate Chemistry and Biochemistry, Volume 70. Academic Press. ISBN 9780124081123.
- Hunter, Graeme K. (2000). Vital Forces: The Discovery of the Molecular Basis of Life. Academic Press. ISBN 978-0-12-361811-5.
- Karp, Gerald (2009). Cell and Molecular Biology: Concepts and Experiments. John Wiley & Sons. ISBN 9780470483374.
- Kauffman, G. B.; Chooljian, S. H. (2001). „Friedrich Wöhler (1800–1882), on the bicentennial of his birth”. The Chemical Educator. 6 (2): 121—133. S2CID 93425404. doi:10.1007/s00897010444a.
- Kleinkauf, Horst; Döhren, Hans von; Lothar, Jaenicke (1988). The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences. Walter de Gruyter & Co. стр. 116. ISBN 9783110852455.
- Knowles, J. R. (1980). „Enzyme-catalyzed phosphoryl transfer reactions”. Annu. Rev. Biochem. 49: 877—919. PMID 6250450. doi:10.1146/annurev.bi.49.070180.004305.
- Metzler, David Everett; Metzler, Carol M. (2001). Biochemistry: The Chemical Reactions of Living Cells. 1. Academic Press. ISBN 978-0-12-492540-3.
- Miller, G.; Scott, Spoolman (2012). Environmental Science - Biodiversity Is a Crucial Part of the Earth's Natural Capital. Cengage Learning. ISBN 978-1-133-70787-5. Приступљено 4. 1. 2016.
- Nielsen, Forrest H. (1999). Shils, Maurice E., ур. Ultratrace minerals; Modern nutrition in health and disease. Baltimore: Williams & Wilkins. стр. 283—303. hdl:10113/46493.
- Peet, Alisa (2012). Marks, Allan; Lieberman Michael A., ур. Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) (4th изд.). Lippincott Williams & Wilkins. ISBN 978-1-60831-572-7.
- Rayner-Canham, Marelene F.; Rayner-Canham, Geoffrey (2005). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century. Chemical Heritage Foundation. ISBN 978-0941901277.
- Rojas-Ruiz, Fernando A; Vargas-Méndez, Leonor; Kouznetsov, Vladimir V. (2011). „Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences”. Molecules. 16 (3): 2672—2687. ISSN 1420-3049. PMC 6259834
 . PMID 21441869. doi:10.3390/molecules16032672
. PMID 21441869. doi:10.3390/molecules16032672  .
. - Saenger, Wolfram (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 978-0-387-90762-8.
- Slabaugh, Michael R.; Seager, Spencer L. (2013). Organic and Biochemistry for Today (6th изд.). Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0.
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). Animal Physiology: From Genes to Organisms. Cengage Learning. ISBN 978-0-8400-6865-1.
- Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th изд.). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (2012). Molecular Biology (4th изд.). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4.
- UNICEF (2010). Facts for life (PDF) (4th изд.). New York: United Nations Children's Fund. ISBN 978-92-806-4466-1. Архивирано из оригинала (PDF) 12. 12. 2018. г. Приступљено 09. 02. 2017.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). „When one is better than two: RNA with dual functions”. Biochimie. 93 (4): 633—644. PMID 21111023. S2CID 22165949. doi:10.1016/j.biochi.2010.11.004.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Essentials of glycobiology. Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6.
- Voet, D; Voet, JG (2005). Biochemistry (3th изд.). Hoboken, NJ: John Wiley & Sons Inc. ISBN 9780471193500. Архивирано из оригинала 11. 9. 2007. г.
- Whiting, G. C. (1970). „Sugars”. Ур.: A.C. Hulme. The Biochemistry of Fruits and their Products. Volume 1. London & New York: Academic Press. ISBN 978-0-12-361201-4.
- Ziesak, Anne-Katrin; Cram, Hans-Robert (1999). Walter de Gruyter Publishers, 1749-1999. Walter de Gruyter & Co. ISBN 978-3110167412.
- Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis and Alexander Johnson, Molecular Biology of the Cell
- , Routledge, March, hardcover, 1616 pages, 7.6 pounds. (4th изд.). 2002. ISBN 978-0-8153-3218-3. Недостаје или је празан параметар
|title=(помоћ) - , Garland. (3rd изд.). 1994. ISBN 978-0-8153-1620-6. Недостаје или је празан параметар
|title=(помоћ) - , Garland. (2nd изд.). 1989. ISBN 978-0-8240-3695-9. Недостаје или је празан параметар
|title=(помоћ)
- , Routledge, March, hardcover, 1616 pages, 7.6 pounds. (4th изд.). 2002. ISBN 978-0-8153-3218-3. Недостаје или је празан параметар
- Fruton, Joseph S. (1999). Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology. Yale University Press: New Haven. ISBN 978-0-300-07608-0.
- Kohler, Robert (1982). From Medical Chemistry to Biochemistry: The Making of a Biomedical Discipline. Cambridge University Press. ISBN 9780521243124..
Спољашње везе
[уреди | уреди извор]- Виртуелна библиотека Биохемије
- Америчко хемијско друштво
- „Biochemical Society”.
- The Virtual Library of Biochemistry and Cell Biology
- Berg, Jeremy Mark; Tymoczko, John L.; Stryer, Lubert (фебруар 2002). Biochemistry (5th изд.). W.H. Freeman. ISBN 978-0-7167-3051-4.
- SystemsX.ch - The Swiss Initiative in Systems Biology
- Full text of Biochemistry by Kevin and Indira, an introductory biochemistry textbook.





