Родопсин
| Родопсин (опсин 2, штап пигмент) (ретинитис пигментоса 4, аутосомно доминантан) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
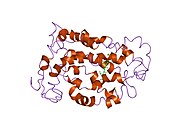
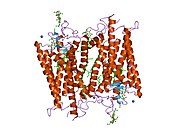
 Сензорни родопсин II (дугиних боја) смештен у липидном двослоју (главе црвено и репови плаво) са трансдуцином испод њега. Gtα је обојен црвено, Gtβ плаво, и Gtγ жуто. ГДП молекул је везан у Gtα-подјединици и коваленто везани ретинал (црно ) је у родопсину. N-терминус родопсина је црвен и C-терминус је плав. Претпостављено анкерисање трансдуцина за мембрану је приказано у црној боји. | |||||||||||
| Доступне структуре | |||||||||||
| 1едс, 1едx, 1ф88, 1гзм, 1хзx, 1јфп, 1л9х, 1лн6, 1у19, 2г87, 2хпy, 2и35, 2и36, 2и37 | |||||||||||
| Идентификатори | |||||||||||
| Симболи | РХО; МГЦ138309; МГЦ138311; ОПН2; РП4 | ||||||||||
| Вањски ИД | ОМИМ: 180380 МГИ: 97914 ХомолоГене: 68068 ГенеЦардс: РХО Гене | ||||||||||
| |||||||||||
| Преглед РНК изражавања | |||||||||||
 | |||||||||||
 | |||||||||||
| подаци | |||||||||||
| Ортолози | |||||||||||
| Врста | Човек | Миш | |||||||||
| Ентрез | 6010 | 212541 | |||||||||
| Енсембл | ЕНСГ00000163914 | ЕНСМУСГ00000030324 | |||||||||
| УниПрот | П08100 | Q8К0Д8 | |||||||||
| РефСеq (мРНА) | НМ_000539 | НМ_145383 | |||||||||
| РефСеq (протеин) | НП_000530 | НП_663358 | |||||||||
| Локација (УЦСЦ) |
Цхр 3: 130.73 - 130.74 Мб |
Цхр 6: 115.9 - 115.9 Мб | |||||||||
| ПубМед претрага | [1] | [2] | |||||||||
Родопсин, мрежњачин пурпур, је пигмент ретине који је одговоран за формирање фоторецепторских ћелија, и за прве догађаје у перцепцији светлости. Родопсини припадају фамилији Г-протеин спрегнутих рецептора и екстремно су сензитивни на светлост, што омогућава вид у слабо-осветљеној средини.[1] Еxпосед то лигхт, тхе пигмент иммедиателy пхотоблеацхес, анд ит такес абоут 30 минутес[2] то регенерате фуллy ин хуманс.
Структура
[уреди | уреди извор]Родопсин се састоји од протеинског дела опсина и реверзибилно ковалентно везаног кофактор, ретинала. Опсин, свежањ седам трансмембранских хеликса међусобно повезаних протеинским петљама, везује ретинал (фотореактивни хромофор), који је лоциран у централној шупљини на лизинском остатку седмог хеликса. Ретинал заузима хоризонталан положај у односу на мембрану. Сваки спољашњи сегмент диска садржи хиљаде визуелних молекула пигмента. Око половине опсина је унутар липидног двослоја. Ретинал настаје у ретини из Витамина А, дијетарног бета-каротена. Изомеризација 11-цис-ретинала у све-транс-ретинал под утицајем светлости индукује конформациону промену (бељење) у опсина, која се наставља са метародопсином II, који активира везани Г протеин трансдуцин, и започиње каскаду секундарних гласника.[2][3][4]
Родопсин штапића најснажније апсорбује зелено-плаву светлост, и зато изгледа црвенкасто-љубичасто. Он се назива "визуелно љубичасто". Родопсин је одговоран за монохроматски вид у тами.[2]

Неколико блиско сродних опсина постоји. Они се разликују у неколико аминокиселина, и консеквентно у таласној дужини светлости коју најјаче апсорбују. Код човека постоје четири различита опсина поред родопсина. Фотопсини се налази у различитим типовима коничних ћелија ретине, и они су база распознавања боја. Они имају максимуме апсорпције за жуто-зелено (фотопсин I), зелено (фотопсин II), и плаво-љубичасто (фотопсин III) светло. Преостали опсин (меланопсин) се налази у фотосензитивним ганглионским ћелијама, и апсорбује најјаче плаву светлост.
Структура родопсина је детаљно проучена путем рендгенске структурне анализе кристала родопсина. Фотоизомеризациона динамика је била истражена путем ФТИР спектроскопије и УВ/Вис спектроскопије. Први фотопродукт, фотородопсин, се формира у току 200 фемтосекунди након ирадијације, чему следи у току неколико пикосекунди други, батородопсин, са деформисаним све-транс везама. Тај интермедијар може да буде заробљен и студиран на криогеним температурама. Више модела (нпр. механизам педала бицикла, хула-твист механизам) покушава да објасни како ретинална група може да промени своју конформацију без сударања са окружујућим родопсин протеинским џепом.[5][6][7]
Недавни налази индицирају да родопсин функционаче као мономер, а не као димер, мада је то дуго времена била устаљена парадигма за Г-спрегнуте протеинске рецепторе.[8]
Референце
[уреди | уреди извор]- ^ Литманн БЈ, Митцхелл DC (1996). „Рходопсин струцтуре анд фунцтион”. Ур.: Лее АГ. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 1—32. ИСБН 978-1-55938-659-3.
- ^ а б в Стуарт ЈА, Бриге РР (1996). „Цхарацтеризатион оф тхе примарy пхотоцхемицал евентс ин бацтериорходопсин анд рходопсин”. Ур.: Лее АГ. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 33—140. ИСБН 978-1-55938-659-3.
- ^ Хофманн КП, Хецк M (1996). „Лигхт-индуцед протеин-протеин интерацтионс он тхе род пхоторецептор дисц мембране”. Ур.: Лее АГ. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 141—198. ИСБН 978-1-55938-659-3.
- ^ Колб Х, Фернандез Е, Нелсон Р, Јонес БW (1. 3. 2010). „Wебвисион: Пхоторецепторс”. Университy оф Утах. Архивирано из оригинала 16. 08. 2000. г.
- ^ Накамицхи Х, Окада Т (2006). „Црyсталлограпхиц аналyсис оф примарy висуал пхотоцхемистрy”. Ангеw. Цхем. Инт. Ед. Енгл. 45 (26): 4270—3. ПМИД 16586416. дои:10.1002/ание.200600595.
- ^ Сцхреибер M, Сугихара M, Окада Т, Бусс V (2006). „Qуантум мецханицал студиес он тхе црyсталлограпхиц модел оф батхорходопсин”. Ангеw. Цхем. Инт. Ед. Енгл. 45 (26): 4274—7. ПМИД 16729349. дои:10.1002/ание.200600585.
- ^ Wеингарт О (2007). „Тхе тwистед Ц11-Ц12 бонд оф тхе рходопсин цхромопхоре--а пхотоцхемицал хот спот”. Ј. Ам. Цхем. Соц. 129 (35): 10618—9. ПМИД 17691730. дои:10.1021/ја071793т.
- ^ „Мономериц Г-Протеин-Цоуплед Рецептор ас а Фунцтионал Унит - Биоцхемистрy (АЦС Публицатионс)”. дои:10.1021/би050720о.
Литература
[уреди | уреди извор]- Хофманн КП, Хецк M (1996). Лее АГ, ур. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 141—198.
- Стуарт ЈА, Бриге РР (1996). Лее АГ, ур. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 33—140.
- Литманн БЈ, Митцхелл DC (1996). Лее АГ, ур. Рходопсин анд Г-Протеин Линкед Рецепторс, Парт А (Вол 2, 1996) (2 Вол Сет). Греенwицх, Цонн: ЈАИ Пресс. стр. 1—32.
- Хумпхриес П, Кенна П, Фаррар ГЈ (1992). „Он тхе молецулар генетицс оф ретинитис пигментоса.”. Сциенце. 256 (5058): 804—8. ПМИД 1589761. дои:10.1126/сциенце.1589761.
- Едwардс СЦ (1995). „Инволвемент оф цГМП анд цалциум ин тхе пхотореспонсе ин вертебрате пхоторецептор целлс.”. Тхе Јоурнал оф тхе Флорида Медицал Ассоциатион. 82 (7): 485—8. ПМИД 7673885.
- ал-Магхтхех M; Грегорy C; Инглехеарн C; et al. (1993). „Rhodopsin mutations in autosomal dominant retinitis pigmentosa.”. Hum. Mutat. 2 (4): 249—55. PMID 8401533. doi:10.1002/humu.1380020403.
- Garriga P, Manyosa J (2002). „The eye photoreceptor protein rhodopsin. Structural implications for retinal disease.”. FEBS Lett. 528 (1-3): 17—22. PMID 12297272. doi:10.1016/S0014-5793(02)03241-6.
- Mendes HF, van der Spuy J, Chapple JP, Cheetham ME (2005). „Mechanisms of cell death in rhodopsin retinitis pigmentosa: implications for therapy.”. Trends in molecular medicine. 11 (4): 177—85. PMID 15823756. doi:10.1016/j.molmed.2005.02.007.
- Inglehearn CF; Keen TJ; Bashir R; et al. (1993). „A completed screen for mutations of the rhodopsin gene in a panel of patients with autosomal dominant retinitis pigmentosa.”. Hum. Mol. Genet. 1 (1): 41—5. PMID 1301135. doi:10.1093/hmg/1.1.41.
- Farrar GJ; Findlay JB; Kumar-Singh R; et al. (1993). „Autosomal dominant retinitis pigmentosa: a novel mutation in the rhodopsin gene in the original 3q linked family.”. Hum. Mol. Genet. 1 (9): 769—71. PMID 1302614. doi:10.1093/hmg/1.9.769.
- Robinson PR, Cohen GB, Zhukovsky EA, Oprian DD (1992). „Constitutively active mutants of rhodopsin.”. Neuron. 9 (4): 719—25. PMID 1356370. doi:10.1016/0896-6273(92)90034-B.
- Fujiki K; Hotta Y; Hayakawa M; et al. (1992). „Point mutations of rhodopsin gene found in Japanese families with autosomal dominant retinitis pigmentosa (ADRP).”. Jpn. J. Hum. Genet. 37 (2): 125—32. PMID 1391967. doi:10.1007/BF01899733.
- Olsson JE; Gordon JW; Pawlyk BS; et al. (1992). „Transgenic mice with a rhodopsin mutation (Pro23His): a mouse model of autosomal dominant retinitis pigmentosa.”. Neuron. 9 (5): 815—30. PMID 1418997. doi:10.1016/0896-6273(92)90236-7.
- Andréasson S, Ehinger B, Abrahamson M, Fex G (1993). „A six-generation family with autosomal dominant retinitis pigmentosa and a rhodopsin gene mutation (arginine-135-leucine).”. Ophthalmic paediatrics and genetics. 13 (3): 145—53. PMID 1484692. doi:10.3109/13816819209046483.
- Inglehearn CF; Lester DH; Bashir R; et al. (1992). „Recombination between rhodopsin and locus D3S47 (C17) in rhodopsin retinitis pigmentosa families.”. Am. J. Hum. Genet. 50 (3): 590—7. PMC 1684283
 . PMID 1539595.
. PMID 1539595. - Fishman GA, Stone EM, Gilbert LD, Sheffield VC (1992). „Ocular findings associated with a rhodopsin gene codon 106 mutation. Glycine-to-arginine change in autosomal dominant retinitis pigmentosa.”. Arch. Ophthalmol. 110 (5): 646—53. PMID 1580841.
- Keen TJ; Inglehearn CF; Lester DH; et al. (1992). „Autosomal dominant retinitis pigmentosa: four new mutations in rhodopsin, one of them in the retinal attachment site.”. Genomics. 11 (1): 199—205. PMID 1765377. doi:10.1016/0888-7543(91)90119-Y.
- Dryja TP; Hahn LB; Cowley GS; et al. (1991). „Mutation spectrum of the rhodopsin gene among patients with autosomal dominant retinitis pigmentosa.”. Proc. Natl. Acad. Sci. U.S.A. 88 (20): 9370—4. PMC 52716
 . PMID 1833777. doi:10.1073/pnas.88.20.9370.
. PMID 1833777. doi:10.1073/pnas.88.20.9370. - Gal A; Artlich A; Ludwig M; et al. (1992). „Pro-347-Arg mutation of the rhodopsin gene in autosomal dominant retinitis pigmentosa.”. Genomics. 11 (2): 468—70. PMID 1840561. doi:10.1016/0888-7543(91)90159-C.
- Sung CH; Davenport CM; Hennessey JC; et al. (1991). „Rhodopsin mutations in autosomal dominant retinitis pigmentosa.”. Proc. Natl. Acad. Sci. U.S.A. 88 (15): 6481—5. PMC 52109
 . PMID 1862076. doi:10.1073/pnas.88.15.6481.
. PMID 1862076. doi:10.1073/pnas.88.15.6481. - Jacobson SG, Kemp CM, Sung CH, Nathans J (1991). „Retinal function and rhodopsin levels in autosomal dominant retinitis pigmentosa with rhodopsin mutations.”. Am. J. Ophthalmol. 112 (3): 256—71. PMID 1882937.
- Sheffield VC; Fishman GA; Beck JS; et al. (1991). „Идентифицатион оф новел рходопсин мутатионс ассоциатед wитх ретинитис пигментоса бy ГЦ-цлампед денатуринг градиент гел елецтропхоресис.”. Ам. Ј. Хум. Генет. 49 (4): 699—706. ПМЦ 1683182
 . ПМИД 1897520.
. ПМИД 1897520. - Колб Х, Фернандез Е, Нелсон Р, Јонес БW (1. 3. 2010). „Wебвисион Хоме Паге: Тхе организатион оф тхе ретина анд висуал сyстем”. Университy оф Утах.
Спољашње везе
[уреди | уреди извор]- Рходопсин на US National Library of Medicine Medical Subject Headings (MeSH)
- Родопсин протеин
- Фотоизомеризација родопсина
- Родопсин и око
- UMich оријентација протеина у мембранама фамилиес/суперфамилy-6