Litijum
 pluta u ulju | |||||||||||||||||
| Opšta svojstva | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | litijum, Li | ||||||||||||||||
| Izgled | srebrnobel | ||||||||||||||||
| Zastupljenost | 0,006[1][2] | ||||||||||||||||
| U periodnome sistemu | |||||||||||||||||
| |||||||||||||||||
| Atomski broj (Z) | 3 | ||||||||||||||||
| Grupa, perioda | grupa 1 (alkalni metali), perioda 2 | ||||||||||||||||
| Blok | s-blok | ||||||||||||||||
| Kategorija | alkalni metal | ||||||||||||||||
| Rel. at. masa (Ar) | [6,938, 6,997] konvencionalna: 6,94 | ||||||||||||||||
| El. konfiguracija | [He] 2s1[3] | ||||||||||||||||
po ljuskama | 2, 1 | ||||||||||||||||
| Fizička svojstva | |||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||
| Tačka topljenja | 453,65 K (180,50 °C, 356,90 °F) | ||||||||||||||||
| Tačka ključanja | 1603[4] K (1330 °C, 2426 °F) | ||||||||||||||||
| Gustina pri s.t. | 0,534[5][6] g/cm3 | ||||||||||||||||
| tečno st., na t.t. | 0,512[2] g/cm3 | ||||||||||||||||
| Kritična tačka | 3220 K, 67 MPa (ekstrapolirano)[7] | ||||||||||||||||
| Toplota fuzije | 3,00 kJ/mol | ||||||||||||||||
| Toplota isparavanja | 136 kJ/mol | ||||||||||||||||
| Mol. topl. kapacitet | 24,860 J/(mol·K) | ||||||||||||||||
Napon pare
| |||||||||||||||||
| Atomska svojstva | |||||||||||||||||
| Oksidaciona stanja | +1 (veoma kiseo oksid) | ||||||||||||||||
| Elektronegativnost | 0,98 | ||||||||||||||||
| Energije jonizacije | 1: 520,2 kJ/mol 2: 7298,1 kJ/mol 3: 11815,0 kJ/mol | ||||||||||||||||
| Atomski radijus | 152 pm | ||||||||||||||||
| Kovalentni radijus | 128±7 pm | ||||||||||||||||
| Valsov radijus | 182 pm | ||||||||||||||||
| Ostalo | |||||||||||||||||
| Kristalna struktura | unutrašnjecentr. kubična (BCC) | ||||||||||||||||
| Brzina zvuka tanak štap | 6000 m/s (na 20 °C) | ||||||||||||||||
| Topl. širenje | 46 µm/(m·K) (na 25 °C) | ||||||||||||||||
| Topl. vodljivost | 84,8 W/(m·K) | ||||||||||||||||
| Elektrootpornost | 92,8 nΩ·m (na 20 °C) | ||||||||||||||||
| Magnetni raspored | paramagnetičan (= 1,4 · 10−5)[8] | ||||||||||||||||
| Magnetna susceptibilnost (χmol) | +14,2·10−6 cm3/mol (298 K)[9] | ||||||||||||||||
| Jangov modul | 4,9 GPa | ||||||||||||||||
| Modul smicanja | 4,2 GPa | ||||||||||||||||
| Modul stišljivosti | 11 GPa | ||||||||||||||||
| Mosova tvrdoća | 0,6 | ||||||||||||||||
| Brinelova tvrdoća | 5 MPa | ||||||||||||||||
| CAS broj | 7439-93-2 | ||||||||||||||||
| Istorija | |||||||||||||||||
| Otkriće | Johan Avgust Arfvedson (1817) | ||||||||||||||||
| Prva izolacija | Vilijam Tomas Brand (1821) | ||||||||||||||||
| Glavni izotopi | |||||||||||||||||
| |||||||||||||||||
| 6Li sadržaj može biti nizak i do 3,75% u prirodnim uzorcima. 7Li stoga može da ima sadržaj do 96,25%. | |||||||||||||||||
Litijum (grč. lithos — kamen), oznaka Li, je najlakši od svih poznatih metala. Ima redni broj 3 u periodnom sistemu elemenata, atomsku težinu 6,94, specifičnu težinu 0,534 (pri 20 °C). On predstavlja smešu dva izotopa 7Li(92,6%) i 6Li(7,4%).[10] Litijum je mek, srebrnasto-beo alkalni metal u drugoj periodi periodnog sistema elemenata. Litijum je vrlo lak metal i ima najmanju gustinu među svim čvrstim elementima (pod standardnim uslovi), a takođe je i element najmanje gustine među čvrstim elementima. Zbog svoje velike reaktivnosti i zapaljivosti, u prirodi se ne nalazi u elementarnom stanju. Na sobnoj temperaturi, samo na potpuno suvom vazduhu je postojan duže vreme, pri čemu vrlo sporo reaguje dajući litijum nitrid. U vlažnom vazduhu, na površini litijuma vrlo brzo se formira mat sivi sloj litijum hidroksida. Litijum se mora čuvati u vakuumu, inertnoj atmosferi, ili pod inertnom tečnošću kao što je prečišćeni kerozin[11] ili mineralno ulje. Kao i svi alkalni metali, elementarni litijum reaguje odmah već pri dodiru sa vlagom na koži, te tako može prouzrokovati teške opekotine i ozlede zbog nagrizanja. Mnoga jedinjenja litijuma, koja u vodenim rastvorima daju jone litijuma smatraju se opasnim za zdravlje, za razliku od analognih jedinjenja natrijuma i kalijuma.
Litijum se ne javlja slobodan u prirodi, već se javlja uglavnom u vidu pegmatitskih minerala, koji su nekada bili glavni izvor litijuma. Zbog svoje rastvorljivosti kao jona, prisutan je u okeanskoj vodi i obično se dobija iz slanih rastvora. Metalni litijum se izoluje elektrolitički iz smeše litijum hlorida i kalijum hlorida. Kao mikroelement, litijum u obliku svojih soli je često sastavni deo mineralnih voda.
Jezgro litijumovog atoma je granično stabilno, pošto dva stabilna izotopa litijuma pronađena u prirodi imaju veoma niske energije vezivanja po nukleonu. Zbog svoje relativne nuklearne nestabilnosti, litijum je manje zastupljen u solarnom sistemu od 25 od prvih 32 hemijska elemenata, iako su njegova jezgra veoma lagana: to je izuzetak od trenda po kome su teža jezgra ređa.[12] Iz srodnih razloga, litijum ima važnu upotrebu u nuklearnoj fizici. Transmutacija atoma litijuma u helijum 1932. godine bila je prva nuklearna reakcija koju je u potpunosti izvršio čovek, a litijum deuterid služi kao gorivo za fuziju u termonuklearnom oružju.[13]
Litijum i njegova jedinjenja imaju nekoliko industrijskih primena, uključujući staklo i keramiku otporne na toplotu, litijumska maziva, topioničke aditive za proizvodnju gvožđa, čelika i aluminijuma, litijum-metalne baterije i litijum-jonske baterije.
U ljudskom organizmu nalaze se vrlo male količine ovog elementa. Ne smatra se neophodnim za život i nema poznate biološke funkcije u organizmu. Međutim, neke soli litijuma pokazuju medicinsko delovanje i upotrebljavaju se u litijumskoj terapiji pri lečenju bipolarnih poremećaja, manija, depresija i drugih sličnih bolesti.
Osobine
[uredi | uredi izvor]Fizičke
[uredi | uredi izvor]

Alkalni metali se takođe nazivaju porodicom litijuma, po njigovom vodećem elementu. Kao i drugi alkalni metali (a to su natrijum (Na), kalijum (K), rubidijum (Rb), cezijum (Cs) i francijum (Fr), litijum ima jedan valentni elektron koji se, u prisustvu rastvarača, lako se oslobađa da formira Li+.[15] Zbog toga je litijum dobar provodnik toplote i struje, kao i visoko reaktivan element, mada je najmanje reaktivan od alkalnih metala. Niža reaktivnost litijuma je posledica blizine njegovog valentnog elektrona njegovom jezgru (preostala dva elektrona su u 1s orbitali, mnogo manje energije i ne učestvuju u hemijskim vezama).[15] Rastopljeni litijum je znatno reaktivniji od njegovog čvrstog oblika.[16][17]
U čistom stanju i u odsustvu vazduha, ima srebrnastometalni sjaj, po čemu liči na natrijum i kalijum, ali od njih je tvrđi. Metal litijum je dovoljno mekan da se može seći nožem. Na vazduhu oksidira u litijum oksid.[15] Takođe, ima i višu tačku topljenja, koja iznosi 180,50 °C (453,65 K; 356,90 °F),[18] a ključa na 1.342 °C (1.615 K; 2.448 °F)[18], što su najviše vrednosti od svih alkalnih metala. Gustina iznosi svega 0,534 g/cm3[19] i predstavlja najmanju gustinu od svih čvrstih elemenata.[20][21] Samo vodonik u čvrstom stanju pri temperaturi od −260 °C ima manju gustinu od 0,0763 g/cm3.[19][22] Litijum može da pluta na najlakšim ugljovodoničnim uljima i jedan je od samo tri metala koji mogu da plutaju na vodi, pri čemu su druga dva natrijum i kalijum.

Prilično je isparljiv i njegova para boji plamen Bunzenove grejalice karmin crveno, što se koristi prilikom kvalitativne analize njegovih soli.[23] Ima najveću specifičnu toplotu od svih elemenata i ona iznosi 0,96 na 50 °C. Litijum među ostalim alkalnim metalima ima najviše tačke topljenja i ključanja kao i najveći specifični toplotni kapacitet. Iako on ima najveću tvrdoću od svih alkalnih metala, može se rezati nožem a njegova Mosova tvrdoća iznosi 0,6.[6][24] Kao tipičan metal, dobar je provodnik struje (provodljivost oko 18% od provodljivosti bakra[1]) kao i toplote.
Litijumski koeficijent toplotnog širenja je dva puta veći od aluminijuma i skoro četiri puta veći od gvožđa.[25] Litijum je superprovodljiv ispod 400 μK pri standardnom pritisku[26] i na višim temperaturama (više od 9 K) pri veoma visokim pritiscima (>20 GPa).[27] Na temperaturama ispod 70 K, litijum, kao i natrijum, prolazi kroz faznu transformaciju bez difuzije. Na 4,2 K ima romboedarski kristalni sistem (sa razmakom ponavljanja u devet slojeva); na višim temperaturama transformiše se u teseralni, a zatim u kubni kristalni sistem. Na temperaturama tečnog helijuma (4 K) preovladava romboedarska struktura.[28] Višestruki alotropni oblici su identifikovani za litijum pri visokim pritiscima.[29]
Litijum ima specifični toplotni kapacitet mase od 3,58 kilodžula po kilogram-kelvinu, najveći od svih čvrstih materija.[30][31] Zbog toga se metalni litijum često koristi u rashladnim tečnostima za aplikacije prenosa toplote.[30]
Poput drugih alkalnih metala, i litijum se kristalizuje u kubnom, prostorno centriranom, gusto pakovanom kristalnom sistemu u prostornoj grupi Im3m sa parametrom rešetke a = 351 pm i dve formulske jedinice po elementarnoj ćeliji. Na izuzetno niskim temperaturama od 78 K menja se kristalna struktura spontanim prelazom bilo u heksagonalnu strukturu tipa magnezijuma sa parametrima rešetke a = 311 pm i c = 509 pm ili izmenom u izobličenu kubnu strukturu tipa bakra (kubna površinsko centrirana) sa parametrom rešetke a = 438 pm. Tačan uzrok zbog čega se javlja jedna od ovih struktura nije poznat.[14]
Litijum ispoljava veliki broj sličnosti sa magnezijumom, što se, između ostalog, iskazuje i u činjenici javljanja heterotipskih mešanih kristala od litijuma i magnezijuma, a koji imaju osobinu izodimorfije. Iako se magnezijum najgušće kristalizuje heksagonalno, dok se nasuprot njega litijum kristalizuje u kubinu prostorno centriranu kuglastu rešetku, oba metala se mogu heterotipski mešati.[32] Međutim, ovo se dešava samo u vrlo ograničenom rasponu koncentracija, pri čemu kod viška neke od komponenti, jedna od njih nameće (prisiljava da promeni) kristalnu rešetku drugoj.
Jon litijuma sa −520 kJ/mol[33] ima najvišu entalpiju hidratacije među svim jonima alkalnih metala. Stoga se on u vodi u potpunosti hidratizuje i snažno privlači molekule vode. Jon litijuma gradi dve hidratne ljuske, jednu unutrašnju sa četiri molekula vode, koja je izuzetno snažno povezana sa litijumovim jonom preko svojih atoma kiseonika, te jednu spoljnu ljusku, koja je povezana sa jonom Li[H2O]4+ preko „vodoničnih mostova” sa drugim molekulima vode. Zbog toga je jonski radijus hidratizovanih jona litijuma veoma velik, veći čak i od nekih jona teških alkalnih metala kao što su rubidijum i cezijum, koji u vodenim rastvorima ne grade takvu vrstu snažno vezanih hidratnih ljuski.

U gasovitom stanju, litijum se ne nalazi u vidu pojedinačnih atoma, već u molekularnom stanju kao dilitijum Li2. Na taj način jednovalentni litijum dostiže popunjenu s-atomsku orbitalu a time i energetski povoljniju situaciju. Dilitijum ima dužinu veze od 267,3 pm i energiju veze od 101 kJ/mol.[34]
Hemijske
[uredi | uredi izvor]
Litijum je, kao i svi drugi alkalni metali, vrlo reaktivan i vrlo lako reaguje sa mnogim elementima i jedinjenjima (poput vode dajući toplotu). Među svim alkalnim metalima, on je najviše reaktivan. Posebnost, po kojoj se litijum razlikuje od drugih alkalnih metala je njegova reakcija sa molekularnim azotom gradeći litijum nitrid, reakcija koja se polako odvija već i na sobnoj temperaturi:
- .
Ovo je moguće zbog velike gustine naboja jona litijuma Li+ te tako i velike energije rešetke litijum nitrida. Litijum sa -3,04 V[33] ima najniži elektrodni potencijal u celom periodnom sistemu, te je stoga i najmanje plemeniti element od svih. Kao i svi alkalni metali, elementarni litijum se može čuvati u kerozinu (petroleumu) ili parafinskom ulju, jer u suprotnom reaguje sa azotom i kiseonikom iz vazduha.
Pošto su radijusi jona litijuma Li+ i magnezijuma Mg2+ slični po veličini, takođe postoje i određene sličnosti u osobinama litijuma odnosno njegovih jedinjenja sa magnezijumom ili jedinjenjima magnezijuma. Ova sličnost u osobinama između dva elementa iz susednih grupa periodnog sistema poznata je i kao dijagonalna veza (dijagonalni efekt). Tako litijum, za razliku od natrijuma, gradi mnoga metalnoorganska jedinjenja (organolitijumska jedinjenja), poput butil litijuma ili metil litijuma. Ista sličnost uočena je i između berilijuma i aluminijuma, kao i između bora i silicijuma.
Na vazduhu gori blještavom belom svetlošću poput magnezijuma, gradeći monoksid, ali druge okside gradi teže. Sa vodonikom se jedini na crvenom usijanju gradeći litijum hidrid, a sa azotom litijum nitrid. Direktno se jedini i sa halogenima i sumporom i može se reći da je hemijski aktivan, ali manje od drugih alkalnih metala. Burno reaguje sa kiselinama, a u reakciji sa vodom se ne pali, čak ni ako voda ključa. Tada nastaje reakcija:[20]
Izotopi
[uredi | uredi izvor]U prirodi se javljaju oba stabilna izotopa litijuma 6Li (7,6%) i 7Li (92,4%).[35] Osim njih, poznato je još nekoliko nestabilnih izotopa počev od 4Li preko 8Li do 12Li, koji se mogu dobiti samo veštačkim putem. Njihova vremena poluraspada iznose samo nekoliko milisekundi.[36] Oba prirodna izotopa imaju anomalno nisku nuklearnu energiju vezivanja po nukleonu (u poređenju sa susednim elementima u periodnom sistemu, helijumom i berilijumom); litijum je jedini element sa malim brojem koji može proizvesti neto energiju kroz nuklearnu fisiju. Dva litijumova jezgra imaju nižu energiju vezivanja po nukleonu nego bilo koji drugi stabilni nuklidi osim vodonika-1, deuterijuma i helijuma-3.[37] Kao rezultat ovoga, iako veoma male atomske težine, litijum je manje zastupljen u solarnom sistemu od 25 od prva 32 hemijska elementa.[12] Okarakterisano je sedam radioizotopa, od kojih su najstabilniji 8Li sa vremenom poluraspada od 838 ms i 9Li sa poluživotom od 178 ms. Svi preostali radioaktivni izotopi imaju period poluraspada koji je kraći od 8,6 ms. Najkraće živeći izotop litijuma je 4Li, koji se raspada emisijom protona i ima vreme poluraspada od 7,6 × 10−23 s.[38] Izotop 6Li je jedan od samo pet stabilnih nuklida koji imaju neparan broj protona i neparan broj neutrona, dok su ostala četiri stabilna neparna-neparna nuklida vodonik-2, bor-10, azot-14 i tantal-180m.[39]
7Li je jedan od primordijalnih elemenata (ili, tačnije, primordijalnih nuklida) proizvedenih u nukleosintezi Velikog praska. Mala količina 6Li i 7Li se proizvodi u zvezdama tokom zvezdane nukleosinteze, ali se dalje „sagoreva“ onoliko brzo koliko se proizvodi.[40] 7Li se takođe može generisati u ugljeničnim zvezdama.[41] Dodatne male količine i 6Li i 7Li mogu se generisati iz solarnog vetra, kosmičkih zraka koji udaraju u teže atome i iz ranog 7Be radioaktivnog raspada u solarnom sistemu.[42]
Izotopi litijuma se u velikoj meri frakcionišu tokom širokog spektra prirodnih procesa,[43] uključujući formiranje minerala (hemijske precipitacije), metabolizam i razmenu jona. Joni litijuma zamenjuju magnezijum i gvožđe na oktaedarskim mestima u mineralima gline, gde je 6Li poželjniji od 7Li, što rezultira obogaćivanjem svetlosnog izotopa u procesima hiperfiltracije i promene stena. Poznato je da egzotični 11Li pokazuje neutronski oreol, sa 2 neutrona koji kruže oko njegovog jezgra od 3 protona i 6 neutrona. Proces poznat kao lasersko odvajanje izotopa može se koristiti za odvajanje litijumskih izotopa, posebno 7Li od 6Li.[44]
Proizvodnja nuklearnog oružja i druge primene u nuklearnoj fizici su glavni izvor veštačkog frakcionisanja litijuma, pri čemu se laki izotop 6Li zadržan u industriji i vojnim zalihama do te mere da je to izazvalo blagu, ali merljivu promenu u odnosu 6Li prema 7Li u prirodnim izvorima, kao što su reke. Ovo je dovelo do neobične nesigurnosti u standardizovanoj atomskoj težini litijuma, pošto ova količina zavisi od prirodnog odnosa obilja ovih prirodno prisutnih stabilnih izotopa litijuma, kao što su oni dostupni u komercijalnim izvorima minerala litijuma.[45] Oba stabilna izotopa litijuma mogu se laserski hladiti i korišćena su za proizvodnju prve kvantno degenerisane Boze–Fermijeve mešavine.[46]

Izotop 6Li ima vrlo važnu ulogu u tehnologiji nuklearne fuzije. Pored uloge u nuklearnim fuzijskim reaktorima, služi i kao polazni materijal za dobijanje tricijuma u hidrogenskoj bombi, koji je neophodan za fuziju sa deuterijumom kojom se proizvodi enormna količina energije. Tricijum nastaje u plaštu fuzijskog reaktora (takozvanom blanketu) ili unutar hidrogenske bombe pored helijuma bombardiranjem litijuma 6Li neutronima, koji nastaju tokom fuzije, a prema sledećoj nuklearnoj reakciji:
- .
Takođe, moguća je i reakcija
ali je ona manje pogodna.
Iz ovog razloga, izotop 6Li se izdvaja pri proizvodnji litijuma.[47] Razdvajanje izotopa se može vršiti na primjer putem razmene izotopa litijum amalgama i nekog rastvorenog litijumovog jedinjenja (poput litijum hlorida u etanolu). Pri tome se može dostići prinos od oko 50%.[48]
Izotop 7Li nastaje u neznatnim količinama u nuklearnim centralama putem nuklearne reakcije izotopa bora 10B (korišten kao usporivač neutrona) sa neutronima.[49]
Oba izotopa litijuma 6Li i 7Li korištena su u eksperimentima sa ultrahladnim kvantnim gasovima. Tako je načinjen i prvi Boze-Ajnštajnov kondenzat sa (bozon) izotopom 7Li.[50] Međutim 6Li je fermion[51][52] te su naučnici 2003. godine uspeli da molekul ovog izotopa pretvore u superfluid.[53]
Nalaženje u prirodi
[uredi | uredi izvor]
Zastupljen je u zemljinoj kori u količini od 0,0018%, ali je i pored male procentualne zastupljenosti veoma čest. Za razliku od ostalih alkalnih metala, litijum se u prirodi nalazi u obliku silikata. Minerali koji ga sadrže su lepidolit, spodumen, ambligonit i petalit, od kojih neki i služe kao polazna sirovina za njegovo dobijanje. Najveća ležišta rude litijuma su u Boliviji, Čileu, Argentini, Kini i Australiji.[54] Pronađen je i u pepelu mnogih biljaka kao što je duvan, ali i u mleku i krvi.[20]
Astronomska zastupljenost
[uredi | uredi izvor]Iako je sintetisan u Velikom prasku, litijum (zajedno sa berilijumom i borom) je znatno manje zastupljen u univerzumu od drugih elemenata. Ovo je rezultat relativno niskih zvezdanih temperatura neophodnih za uništavanje litijuma, zajedno sa nedostatkom uobičajenih procesa za njegovo formiranje.[55]
Prema savremenoj kosmološkoj teoriji, litijum — u oba stabilna izotopa (litijum-6 i litijum-7) — je bio jedan od tri elementa sintetisana u Velikom prasku.[56] Iako količina litijuma generisana u nukleosintezi Velikog praska zavisi od broja fotona po barionu, za prihvaćene vrednosti može se izračunati zastupljenost litijuma, mada postoje „kosmološka litijumska neslaganja“ u univerzumu: postoje indikacije da starije zvezde imaju manje litijuma nego što bi trebalo, a neke mlađe zvezde imaju mnogo više.[57] Nedostatak litijuma u starijim zvezdama je očigledno uzrokovan „mešanjem“ litijuma u unutrašnjost zvezda, gde se uništava,[58] dok se litijum proizvodi u mlađim zvezdama. Iako se transmutira u dva atoma helijuma usled sudara sa protonom na temperaturama iznad 2,4 miliona stepeni Celzijusa (većina zvezda lako dostiže ovu temperaturu u svojoj unutrašnjosti), litijum je u zastupljeniji nego što bi proračuni predvideli za zvezde kasnije generacije.[59]

Litijum se takođe nalazi u smeđim patuljastim subzvezdanim objektima i pojedinim anomalnim narandžastim zvezdama. Pošto je litijum prisutan u hladnijim, manje masivnim smeđim patuljcima, ali je uništen u toplijim crvenim patuljcima, njegovo prisustvo u spektru zvezda može se koristiti u „litijumskom testu“ da se pravi razlika između njih, jer su oba manja od Sunca.[59][61][62] Određene narandžaste zvezde takođe mogu sadržati visoku koncentraciju litijuma. Te narandžaste zvezde za koje je utvrđeno da imaju veću koncentraciju litijuma od uobičajene (kao što je Kentaur X-4) kruže oko masivnih objekata — neutronskih zvezda ili crnih rupa — čija gravitacija očigledno povlači teži litijum na površinu vodonično-helijumske zvezde, uzrokujući da se više litijuma da se zapaža.[59]
Dana 27. maja 2020, astronomi su izvestili da su eksplozije klasičnih nova galaktički proizvođači litijuma-7.[63][64]
Kopnena zastupljenost
[uredi | uredi izvor]Iako je litijum široko rasprostranjen na Zemlji, on se prirodno ne javlja u elementarnom obliku zbog svoje visoke reaktivnosti.[15] Ukupni sadržaj litijuma u morskoj vodi je veoma velik i procenjuje se na 230 milijardi tona, pri čemu element postoji u relativno konstantnoj koncentraciji od 0,14 do 0,25 delova na milion (ppm),[65][66] ili 25 mikromola;[67] veće koncentracije koje se približavaju 7 ppm nalaze se u blizini hidrotermalnih izvora.[66]
Procene za sadržaj Zemljine kore kreću se od 20 do 70 ppm po težini.[68] Litijum čini oko 0,002 procenta Zemljine kore..[69] U skladu sa svojim imenom, litijum čini manji deo magmatskih stena, sa najvećim koncentracijama u granitima. Granitni pegmatiti takođe obezbeđuju najveće obilje minerala koji sadrže litijum, a spodumen i petalit su komercijalno najisplativiji izvori.[68] Još jedan značajan mineral litijuma je lepidolit što je sada zastareo naziv za seriju koju čine polilitionit i trilitionit.[70][71] Drugi izvor litijuma je hektoritna glina, čiji se jedini aktivni razvoj ostvaruje preko Vestern litijum korporacije u Sjedinjenim Državama.[72] Sa 20 mg litijuma po kg Zemljine kore,[73] litijum je 25. najzastupljeniji element.
Prema Priručniku litijuma i prirodnog kalcijuma, „litijum je relativno redak element, iako se nalazi u mnogim stenama i delu solana, uvek je zastupljen u veoma niskim koncentracijama. Postoji prilično veliki broj mineralnih i sonih naslaga litijuma, ali samo relativno mali broj njih ima stvarnu ili potencijalnu komercijalnu vrednost. Mnoge naslage su veoma male, dok su druge preniskog sadržaja.”[74]
Procenjuje se da Čile (2020) ima daleko najveće rezerve (9,2 miliona tona),[75] a Australija najveću godišnju proizvodnju (40.000 tona).[75] Jedna od najvećih rezervnih baza[note 1] litijuma nalazi se u oblasti Salar de Ujuni u Boliviji, koja ima 5,4 miliona tona. Drugi veliki dobavljači su Australija, Argentina i Kina.[76][77] Od 2015. godine, Češki geološki zavod je čitave Rudne planine u Češkoj smatra litijumskom provincijom. Registrovano je pet ležišta, jedno u blizini Cinoveka se smatra potencijalno ekonomičnim nalazištem, sa 160 000 tona litijuma.[78] U decembru 2019, finska rudarska kompanija Keliber Oi je izvestila da njeno ležište litijuma Rapasari sadrži procenjeno dokazane i verovatne rezerve rude od 5,280 miliona tona.[79]
U junu 2010. godine Njujork Tajms je izvestio da su američki geolozi sprovodili istraživanja na suvim slanim jezerima u zapadnom Avganistanu verujući da se tamo nalaze velika nalazišta litijuma.[80] Ove procene su „uglavnom zasnovane na starim podacima koje su prikupili uglavnom Sovjeti tokom svoje okupacije Avganistana od 1979–1989.“[81] Ministarstvo odbrane SAD je procenilo da su rezerve litijuma u Avganistanu uporedive sa onima u Boliviji i nazvale su ih potencijalnom „Saudijskom Arabijom litijuma“.[82] U Kornvolu, Engleska, prisustvo slane vode bogate litijumom je bilo dobro poznato zbog istorijske rudarske industrije u tom regionu, a privatni investitori su sproveli testove kako bi istražili potencijalnu ekstrakciju litijuma u ovoj oblasti.[83][84]
Biološka zastupljenost
[uredi | uredi izvor]Litijum se nalazi u tragovima u brojnim biljkama, planktonu i beskičmenjacima, u koncentracijama od 69 do 5.760 delova na milijardu (ppb). Kod kičmenjaka koncentracija je nešto niža, a skoro sva tkiva i telesne tečnosti kičmenjaka sadrže litijum u rasponu od 21 do 763 ppb.[66] Morski organizmi imaju tendenciju da bioakumuliraju litijum više od kopnenih organizama.[85] Nije poznato da li litijum ima fiziološku ulogu u bilo kom od ovih organizama.[66] Koncentracije litijuma u ljudskom tkivu su u proseku oko 24 ppb (4 ppb u krvi i 1,3 ppm u kostima).[86]
Biljke lako apsorbuju litijum[86] i koncentracija litijuma u biljnom tkivu je tipično oko 1 ppm.[87] Neke porodice biljaka bioakumuliraju više litijuma od drugih.[87] Koncentracije litijuma u suvoj težini za članove porodice Solanaceae (koja uključuje krompir i paradajz), na primer, mogu biti i do 30 ppm, dok za zrna kukuruza mogu sadržati i do 0,05 ppb.[86] Studije koncentracije litijuma u zemljištu bogatom mineralima daju raspon između 0,1 i 50–100 ppm, sa nekim koncentracijama i do 100–400 ppm, iako je malo verovatno da će sve to biti dostupno biljkama.[87] Smatra se da akumulacija litijuma ne utiče na sastav esencijalnih hranljivih sastojaka biljaka.[87] Tolerancija na litijum varira u zavisnosti od biljnih vrsta i obično je paralelna sa tolerancijom na natrijum; Kukuruz i Rodsova trava, na primer, veoma su tolerantni na litijumske povrede, dok su avokado i soja veoma osetljivi.[87] Slično, litijum u koncentraciji od 5 ppm smanjuje klijavost semena kod nekih vrsta (npr. azijski pirinač i leblebija), ali ne i kod drugih (npr. ječam i pšenica).[87]
Mnogi od glavnih bioloških efekata litijuma mogu se objasniti njegovom konkurencijom sa drugim jonima.[88] Jednovalentni litijumski katjon Li+
takmiči se sa drugim jonima kao što je natrijum (neposredno ispod litijuma u periodičnoj tabeli), koji je kao i litijum takođe monovalentni alkalni metal. Litijum se takođe takmiči sa bivalentnim jonima magnezijuma, čiji je jonski radijus (86 pm) približno jednak litijumskom jonu[88] (90 pm). Mehanizmi koji transportuju natrijum kroz ćelijske membrane takođe transportuju litijum. Na primer, natrijumski kanali (naponski i epitelni) su glavni putevi ulaska litijuma.[88] Joni litijuma takođe mogu da prodiru kroz ligandno zavisne jonske kanale, kao i da prođu kroz nuklearne i mitohondrijske membrane.[88] Kao i natrijum, litijum može da uđe i delimično blokira (iako ne prožima) kalijumove i kalcijumove kanale.[88] Biološki efekti litijuma su brojni i raznovrsni, ali su mehanizmi njegovog delovanja samo delimično shvaćeni.[89] Na primer, studije pacijenata lečenih litijumom sa bipolarnim poremećajem pokazuju da, između mnogih drugih efekata, litijum delimično preokreće skraćivanje telomera kod ovih pacijenata i takođe povećava mitohondrijalnu funkciju, iako nije razjašnjeno kako litijum proizvodi ove farmakološke efekte.[89][90] Čak ni tačni mehanizmi uključeni u toksičnost litijuma nisu u potpunosti shvaćeni.
Istorija
[uredi | uredi izvor]
Petalit (LiAlSi4O10) je 1800. godine otkrio brazilski hemičar i državnik Hose Bonifacio de Andrada e Silva u rudniku sa ostrva Ute u Švedskoj.[91][92][93][94] Međutim, tek 1817. Johan August Arfvedson, tada radeći u laboratoriji hemičara Jensa Jakoba Bercelijusa, otkriva prisustvo nepoznatog elementa dok je analizirao rudu petalita (Li[4]Al[4][Si4O10]),[95][96][97][98] a nedugo kasnije i u mineralima spodumenu (LiAl[Si2O6]) i lepidolitu (K(Li,Al)3[(Al,Si)4O10](F,OH)2), nakon analize mineralnih uzoraka sa ostrva Ute.[99][93] Ovaj element je formirao jedinjenja slična onima natrijuma i kalijuma, iako su njegovi karbonat i hidroksid bili manje rastvorljivi u vodi i manje alkalni.[100] Njegov akademski učitelj Jakob Bercelijus predložio je naziv lithion, izvedenicu iz grčkog λίθος líthos‚ kamen, ime koje je izvedeno iz materijala iz kojeg je izolovan, slično kao i kod drugih, do tada poznatih, alkalnih metala natrijuma i kalijuma, a kasnije se to ime ustalilo u svojoj latiniziranoj formi lithium.[101][15][93][98] Nemački hemičar Kristian Gotlob Gmelin primetio je 1818. godine da soli litijuma boje plamen u crvenu boju.[93][102]
Oba naučnika su narednih godina pokušavali da dobiju ovaj element u čistom stanju.[93][98][103] Ovo je uspelo iste godine Brandu i Dejviju pomoću postupka elektrolize litijum oksida (Li2O), procesa koji je ranije koristio hemičar ser Hamfri Dejvi za izolovanje alkalnih metala kalijuma i natrijuma.[59][103][104][105][106] Brand je takođe opisao neke čiste soli litijuma, kao što je hlorid, i procenjujući da litija (litijum oksid) sadrži oko 55% metala, pretpostavio je da je atomska težina litijuma oko 9,8 g/mol (moderna vrednost ~6,94 g/mol).[107] Robert Bunzen i Ogastus Matiesen uspeli su 1855. pomoću elektrolize litijum hlorida (LiCl) da dobiju još veće količine elementarnog litijuma.[93][108] Atomsku težinu litijuma je odredio Ričards pretvaranjem litijum-hlorida u litijum perhlorat.[20]
Prva komercijalna proizvodnja počela je 1923. u nemačkoj kompaniji Metallgesellschaft AG (danas Chemetall GmbH), gde se dobijao pomoću elektrolize istopljene smese litijum- (LiCl) i kalijum hlorida (KCl).[93][109][110] Vilhelm Šlenk je 1917. sintetisao prvo litijumorgansko jedinjenje iz organskih jedinjenja žive.[111] Sve do kraja Drugog svetskog rata, osim upotrebe kao sredstvo za podmazivanje (mineralno ulje sa dodatkom litijum stearata) i u industriji stakla (litijum karbonat ili litijum oksid), gotovo da i nisu postojale aplikacije u kojima se koristio litijum. Međutim, to se promenilo nakon što je SAD-u zatrebao tricijum za pravljenje hidrogenske bombe, a koji se može dobiti iz litijuma. Počela je znatna proizvodnja litijuma, a jedno od najizdašnijih nalazišta bio je rudnik u blizini grada Kings Mauntin u Severnoj Karolini.[112] Pošto tricijum ima vrlo kratko vreme poluraspada, neophodne količine litijuma su konstantno rasle, te su u SAD u periodu od 1953. do 1963. nagomilane ogromne zalihe ovog metala, koje su tek nakon završetka Hladnog rata 1993. dospele na svetsko tržište.[112]
Osim klasičnih rudarskih izvora, jeftinije dobijanje litijuma je moguće i iz slanih voda. Danas se litijum koristi u velikim količinama za razne svrhe kao što je proizvodnja baterija, za polimerizaciju elastomera, u građevinarstvu, te za organske sinteze u farmaciji i argohemijskoj industriji. Od 2007. najvažniji segment upotrebe litijuma su primarne (takozvane „litijumske”) baterije i akumulatori (sekundarne ili litijum-jonske baterije).[113]
Australijski psihijatar Džon Kejd je zaslužan za ponovno uvođenje i popularizaciju upotrebe litijuma za lečenje manije 1949. godine.[114] Ubrzo nakon toga, tokom sredine 20. veka, primenjivost litijuma za stabilizaciju raspoloženja pacijenata sa manijom i depresijom uzela je maha u Evropi i Sjedinjenim Državama.
Proizvodnja i upotreba litijuma pretrpela je nekoliko drastičnih promena u istoriji. Prva velika primena litijuma bila je u visokotemperaturnim litijumskim mastima za avionske motore i slične primene u Drugom svetskom ratu i ubrzo nakon toga. Ova upotreba je podržana činjenicom da sapuni na bazi litijuma imaju višu tačku topljenja od drugih alkalnih sapuna i da su manje korozivni od sapuna na bazi kalcijuma. Mala potražnja za litijumskim sapunima i mastima za podmazivanje bila je podržana od strane nekoliko malih rudarskih operacija, uglavnom u SAD. Potražnja za litijumom se dramatično povećala tokom Hladnog rata sa proizvodnjom nuklearno fuzionih oružja. Litijum-6 i litijum-7 proizvode tricijum kada su ozračeni neutronima, te su stoga korisni za proizvodnju samog tricijuma, kao i oblik čvrstog fuzionog goriva koji se koristi u vodoničnim bombama u obliku litijum deuterida. SAD su postale glavni proizvođač litijuma između kasnih 1950-ih i sredine 1980-ih. Na kraju, zalihe litijuma bile su otprilike 42.000 tona litijum hidroksida. Zalihe litijuma su iscrpljene u pogledu litijuma-6 za 75%, što je bilo dovoljno da se utiče na izmerenu atomsku težinu litijuma u mnogim standardizovanim hemikalijama, te čak i na atomsku težinu litijuma u nekim „prirodnim izvorima“ litijumskih jona koji su bili „kontaminirani“ litijumovim solima ispuštenim iz postrojenja za separaciju izotopa, koje su našle put u podzemne vode.[45][115]
Litijum se koristi za smanjenje temperature topljenja stakla i za poboljšanje ponašanja pri topljenju aluminijum oksida u Hol-Heroultovom procesu.[116][117] Ove dve upotrebe su dominirale tržištem sve do sredine 1990-ih. Nakon završetka trke u nuklearnom naoružanju, potražnja za litijumom je opala, a prodaja zaliha Ministarstva energije na otvorenom tržištu dodatno je smanjila cene.[115] Sredinom 1990-ih, nekoliko kompanija je počelo da izoluje litijum iz slane vode, što se pokazalo kao jeftinija opcija od podzemnog ili otvorenog rudarstva. Većina rudnika se zatvorila ili se fokusirala na druge materijale, jer se samo ruda iz zoniranih pegmatita mogla kopati po konkurentnoj ceni. Na primer, američki rudnici u blizini Kings planine u Severnoj Karolini zatvoreni su pre početka 21. veka.
Razvoj litijum-jonskih baterija povećao je potražnju za litijumom i postao je dominantan vid upotrebe 2007. godine.[118] Sa porastom potražnje za litijumom u baterijama tokom 2000-ih, nove kompanije su proširile napore za izolaciju iz slane vode kako bi zadovoljile rastuću potražnju.[112][119]
Smatra se da će litijum biti jedan od glavnih objekata geopolitičke konkurencije u svetu koji radi na obnovljivu energiju i zavisi od baterija, ali ova perspektiva je takođe kritikovana zbog potcenjivanja moći ekonomskih podsticaja za proširenu proizvodnju.[120]
Hemija
[uredi | uredi izvor]Metal
[uredi | uredi izvor]Litijum lako reaguje sa vodom, ali sa primetno manjom snagom od drugih alkalnih metala. Reakcija formira gas vodonik i litijum hidroksid.[15] Kada se stave iznad plamena, jedinjenja litijuma daju upadljivu grimiznu boju, dok kad metal snažno gori, plamen postaje briljantno srebrn. Litijum se pali i sagoreva u kiseoniku kada je izložen vodi ili vodenoj pari. U vlažnom vazduhu, litijum brzo tamni i formira crnu prevlaku od litijum hidroksida (LiOH i LiOH·H2O), litijum nitrida (Li3N) i litijum karbonata (Li2CO3, nastalog sekundarnom reakcijom između LiOH i CO2).[68] Litijum je jedan od retkih metala koji reaguju sa gasovitim azotom.[121][122]
Zbog svoje reaktivnosti sa vodom, a posebno sa azotom, metalni litijum se obično skladišti pod ugljovodoničnim zaptivačem, često pod vazelinom. Iako se teži alkalni metali mogu skladištiti pod mineralnim uljem, litijum nije dovoljno gust da se potpuno uroni u ove tečnosti.[59]
Litijum ima dijagonalni odnos sa magnezijumom, elementom sličnog atomskog i jonskog radijusa. Hemijske sličnosti između dva metala uključuju formiranje nitrida reakcijom sa N2, formiranje oksida (Li
2O) i peroksida (Li
2O
2) pri sagorevanju u O2, soli slične rastvorljivosti i termičke nestabilnosti karbonata i nitrida.[68][123] Metal reaguje sa gasovitim vodonikom na visokim temperaturama da bi se dobio litijum hidrid (LiH).[124]
Litijum formira različite binarne i ternarne materijale direktnom reakcijom sa elementima glavne grupe. Ove Zintlove faze,[125][126][127] iako visoko kovalentne, mogu se posmatrati kao soli poliatomskih anjona kao što su Si44-, P73-, i Te52-. Sa grafitom, litijum formira niz interkalacionih jedinjenja.[123]
Litijum se rastvara u amonijaku (i aminima) dajući [Li(NH3)4]+ i solvatirani elektron.[123]
Neorganska jedinjenja
[uredi | uredi izvor]Litijum formira derivate slične solima sa svim halogenidima i pseudohalidima. Neki primeri uključuju halogenide LiF, LiCl, LiBr, LiI, kao i pseudohalide i srodne anjone. Litijum karbonat je opisan kao najvažnije jedinjenje litijuma.[123] Ova bela čvrsta supstanca je glavni proizvod oplemenjivanja litijumovih ruda. To je prethodnik drugim solima uključujući keramiku i materijale za litijumske baterije.
Jedinjenja LiBH
4 i LiAlH
4 su korisni reagensi. Ove soli i mnoge druge litijumove soli pokazuju izrazito visoku rastvorljivost u etrima, za razliku od soli težih alkalnih metala.
U vodenom rastvoru, koordinacioni kompleks [Li(H2O)4]+ preovlađuje za mnoge litijumove soli. Srodni kompleksi su poznati sa aminima i etrima.
Organska hemija
[uredi | uredi izvor]
Organolitijumova jedinjenja su brojna i korisna. Definisana su prisustvom veze između ugljenika i litijuma. Ona služe kao karbanjoni stabilizovani metalom, iako su njihovi rastvori i strukture čvrstog stanja složenije od ovog pojednostavljenog pogleda.[128] Dakle, ovo su izuzetno moćne baze i nukleofili. Takođe su primenjuju u asimetričnoj sintezi u farmaceutskoj industriji. Za laboratorijsku organsku sintezu, mnogi organolitijumski reagensi su komercijalno dostupni u obliku rastvora. Ovi reagensi su veoma reaktivni, a ponekad su i piroforni.
Kao i njegova neorganska jedinjenja, skoro sva organska jedinjenja litijuma formalno slede duetno pravilo (npr. BuLi, MeLi). Međutim, važno je napomenuti da u odsustvu koordinirajućih rastvarača ili liganada, organolitijumova jedinjenja formiraju dimerne, tetramerne i heksamerne klastere (npr. BuLi je zapravo [BuLi]6, a MeLi je zapravo [MeLi]4) koji imaju višestruke centre vezivanja, čime se povećava koordinacioni broj oko litijuma. Ovi klasteri se razlažu na manje ili monomerne jedinice u prisustvu rastvarača kao što je dimetoksietan (DME) ili liganda kao što je tetrametiletilendiamin (TMEDA).[129] Kao izuzetak od pravila dueta, kristalografski je okarakterisan dvokoordinatni litatni kompleks sa četiri elektrona oko litijuma, [Li(thf)4]+[((Me3Si)3C)2Li]–.[130]
Struktura
[uredi | uredi izvor]Iako su jednostavne vrste alkillitijuma često predstavljene kao monomer RLi, one postoje kao agregati (oligomeri) ili polimeri.[131] Stepen agregacije zavisi od organskog supstituenta i prisustva drugih liganada.[132][133] Ove strukture su razjašnjene različitim metodama, posebno 6Li, 7Li, and 13C NMR spektroskopijom i analizom difrakcije rendgenskih zraka.[134] Računarska hemija podržava ove zadatke.[131]
Priroda veze ugljenik-litijum
[uredi | uredi izvor]
Relativna elektronegativnost ugljenika i litijuma sugeriše da je C−Li veza visoko polarna.[135][136][137] Međutim, određena organolitijumova jedinjenja poseduju svojstva kao što je rastvorljivost u nepolarnim rastvaračima koja komplikuju problem.[135] Dok većina podataka sugeriše da je C−Li veza u suštini jonska, bilo je debate o tome koliko kovalentnog karaktera postoji u njoj.[136][137] Prema jednoj proceni procenat jonskog karaktera jedinjenja alkillitijuma iznosi 80 do 88%.[138]
U alil litijumskim jedinjenjima, litijumski katjon se koordinira prema površini ugljenične π veze na η3 način umesto lokalizovanog, karbanionskog centra, tako da su alilitijumi često manje agregirani od alkillitijuma.[132][139] U arillitijumskim kompleksima, litijumski katjon se koordinira ka jednom karbanjonskom centru preko Li−C σ tipa veze.[132][140]
Struktura čvrstog stanja
[uredi | uredi izvor]
Kao i druge vrste koje se sastoje od polarnih podjedinica, organolitijumske vrste se agregiraju.[133][141] Na formiranje agregata utiču elektrostatičke interakcije, koordinacija između litijuma i okolnih molekula rastvarača ili polarnih aditiva, i sterički efekti.[133]
Osnovni gradivni blok za izgradnju složenijih struktura je karbanjonski centar koji ostvaruje interakciju sa Li3 trouglom na η3- način.[131] U jednostavnim alkillitijumskim reagensima, ovi trouglovi se agregiraju i formiraju tetraedarske ili oktaedarske strukture. Na primer, metillitijum, etillitijum i tert-butillitijum postoje u tetrameru [RLi]4. Metillitijum postoji u vidu tetramera u klasteru kubnog tipa u čvrstom stanju, sa četiri centra litijuma koji formiraju tetraedar. Svaki metanid u tetrameru u metillitijumu može imati agostičnu interakciju sa litijumskim katjonima u susednim tetramerima.[131][133] Etillitijum i tert-butillitijum, s druge strane, ne manifestuju ovu interakciju, te su stoga rastvorljivi u nepolarnim ugljovodoničnim rastvaračima. Druga klasa alkillitijuma poprima heksamerne strukture, kao što su n-butillitijum, izopropillitijum i cikloheksanillitijum.[131]

Uobičajeni litijum amidi, npr. litijum bis(trimetilsilil)amid i litijum diizopropilamid, takođe su podložni agregaciji.[142] Litijumski amidi usvajaju strukture tipa polimerne lestvice u nekoordinacionom rastvaraču u čvrstom stanju, i generalno postoje kao dimeri u eteričnim rastvaračima. U prisustvu snažno donirajućih liganada, formiraju se tri- ili tetramerni litijumski centri.[143] Na primer, LDA postoji prvenstveno u vidu dimera u THF.[142] Strukture uobičajenih litijumskih amida, kao što su litijum diizopropilamid (LDA) i litijum heksametildisilazid (LiHMDS) su sveobuhvatno proučavali Kolam i njegovi saradnici koristeći NMR spektroskopiju.[144] Druga važna klasa reagensa su silillitijumi, koji se ekstenzivno koriste u sintezi organometalnih kompleksa i polisilanskih dendrimera.[133][145] U čvrstom stanju, za razliku od alkillitijumskih reagenasa, većina silillitijuma teži da formira monomerne strukture koordinisane sa molekulima rastvarača kao što je THF, a samo nekoliko silillitijuma je okarakterisano kao viši agregati.[133] Ova razlika može proizaći iz metode pripreme silillitijuma, sterične smetnje uzrokovane glomaznim alkil supstituentima na silicijumu i manje polarizovane prirode Si−Li veza. Dodavanje snažno donirajućih liganda, kao što su TMEDA i (-)-spartein, može zameniti koordinirajuće molekule rastvarača u silillitijumima.[133]
Struktura u rastvoru
[uredi | uredi izvor]Moguće je da organolitijumski reagensi u rastvoru usvoje strukture koje se razlikuju od čvrstog stanja.[132][146] NMR spektroskopija se pojavila kao moćno sredstvo za proučavanje organolitijumskih agregata u rastvoru. Za alkillitijumske vrste, C−Li J sprega se često može koristiti za određivanje broja litijuma u interakciji sa karbanjonskim centrom, i da li su ove interakcije statičke ili dinamičke.[132] Odvojeni NMR signali takođe mogu razlikovati prisustvo višestrukih agregata od zajedničke monomerne jedinice.[147]
Organolitijumova jedinjenja vezuju Luisove baze kao što su tetrahidrofuran (THF), dietil etar (Et2O), tetrametiletilen diamin (TMEDA) ili heksametilfosforamid (HMPA).[131] Metillitijum je poseban slučaj: na njegovu tetramernu strukturu ne utiče etar ili čak HMPA.[133] S druge strane, THF deagregira heksamerni butil litijum: tetramer je glavna vrsta, a ΔG za međukonverziju između tetramera i dimera je oko 11 kcal/mol.[148] TMEDA takođe može da helatira sa litijumskim katjonima u n-butillitijumu i formira solvatne dimere kao što je [(TMEDA) LiBu-n)]2.[131][132] Pokazano je da fenillitijum postoji kao iskrivljeni tetramer u kristalizovanom etarskom solvatu i kao mešavina dimera i tetramera u etarskom rastvoru.[132]
| Alkil grupa | Rastvarač | Struktura |
|---|---|---|
| metil | THF | tetramer |
| etar/HMPA | tetramer | |
| n‑butil | pentan | heksamer |
| etar | tetramer | |
| THF | tetramer-dimer | |
| sec‑butil | pentan | heksamer-tetramer |
| izopropil | pentan | heksamer-tetramer |
| tert‑butil | pentan | tetramer |
| THF | monomer | |
| fenil | etar | tetramer-dimer |
| etar/HMPA | dimer |
Struktura i reaktivnost
[uredi | uredi izvor]Kako se strukture organolitijumskih reagenasa menjaju u zavisnosti od njihovog hemijskog okruženja, menja se i njihova reaktivnost i selektivnost.[133][149] Jedno pitanje koje obuhvata odnos strukture i reaktivnosti je da li postoji korelacija između stepena agregacije i reaktivnosti organolitijumskih reagensa. Prvobitno je predloženo da su niži agregati kao što su monomeri reaktivniji u alkillitijumima.[150] Međutim, takođe su otkriveni reakcioni putevi u kojima su dimer ili drugi oligomeri reaktivne vrste,[151] a za litijum amide kao što je LDA, reakcije zasnovane na dimerima su uobičajene..[152] Serija studija kinetike rastvora reakcija kojima posreduje LDA sugeriše da niži agregati enolata ne dovode nužno do veće reaktivnosti.[144]
Takođe, neke Luisove baze povećavaju reaktivnost organolitijumskih jedinjenja.[153][154] Međutim, nije uvek jasno da li ovi aditivi funkcionišu kao jaki helatni ligandi i kako se uočeno povećanje reaktivnosti odnosi na strukturne promene u agregatima izazvanim ovim aditivima.[153][154] Na primer, TMEDA povećava stope i efikasnost u mnogim reakcijama koje uključuju organolitijumske reagense.[133] Prema alkillitijum reagensima, TMEDA deluje kao donorski ligand, smanjuje stepen agregacije,[131] i povećava nukleofilnost ovih vrsta.[155] Međutim, TMEDA ne funkcioniše uvek kao donorski ligand za litijumski katjon, posebno u prisustvu anjonskih centara kiseonika i azota. Na primer, on samo slabo reaguje sa LDA i LiHMDS čak i u ugljovodoničnim rastvaračima bez konkurentskih donorskih liganda.[156] U litiranju iminom, dok THF deluje kao jak donirajući ligand za LiHMDS, slabo koordinirajući TMEDA se lako odvaja od LiHMDS, što dovodi do formiranja LiHMDS dimera koji su reaktivnije vrste. Dakle, u slučaju LiHMDS, TMEDA ne povećava se reaktivnost smanjenjem agregacionog stanja.[157] Takođe, za razliku od jednostavnih alkillitijumovih jedinjenja, TMEDA ne deagregira litio-acetofenolat u THF rastvoru.[132][158] Dodavanje HMPA litijum amidima kao što su LiHMDS i LDA često rezultira mešavinom dimer/monomernih agregata u THF. Međutim, odnos vrsta dimer/monomer se ne menja sa povećanjem koncentracije HMPA, tako da uočeno povećanje reaktivnosti nije rezultat deagregacije. Mehanizam kojim ovi aditivi povećavaju reaktivnost se još uvek istražuje.[149]
Reaktivnost i primena
[uredi | uredi izvor]C−Li veza u organolitijumskim reagensima je visoko polarizovana. Kao rezultat toga, ugljenik privlači većinu elektronske gustine u vezi i podseća na karbanjon. Dakle, organolitijumski reagensi su jako bazični i nukleofilni. Neke od najčešćih primena organolitijumskih reagenasa u sintezi uključuju njihovu upotrebu kao nukleofila, jakih baza za deprotonaciju, inicijatora za polimerizaciju i polaznog materijala za pripremu drugih organometalnih jedinjenja.
Kao nukleofil
[uredi | uredi izvor]Reakcije karboliticije
[uredi | uredi izvor]Kao nukleofili, organolitijumski reagensi prolaze kroz reakcije karbolitijacije, pri čemu se veza ugljenik-litijum dodaje preko dvostruke ili trostruke veze ugljenik-ugljenik, formirajući nove organolitijumske vrste.[159] Ova reakcija je najrasprostranjenija reakcija organolitijumovih jedinjenja. Karbolitijacija je ključna u procesima anjonske polimerizacije, a n-butillitijum se koristi kao katalizator za iniciranje polimerizacije stirena, butadiena ili izoprena ili njihovih smeša.[160][161]
Druga primena koja koristi prednost ove reaktivnosti je formiranje karbocikličnih i heterocikličnih jedinjenja intramolekularnom karbolitijacijom.[159] Kao oblik anjonske ciklizacije, reakcije intramolekularne karbolitijacije nude nekoliko prednosti u odnosu na radikalnu ciklizaciju. Prvo, moguće je da ciklične organolitijumske vrste proizvoda reaguju sa elektrofilima, mada je često teško izolovati radikalni intermedijer korespondirajuće strukture. Drugo, anjonske ciklizacije su često regio- i stereospecifičnije od radikalne ciklizacije, posebno u slučaju 5-heksenillitijuma. Intramolekularna karbolitijacija omogućava dodavanje alkil-, vinillitijuma na trostruke veze i mono-alkil supstituisane dvostruke veze. Arillitijumi takođe mogu biti podvrgnuti dodavanju ako se formira petočlani prsten. Ograničenja intramolekularne karbolitijacije uključuju poteškoće u formiranju 3 ili 4-članih prstenova, pošto srednje ciklične vrste organolitijuma često imaju tendenciju da se podvrgavaju otvaranju prstena.[159] Ispod je dat primer reakcije intramolekularne karbolitijacije. Vrste litijuma koje potiču iz litijum-halogenske razmene ciklizuju se da formiraju vinillitijum kroz 5-egzo-trig zatvaranje prstena. Vinillitijumove vrste dalje reaguju sa elektrofilima i proizvode funkcionalizovana jedinjenja ciklopentilidena.[162]
Dodatak karbonilnim jedinjenjima
[uredi | uredi izvor]Nukleofilni organolitijumski reagensi mogu da se dodaju elektrofilnim karbonilnim dvostrukim vezama da bi se formirale veze ugljenik-ugljenik. Oni mogu da reaguju sa aldehidima i ketonima da bi proizveli alkohole. Dodavanje se odvija uglavnom polarnom adicijom, u kojoj nukleofilne organolitijumske vrste napadaju iz ekvatorijalnog pravca i stvaraju aksijalni alkohol.[163] Dodavanje litijumovih soli kao što je LiClO4 može poboljšati stereoselektivnost reakcije.[164]
Kada je keton sterički ometan, upotreba Grignardovih reagensa često dovodi do redukcije karbonilne grupe umesto adicije.[163] Međutim, manje je verovatno da će alkillitijumski reagensi redukovati keton i mogu se koristiti za sintezu supstituisanih alkohola.[165] Ispod je primer dodavanja etillitijuma adamantonu za proizvodnju tercijarnog alkohola.[166]
Organolitijumski reagensi su takođe bolji od Grignardovih reagensa u pogledu svoje sposobnosti da reaguju sa karboksilnim kiselinama i formiraju ketone.[163] Ova reakcija se može optimizovati pažljivim kontrolisanjem količine dodatog organolitijumskog reagensa, ili korišćenjem trimetilsilil hlorida da se ukloni višak litijumskog reagensa.[167] Češći način za sintezu ketona je dodavanje organolitijumskih reagenasa Vajnrebovim amidima (N-metoksi-N-metil amidi). Ova reakcija dovodi do formiranja ketona kada se organolitijumski reagensi koriste u višku, usled helacije litijumskih jona između N-metoksi kiseonika i karbonil kiseonika, koji formira tetraedarski međuproizvod koji kolapsira nakon kiselinskog tretmana.[168]
Organolitijumski reagensi takođe reaguju sa ugljen-dioksidom da bi nakon daljih koraka formirali karboksilne kiseline.[169]
U slučaju enonskog supstrata, gde su moguća dva mesta nukleofilne adicije (1,2 adicija karbonilnom ugljeniku ili 1,4 konjugovana adicija β ugljeniku), većina visoko reaktivnih organolitijumskih vrsta favorizuje 1,2 adiciju, međutim, postoji nekoliko načina da se organolitijumski reagensi podvrgnu dodavanju konjugata. Prvo, pošto je 1,4 adukt verovatno termodinamički povoljnija vrsta, adicija konjugata se može postići ekvilibracijom (izomerizacija dva proizvoda), posebno kada je litijumski nukleofil slab i 1,2 adicija je reverzibilna. Drugo, dodavanje donorskih liganda u reakciju formira heteroatomom stabilizovane vrste litijuma koje favorizuju dodavanje 1,4 konjugata. U jednom primeru, dodavanje niskog nivoa HMPA rastvaraču favorizuje 1,4 dodavanje. U odsustvu donorskog liganda, litijum katjon je blisko koordinisan sa atomom kiseonika, međutim, kada je litijumski katjon rastvoren pomoću HMPA, koordinacija između karbonilnog kiseonika i litijumskog jona je oslabljena. Ovaj metod se generalno ne može koristiti da utiče na regioselektivnost alkil- i arillitijumskih reagenasa.[170][171]
Organolitijumski reagensi takođe mogu izvršiti enantioselektivno nukleofilno dodavanje karbonilu i njegovim derivatima, često u prisustvu hiralnih liganda. Ova reaktivnost se široko primenjuje u industrijskim sintezama farmaceutskih jedinjenja. Jedan primer je Merk i Dupontova sinteza efavirenza, snažnog inhibitora reverzne transkriptaze HIV-a. Litijum acetilid se dodaje u prohiralni keton da bi se dobio proizvod hiralnog alkohola. Struktura aktivnog reakcionog intermedijera je određena NMR spektroskopskim studijama u stanju rastvora, i rendgenskom kristalografijom čvrstog stanja, da je kubni 2:2 tetramer.[172]
SN2 tip reakcija
[uredi | uredi izvor]Organolitijumski reagensi mogu poslužiti kao nukleofili i sprovesti reakcije SN2 tipa sa alkil ili alil halidima.[173] Iako se smatraju reaktivnijim od Grignardovih reagensa u alkilaciji, njihova upotreba je i dalje ograničena zbog konkurentskih sporednih reakcija kao što su radikalne reakcije ili metal-halogenska razmena. Većina organolitijumskih reagensa koji se koriste u alkilacijama je u većoj meri stabilizovana, manje bazna i manje agregirana, kao što su stabilizovani heteroatomi, aril- ili alillitijumski reagensi..[132] Pokazalo se da HMPA povećava brzinu reakcije i prinose proizvoda, a reaktivnost arillitijumskog reagensa je često poboljšana dodatkom kalijum alkoksida.[163] Organolitijumski reagensi takođe mogu da izvrše nukleofilne napade sa epoksidima da bi se formirali alkoholi.
Kao baza
[uredi | uredi izvor]Organolitijumski reagensi pružaju širok spektar bazičnosti. tert-Butillitijum, sa tri alkil grupe koje slabo doniraju elektrone, je najjača komercijalno dostupna baza (pKa = 53). Kao rezultat toga, kiseli protoni na −OH, −NH i −SH su često zaštićeni u prisustvu organolitijumskih reagensa. Neke od najčešće korišćenih litijumskih baza su alkillitijumove vrste kao što su n-butillitijum i litijum dialkilamidi (LiNR2). Reagensi sa glomaznim R grupama kao što su litijum diizopropilamid (LDA) i litijum bis(trimetilsilil)amid (LiHMDS) su često sterički ometani za nukleofilno dodavanje, te su stoga selektivniji prema deprotonaciji. Litijum dialkilamidi (LiNR2) se široko koriste pri formiranju enolata i aldolnoj reakciji.[174] Na reaktivnost i selektivnost ovih baza takođe utiču rastvarači i drugi kontrajoni.
Metalacija
[uredi | uredi izvor]Metalacija sa organolitijumskim reagensima, takođe poznata kao litijacija ili litijum-vodonična razmena, postiže se kada organolitijumski reagens, najčešće alkillitijum, apstrahuje proton i formira novu organolitijumsku vrstu.
-
(1)
Uobičajeni reagensi za metalizaciju su butillitijumi. tert-butillitijum i sec-butillitijum su generalno reaktivniji i imaju bolju selektivnost od n-butillitijuma, međutim, oni su takođe skuplji i njima se teško rukuje.[174] Metalizacija je uobičajen način pripreme raznovrsnih organolitijumskih reagenasa. Pozicija metalacije je uglavnom kontrolisana kiselošću C-H veze. Litijacija se često javlja na poziciji α prema grupama koje povlače elektrone, pošto su one dobre u stabilizaciji elektronske gustine anjona. Usmeravajuće grupe na aromatičnim i heterocikličnim jedinjenjima obezbeđuju regioselektivna mesta metalacije; usmerena orto metalacija je važna klasa reakcija metalacije. Metalirani sulfoni, acil grupe i α-metalirani amidi su važni intermedijeri u hemijskoj sintezi. Metaliranje alil etra sa alkillitijumom ili LDA formira anjon u α položaju prema kiseoniku, i može da se nastavi do 2,3-Vitigovog preuređenja. Dodavanje donorskih liganada kao što su TMEDA i HMPA može povećati brzinu metalacije i proširiti obim supstrata.[175] Hiralnim organolitijumskim reagensima se može pristupiti asimetričnom metalacijom.[176]
Usmerena orto metalacija je važno sredstvo u sintezi regiospecifičnih supstituisanih aromatičnih jedinjenja. Ovaj pristup litijaciji i naknadnom uklanjanju intermedijernih litijumskih vrsta sa elektrofilom je često bolje od elektrofilne aromatične supstitucije zbog svoje visoke regioselektivnosti. Ova reakcija se odvija deprotonacijom organolitijumskih reagensima na pozicijama α do direktne metalacione grupe (DMG) na aromatičnom prstenu. DMG je često funkcionalna grupa koja sadrži heteroatom koji je Luisno bazan i može da se koordinira sa Luisno kiselim litijum-katjonom. Ovo generiše kompleksno indukovani efekat blizine, koji usmerava deprotonaciju na α poziciji da bi se formirala vrsta arillitijuma koja može dalje da reaguje sa elektrofilima. Neki od najefikasnijih DMG agenasa su amidi, karbamati, sulfoni i sulfonamidi. To su grupe koje jako povlače elektrone čime povećavaju kiselost alfa-protona na aromatičnom prstenu. U prisustvu dva DMG-a, metalacija se često javlja orto prema jačoj usmeravajućoj grupi, mada se primećuju i mešoviti proizvodi. Brojna heterociklična jedinjenja koji sadrže kisele protone takođe mogu biti podvrgnuta orto-metalaciji. Međutim, za heterociklična jedinjenja siromašna elektronima, generalno se koriste litijum amidne baze kao što je LDA, pošto je primećeno da alkillitijum vrši adiciju u heterociklična jedinjenja siromašna elektronima, a ne deprotonaciju. U određenim prelaznim metal-arenskim kompleksima, kao što je ferocen, prelazni metal privlači elektronsku gustinu iz arena, čineći tako aromatične protone kiselijim i spremnim za orto-metalaciju.[177]
Superbaze
[uredi | uredi izvor]Dodavanje kalijum alkoksida alkillitijumu u velikoj meri povećava bazičnost organolitijumskih vrsta.[178] Najčešća „superbaza” se može formirati dodavanjem KOtBu butillitijumu, često skraćeno kao „LiCKOR” reagensi. Ove „superbaze” su visoko reaktivni i često stereoselektivni reagensi. U primeru ispod, LiCKOR baza generiše stereospecifičnu krotilboronatnu vrstu metalacijom i naknadnom litijum-metaloidnom razmenom.[179]
Asimetrična metalacija
[uredi | uredi izvor]Enantioobogaćene organolitijumske vrste mogu se dobiti asimetričnom metalacijom prohiralnih supstrata. Asimetrična indukcija zahteva prisustvo hiralnog liganda kao što je (-)-spartein.[176] Na enantiomerni odnos hiralnih vrsta litijuma često utiču razlike u stopama deprotonacije. U primeru ispod, tretman N-Boc-N-benzilamina sa n-butillitijumom u prisustvu (-)-sparteina daje jedan enantiomerni proizvod sa visokim enantiomernim viškom. Transmetalacija sa trimetilkalajhloridom daje suprotan enantiomer.[180]
Formiranje enolata
[uredi | uredi izvor]Litijumski enolati se formiraju deprotonacijom C−H veze na α poziciji u odnosu na karbonilnu grupu od strane organolitijumske vrste. Litijumski enolati se široko koriste kao nukleofili u reakcijama formiranja veze ugljenik-ugljenik kao što su aldolna kondenzacija i alkilacija. Oni su takođe važan intermedijer u formiranju silil enolnog etra.
Formiranje litijum enolata može se generalizovati kao kiselo-bazna reakcija, u kojoj relativno kiseli proton u α poziciji u odnosu na karbonilnu grupu (pK =20-28 u DMSO) reaguje sa organolitijumskom bazom. Generalno se koriste jake, nenukleofilne baze, posebno litijumski amidi kao što su LDA, LiHMDS i LiTMP. THF i DMSO su uobičajeni rastvarači u reakcijama litijum enolata.[181]
Stereohemija i mehanizam formiranja enolata izazvali su veliko interesovanje u hemijskoj zajednici. Mnogi faktori utiču na ishod stereohemije enolata, kao što su sterički efekti, rastvarač, polarni aditivi i tipovi organolitijumskih baza. Među mnogim modelima koji se koriste za objašnjenje i predviđanje selektivnosti u stereohemiji litijum enolata je irski model.[182]
U ovoj pretpostavci, monomerni LDA reaguje sa karbonilnim supstratom i formira ciklično prelazno stanje tipa Zimerman-Traksler. (E)-enolat je favorizovan zbog nepovoljne interakcije syn-pentana u (Z)-enolatnom prelaznom stanju.[181]
Dodavanje polarnih aditiva kao što su HMPA ili DMPU favorizuje formiranje (Z) enolata. Irski model navodi da se ovi donorski ligandi koordiniraju sa litijumskim katjonima, kao rezultat toga, interakcija karbonil kiseonika i litijuma je smanjena, a prelazno stanje nije tako čvrsto vezano kao šestočlana stolica. Procenat (Z) enolata se takođe povećava kada se koriste litijumske baze sa glomaznijim bočnim lancima (kao što je LiHMDS).[181] Međutim, i dalje se raspravlja o mehanizmu putem kog ovi aditivi preokreću stereoselektivnost.
Bilo je izvesnih izazova u pogledu primenljivosti irskog modela, jer on prikazuje litijumske entitete kao monomere u prelaznom stanju. U stvarnosti, različiti litijumski agregati se često primećuju u rastvorima litijum enolata, i u zavisnosti od specifičnog supstrata, rastvarača i reakcionih uslova, može biti teško odrediti koji je agregat stvarna reaktivna vrsta u rastvoru.[181]
Litijum-halogenska razmena
[uredi | uredi izvor]Litijum-halogenska razmena uključuje razmenu heteroatoma između organohalida i organolitijumskih vrsta.
-
(2)
Litijum-halogenska razmena je veoma korisna u pripremi novih organolitijumskih reagenasa. Primena litijum-halogenske razmene je ilustrovana Parhamovom ciklizacijom.[183]
Transmetalacija
[uredi | uredi izvor]Organolitijumski reagensi se često koriste za pripremu drugih organometalnih jedinjenja transmetalacijom. Organobakar, organokalaj, organosilicijum, organobor, organofosfor, organocerijum i organosumporna jedinjenja se često pripremaju reakcijom organolitijumskih reagensa sa odgovarajućim elektrofilima.
-
(3)
Uobičajeni tipovi transmetalacije uključuju Li/Sn, Li/Hg, i Li/Te razmenu, koja je brza na niskim temperaturama.[174] Prednost Li/Sn razmene je u tome što prekurzori tri-alkilstanana prolaze kroz nekoliko sporednih reakcija, pošto su rezultujući nusproizvodi n-Bu3Sn nereaktivni prema alkillitijumskim reagensima.[174] U sledećem primeru, vinilstanan, dobijen hidrostanilacijom terminalnog alkina, formira vinillitijum transmetalacijom sa n-BuLi.[184]
Organolitijum se takođe može koristiti za pripremu organocinkovih jedinjenja putem transmetalacije sa solima cinka.[185]
Litijum diorganokuprati se mogu formirati reakcijom alkil litijumskih jedinjenja sa bakar(I) halidom. Dobijeni organokuprati su generalno manje reaktivni prema aldehidima i ketonima od organolitijumskih reagensa ili Grignardovih reagenasa.[186]
Priprema
[uredi | uredi izvor]Većina jednostavnih alkillitijumskih reagensa, i uobičajenih litijumskih amida je komercijalno dostupna u različitim rastvaračima i koncentracijama. Organolitijumski reagensi se takođe mogu pripremiti u laboratoriji. Ispod su navedene neke uobičajene metode za pripremu organolitijumskih reagenasa.
Reakcija sa metalnim litijumom
[uredi | uredi izvor]Redukcija alkil halida metalnim litijumom može dati jednostavne alkil i aril organolitijumske reagense.[163]
-
(4)
Industrijska priprema organolitijumskog reagenasa se ovim metodom postiže tretiranjem alkil hlorida metalnim litijumom koji sadrži 0,5–2% natrijuma. Konverzija je veoma egzotermna. Natrijum pokreće radikalni put i povećava stopu reakcije.[187] Redukcija se odvija mehanizmom radikala. Ispod je primer pripreme funkcionalizovanog litijumskog reagensa korišćenjem redukcije metalnim litijumom.[188] Ponekad se metalni litijum u obliku finog praha koristi u reakciji sa određenim katalizatorima kao što su naftalen ili 4,4'-di-t-butilbifenil (DTBB). Još jedan supstrat koji se može redukovati metalnim litijumom za generisanje alkillitijumskih reagensa su sulfidi. Redukcija sulfida je korisna u formiranju funkcionalizovanih organolitijumskih reagenasa kao što su alfa-lito etri, sulfidi i silani.[189]
Metalacija
[uredi | uredi izvor]Drugi metod pripreme organolitijumskih reagenasa je metalizacija (razmena litijum vodonika). Relativna kiselost atoma vodonika kontroliše položaj litijacije.
Ovo je najčešći metod za pripremu alkinillitijumskog reagenasa, jer je terminalni vodonik koji je vezan za sp ugljenik veoma kiseo i lako se deprotonira.[163] Za aromatična jedinjenja, položaj litijacije je takođe određen usmeravajućim dejstvom supstituentskih grupa.[190] Neke od najefikasnijih usmeravajućih grupa supstituenta su alkoksi, amido, sulfoksid, sulfonil. Metalacija se često javlja na orto poziciji ovih supstituenata. U heteroaromatičnim jedinjenjima, metalizacija se obično dešava na orto poziciji prema heteroatomu.[163][190]
Litijum-halogenska razmena
[uredi | uredi izvor]Treći metod za pripremu organolitijumskih reagensa je litijum-halogenska razmena.
tert-butillitijum ili n-butillitijum su najčešće korišćeni reagensi za generisanje novih organolitijumskih vrsta putem litijum-halogenske razmene. Litijum-halogenska razmena se uglavnom koristi za pretvaranje aril i alkenil jodida i bromida sa sp2 ugljenicima u odgovarajuća organolitijumova jedinjenja. Reakcija je izuzetno brza i često se odvija na -60 do -120 °C.[175]
Transmetalacija
[uredi | uredi izvor]Četvrta metoda za pripremu organolitijumskih reagenasa je transmetalacija. Ovaj metod se može koristiti za pripremu vinillitijuma.
Šapirova reakcija
[uredi | uredi izvor]U Šapirovoj reakciji, dva ekvivalenta jake alkillitijumske baze reaguju sa jedinjenjima p-tozilhidrazona da bi se proizveo vinillitijum, kao i olefinsk proizvod.
Rukovanje
[uredi | uredi izvor]Organolitijumska jedinjenja su visoko reaktivne materije i zahtevaju specijalizovane tehnike rukovanja. Često su korozivna, zapaljiva, a ponekad i piroforna (dolazi do spontanog paljenja kada su izložena vazduhu ili vlazi).[191] Alkillitijumski reagensi takođe mogu da se podvrgnu termičkoj razgradnji da bi se formirale odgovarajuće alkil vrste i litijum hidrid.[192] Organolitijumski reagensi se obično čuvaju na temperaturi ispod 10 °C. Reakcije se sprovode bezvazdušnim tehnikama.[191] Koncentracija alkillitijumskog reagensa se često određuje titracijom.[193][194][195]
Organolitijumski reagensi reaguju, često sporo, sa etrima, koji se često koriste kao rastvarači.[196]
| Rastvarač | Temp | n-BuLi | s-BuLi | t-BuLi | MeLi | CH2=C(OEt)-Li | CH2=C(SiMe3)-Li |
|---|---|---|---|---|---|---|---|
| THF | −40 °C | 338 min | |||||
| THF | −20 °C | 42 min | |||||
| THF | 0 °C | 17 h | |||||
| THF | 20 °C | 107 min | >15 h | 17 h | |||
| THF | 35 °C | 10 min | |||||
| THF/TMEDA | −20 °C | 55 h | |||||
| THF/TMEDA | 0 °C | 340 min | |||||
| THF/TMEDA | 20 °C | 40 min | |||||
| Etar | −20 °C | 480 min | |||||
| Etar | 0 °C | 61 min | |||||
| Etar | 20 °C | 153 h | <30 min | 17 d | |||
| Etar | 35 °C | 31 h | |||||
| Etar/TMEDA | 20 °C | 603 min | |||||
| DME | −70 °C | 120 min | 11 min | ||||
| DME | −20 °C | 110 min | 2 min | ≪2 min | |||
| DME | 0 °C | 6 min |
Dobijanje
[uredi | uredi izvor]Proizvodnja litijuma je značajno porasla od kraja Drugog svetskog rata. Glavni izvori litijuma su slana voda i rude. Metalni litijum se proizvodi elektrolizom primenjenom na mešavinu sa 55% litijum hlorida i 45% kalijum hlorida na oko 450 °C.[197]
| Zemlja | Produkcija | Rezerve[note 1] | Resursi |
|---|---|---|---|
| Argentina | 6.590 | 3.600.000 | 22.000.000 |
| Australija | 74.700 | 6.200.000 | 8.700.000 |
| Austrija | - | - | 60.000 |
| Bolivija | - | - | 23.000.000 |
| Brazil | 2.630 | 390.000 | 800.000 |
| Kanada | 520 | 930.000 | 3.000.000 |
| Čile | 38.000 | 9.300.000 | 11.000.000 |
| Kina | 22.600 | 3.000.000 | 6.800.000 |
| Češka | - | - | 1.300.000 |
| DR Kongo | - | - | 3.000.000 |
| Finska | - | - | 68.000 |
| Nemačka | - | - | 3.800.000 |
| Gana | - | - | 200.000 |
| Indija | - | - | 5.900.000[198][199] |
| Kazahstan | - | - | 50.000 |
| Mali | - | - | 890.000 |
| Meksiko | - | - | 1.700.000 |
| Namibija | - | - | 230.000 |
| Peru | - | - | 1.000.000 |
| Portugalija | 380 | 60.000 | 270.000 |
| Rusija | - | - | 1.000.000 |
| Srbija | - | - | 1.200.000 |
| Španija | - | - | 320.000 |
| Sjedinjene Države | 870[note 2] | 1.100.000 | 14.000.000 |
| Zimbabve | 1.030 | 310.000 | 690.000 |
| Druge zemlje | - | 2.800.000 | - |
| Svetski total | 146.000[note 3] | 28.000.000 | 105.000.000+ |
Dobija se ekstrakcijom iz minerala na razne načine, ali se svi oni zasnivaju ili na slabijoj rastvorljivosti litijum-karbonata, a u odnosu na karbonate drugih alkalnih metala ili na rastvorljivosti litijum hlorida u alkoholu. Takođe, litijum se može dobiti elektrolizom stopljenog litijum hlorida.[20] Iz slanih rastvora koji sadrže litijum, može se istaložiti litijum-karbonat razblaživanjem vodom i dodavanjem natrijum karbonata (sode). Zatim se uparava slana voda u vazduhu sve dok udeo litijuma ne pređe 0,5%. Dodavanjem natrijum karbonata iz nje se počinje taložiti teško rastvorljivi litijum karbonat:
- .
Ne računajući proizvodnju u SAD, tokom 2008. godine u svetu je proizvedeno oko 27.400 tona litijuma,[200] a uglavnom se na tržištu prodavao u obliku litijum karbonata (Li2CO3). Od ove količine 12.000 tona otpada na čileansku Salar de Atakama, a gotovo 7.000 tona na australijski rudnik Grinbušes.
Da bi se dobio metalni litijum, prvo se litijum karbonatu dodaje hlorovodonična kiselina. Pri tome nastaje ugljen-dioksid koji se izdvaja kao gas, te preostaje rastvoreni litijum hlorid. Ovaj rastvor se stavlja u vakuumski isparivač gde se uparava, sve dok se hlorid ne iskristalizuje:
Uređaji i oprema koja se koristi za dobijanje litijum-hlorida moraju biti načinjeni iz posebnih vrsta čelika ili legura nikla, jer slani rastvor deluje izuzetno korozivno. Metalni litijum se dobija elektrolizom topivim elektrodama pri temperaturi od 352 °C iz istopljene eutektične smese iz 52 masena postotka litijum hlorida i 48 masena postotka kalijum hlorida:
odnosno:
- .
Međutim, u procesu elektrolize, kalijum se ne izdvaja, jer u istopljenom hloridu on ima niži elektrodni potencijal. Za razliku od njega, tragovi natrijuma se izdvajaju, te čine litijum izuzetno reaktivnim (što je prednost u organskoj hemiji, ali ne i za Li-baterije). Tečni litijum se skuplja na površini elektrolita, te se relatno lako može izdvojiti iz elektrolitičke ćelije. Litijum je takođe moguće dobiti i elektrolizom litijum-hlorida u piridinu. Ova metoda je posebno pogodna za laboratorijsko dobijanje manjih količina litijuma.
Rezerve i zastupljenost
[uredi | uredi izvor]Mala jonska veličina otežava uključivanje litijuma u rane faze kristalizacije minerala. Kao rezultat, litijum ostaje u rastopljenim fazama, gde se obogaćuje, sve dok se ne očvrsne u završnim fazama. Takvo obogaćivanje litijumom je odgovorno za nastanak svih komercijalno obećavajućih ležišta litijumske rude. Slane vode (i suva so) su još jedan važan izvor Li++. Iako je broj poznatih naslaga i slaništa koji sadrže litijum veliki, većina njih je ili mala ili ima preniske koncentracije Li+. Stoga se smatra da samo nekoliko ima komercijalnu vrednost.[201]
Američki geološki zavod (USGS) procenjuje da su širom sveta identifikovane rezerve litijuma u 2020. i 2021. godini iznosile 17 miliona i 21 milion tona, respektivno.[76][75] Tačna procena svetskih rezervi litijuma je teška.[202][203] Jedan od razloga za ovo je što je većina šema klasifikacije litijuma razvijena za čvrsta ležišta rude, dok je slani rastvor fluid koju je problematično tretirati istom šemom klasifikacije zbog različitih koncentracija i efekata pumpanja.[204]
Godine 2019, svetska proizvodnja litijuma iz spodumena[205][206][207] bila je oko 80.000 tona godišnje, prvenstveno iz grinbuškog pegmatita i iz nekih kineskih i čileanskih izvora. Rudnik Talison u Grinbušu je verovatno najveći, i smatra se da ima najviši nivo rude sa 2,4% Li2O (podaci iz 2012. godine).[208]
Litijumski trougao i drugi izvori
[uredi | uredi izvor]Četiri zemlje s najvećom proizvodnjom litijuma od 2019. godine, prema izveštaju Geološkog zavoda SAD, su Australija, Čile, Kina i Argentina.[76]
Tri zemlje Čile, Bolivija i Argentina sadrže region poznat kao litijumski trougao.[209][210] Litijumski trougao je poznat po svojim visokokvalitetnim solanama, koje uključuju bolivijski Salar de Ujuni, čileanski Salar de Atakama i argentinski Salar de Arizaro. Veruje se da litijumski trougao sadrži preko 75% postojećih poznatih rezervi litijuma.[211] Naslage se takođe nalaze u Južnoj Americi širom planinskog lanca Anda. Čile je vodeći proizvođač, a sledi mu Argentina. Obe zemlje izvlače litijum iz bazena slane vode. Prema USGS-u, pustinja Ujuni u Boliviji ima 5,4 miliona tona litijuma.[212][213] Polovina svetskih poznatih rezervi nalazi se u Boliviji duž centralno istočnih padina Anda. Bolivijska vlada je uložila 900 miliona dolara u proizvodnju litijuma i 2021. godine je uspešno proizvedeno 540 tona.[214][212] Rasoli u solanama litijumskog trougla veoma variraju u sadržaju litijuma.[215] Koncentracije takođe mogu varirati tokom vremena jer su slani rastvori promenljive i pokretne tečnosti.[215]
U SAD, litijum se dobija iz slanih bazena u Nevadi.[30] Projekti su takođe u razvoju u Litijumskoj dolini u Kaliforniji.[216]
Tvrdostenske naslage
[uredi | uredi izvor]Od 2018. poznato je da Demokratska Republika Kongo ima jedno od najvećih nalazišta na svetu litijumskih spodumenskih depozita u vidu tvrdih stena.[217] Nalazište koje se nalazi u Manonu, DRK, može da sadrži do 1,5 milijardi tona litijumskog spodumena. Dva najveća nalazišta pegmatita (poznata kao Carriere de l'Este Pegmatite i Roche Dure Pegmatite) su slične veličine ili veći od poznatog Grinbuškog pegmatita u Zapadnoj Australiji. Stoga se očekuje da će Demokratska Republika Kongo biti značajan dobavljač litijuma u svetu visokog kvaliteta i niskim sadržajem nečistoća.
Dana 16. jula 2018. godine, 2,5 miliona tona visokokvalitetnih resursa litijuma i 124 miliona funti resursa uranijuma pronađeno je u tvrdostenskom ležištu Falčani u regionu Puno, Peru.[218] Australija je 2020. godine dodelila status glavnog projekta (MPS) Finiskom litijumskom projekatu za strateški važno nalazište litijuma: procenjenih 3,45 miliona tona (Mt) mineralnih resursa sa 1,4 procenta litijum oksida.[219][220] Operativno iskopavanje je počelo 2022. godine.[221]
Procenjuje se da ležište otkriveno 2013. godine u vajominškom Rok Springs uzdizanju sadrži 228.000 tona. Dodatna ležišta u istoj formaciji procenjena su na čak 18 miliona tona.[222] Slično u Nevadi, Makdermitova kaldera je lokacija vulkanskog blata sa litijumom koji se sastoji od najvećih poznatih depozita litijuma u Sjedinjenim Državama.[223]
Poznato je da provincija Pampean Pegmatit u Argentini ima total od najmanje 200.000 tona spodumena sa sadržajem litijum oksida (Li2O) koji varira između 5 i 8 težinskih %.[224]
Kolmozerskoje, najveće nalazište litijuma u Rusiji, nalazi se u Murmanskoj oblasti. Godine 2023, Polarni litijum, zajedničko preduzeće Nornikla i Rosatoma, dobilo je pravo da razvija nalazište. Projekat ima za cilj proizvodnju 45.000 tona litijum karbonata i hidroksida godišnje i planira se dostizanje punog projektovanog kapaciteta do 2030. godine.[225]
Izvori
[uredi | uredi izvor]Još jedan potencijalni izvor litijuma prema podacima iz 2012. godine identifikovan je kao procedne vode geotermalnih bunara, koje se izvlače na površinu.[226] Izdvajanje ove vrste litijuma je demonstrirano na terenu; litijum se odvaja jednostavnom filtracijom.[227] Rezerve su ograničenije od rezervi rezervoara slane vode i tvrdih stena.
Cene
[uredi | uredi izvor]
Godine 1998. cena litijum metala je bila oko 95 USD/kg.[228] Posle finansijske krize 2007. godine, vodeći dobavljači, kao što je Sosijedad Kimika i Minera (SQM), snizili su cene litijum karbonata za 20%.[229] Cene su porasle 2012. godine. U jednom članku objavljenom u časopisu Poslovna nedelja iz 2012. opisana je oligopolija litijumskog prostora: „SQM, koji kontroliše milijarder Hulio Pons, je drugi po veličini, a sledi Rokvud, koji podržava KKR & Ko. Henrija Kravisa, i filadelfijski FMC“, pri čemu se Talison spominje kao najveći proizvođač.[230] Smatralo se da globalna potrošnja može skočiti na 300.000 metričkih tona godišnje do 2020. sa oko 150.000 tona u 2012. godini, kako bi podmirila potražnja za litijumskim baterijama koja raste za oko 25% godišnje, nadmašujući ukupni porast proizvodnih kapaciteta litijuma od 4% do 5%.[230]
Informativni servis o cenama ISE – Institut za elemente retkih zemalja i strateške metale – daje za različite litijumske supstance u proseku od marta do avgusta 2022. godine sledeće cene kilograma stabilne u toku kursa: litijum karbonat čistoće 99,5% min, različitih proizvođača između 63 i 72 EUR/kg. Litijum hidroksid monohidrat LiOH 56,5% min, Kina, 66 do 72 EUR/kg; isporučeno Južnoj Koreji - 73 EUR/kg. Metalni litijum 99,9% min, isporučeno Kini - 42 EUR/kg.[231]
Ekstrakcija
[uredi | uredi izvor]
Litijum i njegova jedinjenja su istorijski izolovani i ekstrahovani iz tvrdih stena, ali su do 1990-ih mineralni izvori, bazeni sa slanom vodom i slanovodni depoziti postali dominantni izvor. Najviše ih je bilo u Čileu, Argentini i Boliviji.[75] Velika ležišta litijumske gline koja se razvijaju u Makdermitovoj kalderi (Nevada, Sjedinjene Države) zahtevaju koncentrovanu sumpornu kiselinu da bi se litijum izvukao iz glinene rude.[232]
Do početka 2021. godine, veliki deo iskopanog litijuma na globalnom nivou dolazi ili iz „spodumena, minerala sadržanog u tvrdim stenama koje se nalaze na lokacijama kao što su Australija i Severna Karolina“[233] ili iz slane slane vode koja se ispumpava direktno iz zemlje, kao što je na lokacijama u Čileu.[233][215] U čileanskoj Salar de Atakami, koncentracija litijuma u slanoj vodi se povećava solarnim isparavanjem u sistemu jezera.[215] Za obogaćivanje procesom isparavanja može biti potrebno i do godinu i po, kada slana voda dostiže sadržaj litijuma od 6%.[215] Finalna obrada u ovom primeru se vrši u blizini grada Antofagasta na obali gde se čisti litijum karbonat, litijum hidroksid i litijum hlorid proizvode iz slane vode.[215]
Očekuje se da će kobaltne katode za litijumske baterije zahtevati litijum hidroksid, a ne litijum karbonat kao sirovinu, a taj trend favorizuje stenu kao izvor.[234][235][236]
Jedna metoda za ekstrakciju litijuma, kao i drugih vrednih minerala, je obrada geotermalne slane vode kroz elektrolitičku ćeliju koja se nalazi unutar membrane.[237]
Predložena je upotreba elektrodijalize i elektrohemijske interkalacije za ekstrakciju litijumovih jedinjenja iz morske vode (koja sadrži litijum u količini od 0,2 dela na milion).[238][239][240][241] Jonsko-selektivne ćelije unutar membrane u principu mogu sakupljati litijum bilo korišćenjem električnog polja ili razlikom u koncentraciji.[241]
Ekološki problemi
[uredi | uredi izvor]Proizvodni procesi litijuma, uključujući rastvarače i rudarski otpad, predstavljaju značajne opasnosti po životnu sredinu i zdravlje.[242][243][244] Ekstrakcija litijuma može biti fatalna za vodeni život zbog zagađenja vode.[245] Poznato je da se uzrokuje kontaminacija površinskih voda, kontaminacija vode za piće, respiratorni problemi, degradacija ekosistema i oštećenje pejzaža.[242] To takođe dovodi do neodržive potrošnje vode u sušnim regionima (1,9 miliona litara po toni litijuma).[242] Ogromno stvaranje nusproizvoda ekstrakcije litijuma takođe predstavlja nerešene probleme, kao što su velike količine otpada od magnezijuma i kreča.[246]
U Sjedinjenim Državama, eksploatacija otvorenog kopa i eksploatacija planinskih vrhova se takmiče sa eksploatacijom iz slane vode.[247] Zabrinutost za životnu sredinu obuhvata degradaciju staništa divljih životinja, zagađenje vode za piće uključujući zagađenje arsenom i antimonom, neodrživo smanjenje nivoa vode i masivni rudarski otpad, uključujući nusproizvod radioaktivnog uranijuma i ispuštanje sumporne kiseline.
Pitanja ljudskih prava
[uredi | uredi izvor]Studija odnosa između kompanija za vađenje litijuma i starosedelačkog stanovništva u Argentini pokazala je da država nije zaštitila prava autohtonih naroda na slobodan prethodni i informisani pristanak, i da kompanije za ekstrakciju generalno kontrolišu pristup zajednice informacijama i postavljaju uslove za diskusiju o projektu i podeli koristi.[248]
Razvoj rudnika litijuma Takerov prevoj u Nevadi, Sjedinjene Države, naišao je na proteste i tužbe nekoliko domorodačkih plemena koja su izjavila da nisu dala slobodan prethodni i informisani pristanak, i da projekat ugrožava kulturna i sveta mesta.[249] Oni su takođe izrazili zabrinutost da će razvoj projekta stvoriti rizik za urođeničke žene, jer je vađenje resursa povezano sa nestalim i ubijenim domorodačkim ženama.[250] Demonstranti su držali pod okupacijom lokaciju predloženog rudnika od januara 2021. godine.[251][247]
Upotreba
[uredi | uredi izvor]
Najveći deo proizvedenih soli litijuma se ne redukuje do metalnog litijuma, već se koristi bilo direktno kao litijum karbonat, litijum hidroksid, litijum hlorid, litijum bromid ili se prevodi u neki drugo jedinjenje litijuma. Kao metal, on je neophodan u određenom broju aplikacija, među kojima je najviše u industriji baterija i industriji stakla i keramike.
Kao metal
[uredi | uredi izvor]Deo proizvedenog metalnog litijuma koristi se za dobijanje njegovih jedinjenja, koja se ne mogu direktno dobiti iz litijum karbonata. To su, u prvom redu, organolitijumska jedinjenja poput butil litijuma, jedinjenja litijuma i vodonika kao litijum hidrida (LiH) ili litijum aluminijum hidrida kao i litijum amida. Zbog sposobnosti litijuma da reaguje direktno sa azotom, koristi se i za uklanjanje tog gasa tamo gde je to neophodno.
Metalni litijum je izuzetno snažno redukciono sredstvo. On redukuje mnoge materijale, koji inače ne reaguju sa drugim redukcionim sredstvima. Upotrebljava se i za delimično hidriranje aromatičnih jedinjenja (Birčova redukcija). U metalurgiji, koristi se za odstranjivanje sumpora iz istopljenog željeza, dezoksidaciju i uklanjanje ugljenika iz istopljenih metala.
Pošto litijum ima veoma nizak elektrodni potencijal, može se upotrebljavati u baterijama kao anoda. Takve litijumske baterije imaju vrlo veliku gustinu energije, a mogu proizvesti posebno visok električni napon. Treba razlikovati litijumske baterije koje se ne mogu ponovno puniti sa punjivim litijum-jonskim baterijama (akumulatorima), kod kojih se kao katoda koristi metalni oksid litijuma kao na primjer litijum kobalt oksid, a na strani anode koristi se grafit ili neko jedinjenje na kojem se interkaliraju joni litijuma.[252]
Metalurgija
[uredi | uredi izvor]Litijum (npr. kao litijum karbonat) se koristi kao aditiv šljaci iz kalupa za kontinualno livenje gde povećava fluidnost,[253][254] što je upotreba koja sačinjava 5% globalne potrošnje litijuma (2011).[76] Jedinjenja litijuma se takođe koriste kao aditivi (fluksovi) za livnički pesak za livenje gvožđa da bi se smanjilo stvaranje vena.[255]
Litijum (kao litijum fluorid) se koristi kao aditiv u topionicama aluminijuma (Hol–Heroultov proces), smanjujući temperaturu topljenja i povećavajući električni otpor,[256] što je upotreba koja konzumira 3% proizvedene količine (2011).[76]
Kada se koristi kao fluks za zavarivanje ili lemljenje, metalni litijum promoviše stapanje metala tokom procesa[257] i eliminiše stvaranje oksida apsorbujući nečistoće.[258] Legure metala sa aluminijumom, kadmijumom, bakrom i manganom se koriste za izradu delova aviona visokih performansi i male gustine (videti takođe legure litijum-aluminijuma).[259]
Silicijumsko nano-zavarivanje
[uredi | uredi izvor]Utvrđeno je da litijum pomaže savršenstvu silicijumskih nano-varova u elektronskim komponentama za električne baterije i druge uređaje.[260]
Istraživanje (atomska fizika)
[uredi | uredi izvor]U oblasti atomske fizike, litijum se vrlo često upotrebljava, jer je kao 6Li jedini među alkalnim metalima sa stabilnim fermionskim izotopom, zbog čega je pogodan za istraživanje efekata u ultrahladnim fermionskim kvantnim gasovima. Istovremeno, iskazuje veoma široku Fešbačovu rezonancu, koja omogućava da se dužina raspršenja između atoma podešava po želji, pri čemu se ne mora posebno precizno održavati magnetno polje zbog širine rezonance.

Baterije
[uredi | uredi izvor]U 2021. godini najveći deo litijuma se koristi za pravljenje litijum-jonskih baterija za električne automobile i mobilne uređaje.
Keramika i staklo
[uredi | uredi izvor]Litijum oksid se široko koristi kao fluks za preradu silicijum dioksida, smanjujući tačku topljenja i viskozitet materijala i dovodeći do glazura sa poboljšanim fizičkim svojstvima uključujući niske koeficijente toplotnog širenja. Širom sveta, ovo je jedna od najvećih upotreba litijumskih jedinjenja.[262][263] Za posuđe za rerne koriste se glazure koje sadrže litijum okside. Litijum karbonat (Li2CO3) se generalno koristi u ovom vidu primene, jer se pri zagrevanju pretvara u oksid.[264]
Elektrika i elektronika
[uredi | uredi izvor]Krajem 20. veka, litijum je postao važna komponenta elektrolita i elektroda baterija, zbog svog visokog elektrodnog potencijala. Zbog svoje niske atomske mase, on ima visok odnos punjenja i snage prema težini. Tipična litijum-jonska baterija može da generiše približno 3 volta po ćeliji, u poređenju sa 2,1 volta za olovnu kiselinu i 1,5 volta za cink-ugljenik. Litijum-jonske baterije, koje se mogu višestruko puniti i imaju visoku gustinu energije, razlikuju se od litijum metalnih baterija, koje su jednokratne (primarne) baterije sa litijumom ili njegovim jedinjenjima kao anodom.[265][266] Ostale punjive baterije koje koriste litijum uključuju litijum-jonsku polimernu bateriju, litijum-gvožđe-fosfatnu bateriju i nanožičnu bateriju.
Tokom godina mišljenja su se razlikovala o potencijalnom porastu. Jedna studija iz 2008. je zaključila da bi „realno ostvariva proizvodnja litijum karbonata bila dovoljna za samo mali deo budućih zahteva globalnog tržišta za PHEV i EV“, da će „potražnja iz sektora prenosive elektronike apsorbovati veći deo planiranog povećanja proizvodnje u narednoj deceniji“ , te da „masovna proizvodnja litijum karbonata nije ekološki podobna, da će naneti nepopravljivu ekološku štetu ekosistemima koje treba zaštititi i da je litijumsko jonski pogon nekompatibilan sa pojmom ’Zelenog automobila’“.[77]
Masti za podmazivanje
[uredi | uredi izvor]Treća najčešća upotreba litijuma je u mazivima. Litijum hidroksid je jaka baza, a kada se zagreje sa masti, proizvodi sapun, kao što je litijum stearat iz stearinske kiseline. Litijumski sapun ima sposobnost zgušnjavanja ulja i koristi se za proizvodnju mazivih masti za sve namene na visokim temperaturama.[30][267][268]
Pirotehnika
[uredi | uredi izvor]
Jedinjenja litijuma se koriste kao pirotehnička bojila i oksidanti u crvenim vatrometima i bakljama.[30][270]
Prečišćavanje vazduha
[uredi | uredi izvor]Litijum hlorid i litijum bromid su higroskopni i koriste se kao sredstva za sušenje gasnih tokova.[30] Litijum hidroksid i litijum peroksid su soli koje se najčešće koriste u zatvorenim prostorima, kao što su svemirske letelice i podmornice, za uklanjanje ugljen-dioksida i prečišćavanje vazduha. Litijum hidroksid apsorbuje ugljen-dioksid iz vazduha formirajući litijum karbonat, i preferira se u odnosu na druge alkalne hidrokside zbog svoje male težine.
Litijum peroksid (Li2O2) u prisustvu vlage ne samo da reaguje sa ugljen-dioksidom i formira litijum karbonat, već i oslobađa kiseonik.[271][272] Reakcija je sledeća:
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2
Neka od pomenutih jedinjenja, kao i litijum perhlorat, koriste se u kiseoničnim svećama koje snabdevaju podmornice kiseonikom. Ona takođe mogu uključivati male količine bora, magnezijuma, aluminijuma, silicijuma, titanijuma, mangana i gvožđa.[273]
Optika
[uredi | uredi izvor]Litijum fluorid, u obliku veštački formiranog kristala, je bistar i transparentan i često se koristi u specijalizovanoj optici za IR, UV i VUV (vakuumske UV) aplikacije. On ima jedan od najnižih indeksa prelamanja i najdalji opseg transmisije u dubokim UV zracima među uobičajenim materijala.[274] Fino usitnjeni prah litijum fluorida je korišćen za termoluminiscentnu dozimetriju zračenja (TLD): kada je takav uzorak izložen zračenju, on akumulira kristalne defekte koji se, kada se zagreju, rešavaju oslobađanjem plavičaste svetlosti čiji je intenzitet proporcionalan apsorbovanoj dozi, što omogućava da se ovo kvantifikuje.[275] Litijum fluorid se ponekad koristi u fokalnim sočivima teleskopa.[30][276]
Visoka nelinearnost litijum niobata takođe ga čini korisnim u aplikacijama nelinearne optike. Široko se koristi u telekomunikacionim proizvodima kao što su mobilni telefoni i optički modulatori, za komponente kao što su rezonantni kristali. Litijumske aplikacije se koriste u više od 60% mobilnih telefona.[277]
Organska i polimerna hemija
[uredi | uredi izvor]Organolitijumska jedinjenja se široko koriste u proizvodnji polimera i finih hemikalija. U industriji polimera, koja je dominantni potrošač ovih reagenasa, jedinjenja alkil litijuma su katalizatori/inicijatori[278] u anjonskoj polimerizaciji nefunkcionalizovanih olefina.[279][280][281] Za proizvodnju finih hemikalija, organolitijumova jedinjenja funkcionišu kao jake baze i kao reagensi za formiranje ugljenik-ugljenik veza. Organolitijumska jedinjenja se pripremaju od metalnog litijuma i alkil halida.[282]
Mnoga druga jedinjenja litijuma se koriste kao reagensi za pripremu organskih jedinjenja. Neka popularna jedinjenja uključuju litijum aluminijum hidrid (LiAlH4), litijum trietilborohidrid, n-butillitijum i tert-butillitijum.
Vojna primena
[uredi | uredi izvor]
Metalni litijum i njegovi kompleksni hidridi, kao što je litijum aluminijum hidrid (LiAlH4), koriste se kao visokoenergetski aditivi za raketna goriva.[59] LiAlH4 se može koristiti i sam kao čvrsto gorivo.[283]
Pogonski sistem sa hemijskom energijom (SCEPS) u torpedu Mark 50 koristi mali rezervoar sumpor heksafluorida, koji se raspršuje preko bloka čvrstog litijuma. Reakcija generiše toplotu, stvarajući paru koja pokreće torpedo u zatvorenom Rankinovom ciklusu.[284]
Litijum hidrid koji sadrži litijum-6 se koristi u termonuklearnom oružju, gde služi kao gorivo za fuzionu fazu bombe.[285]
Nuklearna primena
[uredi | uredi izvor]Litijum-6 je cenjen kao izvorni materijal za proizvodnju tricijuma i kao apsorber neutrona u nuklearnoj fuziji. Prirodni litijum sadrži oko 7,5% litijuma-6 iz kojeg su velike količine litijum-6 proizvedene separacijom izotopa za upotrebu u nuklearnom oružju.[286] Postoji interesovanje za upotrebu litijum-7 u rashladnim tečnostima nuklearnih reaktora.[287]

Litijum deuterid je bio preferentno fuziono gorivo u ranim verzijama hidrogenske bombe. Kada su bombardovani neutronima, 6Li i 7Li proizvode tricijum - ova reakcija, koja nije bila u potpunosti shvaćena kada su vodonične bombe prvi put testirane, bila je odgovorna za odbegli prinos nuklearnog testa Kasl Bravo. Tricijum se spaja sa deuterijumom u reakciji fuzije koju je relativno lako postići. Iako detalji ostaju tajni, litijum-6 deuterid očigledno još uvek igra ulogu u modernom nuklearnom oružju kao fuzioni materijal.[288]
Litijum fluorid, kada je visoko obogaćen izotopom litijum-7, predstavlja osnovni sastojak mešavine fluoridne soli LiF-BeF2 koja se koristi u nuklearnim reaktorima sa tečnim fluorom. Litijum fluorid je izuzetno hemijski stabilan i smeše LiF-BeF2 imaju niske tačke topljenja. Pored toga, 7Li, Be, i F su među retkim nuklidima sa dovoljno malim poprečnim presecima hvatanja termalnih neutrona da ne otruju reakcije fisije unutar reaktora nuklearne fisije.[note 4][289]
U konceptualizovanim (hipotetičkim) elektranama nuklearne fuzije, litijum će se koristiti za proizvodnju tricijuma u magnetno ograničenim reaktorima koristeći deuterijum i tricijum kao gorivo. Prirodni tricijum je izuzetno redak i mora se sintetički proizvoditi okružujući reagujuću plazmu 'prekrivačem' koji sadrži litijum, gde će neutroni iz reakcije deuterijum-tricijum u plazmi cepati litijum da bi proizveli više tricijuma:
- 6Li + n → 4He + 3H.
Litijum se takođe koristi kao izvor za alfa čestice, ili jezgra helijuma. Kada 7Li bombarduju ubrzani protoni, formira se 8Be, koji skoro odmah podleže fisiji da bi se formirale dve alfa čestice. Ovaj podvig, u to vreme nazvan „cepanje atoma“, bio je prva nuklearna reakcija koju je u potpunosti napravio čovek. Ostvarili su ga Kokroft i Volton 1932. godine.[290][291] Ubrizgavanje litijumovog praha se koristi u fuzionim reaktorima za manipulaciju interakcija plazme i materijala, i disipaciju energije u vrućoj termonuklearnoj fuzionoj granici plazme.[292][293]
U 2013. godini, SAD Služba za odgovornost izjavila je da nedostatak litijuma-7 koji je kritičan za rad 65 od 100 američkih nuklearnih reaktora „donekle dovodi njihovu sposobnost da nastave da obezbeđuju električnu energiju u rizik“. Kasl Bravo je prvi put koristio litijum-7 u Šrimpu, svom prvom uređaju, koji je težio samo 10 tona, i stvorio je ogromnu nuklearnu atmosfersku kontaminaciju atola Bikini. Ovo je možda razlog za nazadovanje američke nuklearne infrastrukture.[294] Oprema potrebna za odvajanje litijuma-6 od litijuma-7 uglavnom je ostatak Hladnog rata. SAD su zatvorile većinu ovih postrojenja 1963. godine, kada su imale ogroman višak izdvojenog litijuma, koji se uglavnom trošio tokom dvadesetog veka. U izveštaju se navodi da će biti potrebno pet godina i 10 do 12 miliona dolara da se ponovo uspostave kapaciteti razdvajanja litijum-6 od litijuma-7.[295]
Reaktori koji koriste litijum-7 zagrevaju vodu pod visokim pritiskom i prenose toplotu kroz izmenjivače toplote koji su skloni koroziji. Reaktori koriste litijum da bi se suprotstavili korozivnim efektima borne kiseline, koja se dodaje u vodu da apsorbuje višak neutrona.[295]
Medicina
[uredi | uredi izvor]Litijum je koristan u lečenju bipolarnog poremećaja.[296] Litijumove soli takođe mogu biti od pomoći za srodne dijagnoze, kao što su šizoafektivni poremećaj i ciklična velika depresija. Aktivni deo ovih soli je litijumski jon Li+.[296] Litijum može povećati rizik od razvoja Ebsteinove srčane anomalije kod odojčadi rođenih od žena koje uzimaju litijum tokom prvog trimestra trudnoće.[297]
Već od 1850. litijum se počeo koristiti u medicini zapadnoevropskih zemalja kao sredstvo protiv gihta. Međutim, nije se pokazao delotvoran. I drugi vidovi upotrebe litijumskih soli u medicini su takođe ostali bezuspešni, između ostalih i kao sredstvo protiv infektivnih bolesti.
Tek 1949. australijski fizijatar Džon Kejd opisao je moguću oblast upotrebe litijumovih soli. On je zamorcima ubrizgavao različita hemijska jedinjenja, između ostalih i soli litijuma, od čega su oni mnogo slabije reagovali na spoljne nadražaje, te su bili mnogo mirniji ali ne i pospani.[298] Tek nakon što je isto isprobao i na sebi između 1952. i 1954. Kejd je podržao upotrebu litijum karbonata kao leka u terapiji depresivnih, šizofrenih i maničnih pacijenata, a nakon sprovedene opsežne studije na psihijatrijskoj bolnici u Riskovu (Danska).[299] Time su postavljeni budući temelji današnje terapije litijumom.
Preventivne mere
[uredi | uredi izvor]| Opasnosti | |
|---|---|
| GHS piktogrami |  
|
| GHS signalne reči | Opasnost |
| H260, H314 | |
| P223, P231+232, P280, P305+351+338, P370+378, P422[300] | |
| NFPA 704 | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Metalni litijum je korozivan i neophodno je posebno rukovanje kako bi se izbegao kontakt sa kožom. Udisanje litijumove prašine ili jedinjenja litijuma (koja su često alkalna) u početku iritira nos i grlo, dok veća izloženost može izazvati nakupljanje tečnosti u plućima, što dovodi do plućnog edema. Sam metal predstavlja opasnost za rukovanje, jer kontakt sa vlagom proizvodi kaustični litijum hidroksid. Litijum se bezbedno skladišti u nereaktivnim jedinjenjima kao što je nafta.[302]
Vidi još
[uredi | uredi izvor]- Kosmološki problem litijuma
- Dilitijum
- Halo jezgro
- Izotopi litijuma
- Spisak zemalja prema proizvodnji litijuma
- Litijska voda
- Litijum-vazdušna baterija
- Sagorevanje litijuma
- Jedinjenja litijuma (kategorija)
- Litijum-jonska baterija
- Eksperiment sa litijumskim tokamakom
Napomene
[uredi | uredi izvor]- ^ a b Appendixes Arhivirano 6 novembar 2011 na sajtu Wayback Machine. By USGS definitions, the reserve base "may encompass those parts of the resources that have a reasonable potential for becoming economically available within planning horizons beyond those that assume proven technology and current economics. The reserve base includes those resources that are currently economic (reserves), marginally economic (marginal reserves), and some of those that are currently subeconomic (subeconomic resources)."
- ^ In 2013
- ^ Excludes U.S. production
- ^ Berilijum i fluor se javljaju samo kao jedan izotop, 9Be i 19F respektivno. Ova dva, zajedno sa 7Li, kao i 2H, 11B, 15N, 209Bi, i stabilni izotopi C, i O, jedini su nuklidi sa dovoljno malim poprečnim presecima hvatanja toplotnih neutrona osim aktinida da služe kao glavni sastojci rastopljene soli oplemenjivačkog reaktorskog goriva.
Reference
[uredi | uredi izvor]- ^ a b dtv-Atlas Chemie. 1 (9 izd.). dtv. 2000. ISBN 9783423032179.
- ^ a b Binder, Harry H. der chemischen Elemente (1999). Lexikon. Stuttgart: S. Hirzel Verlag. ISBN 978-3-7776-0736-8.
- ^ Wieser, Michael E.; Coplen, Tyler B. (2010). „Atomic weights of the elements 2009 (IUPAC Technical Report)”. Pure and Applied Chemistry. 83 (2): 359—396. S2CID 95898322. doi:10.1351/PAC-REP-10-09-14.
- ^ Zhang, Yiming; Julian R. G. Evans; Yang, Shoufeng (2011). „Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks” (PDF). Journal of Chemical & Engineering Data. 56 (2): 328—337. doi:10.1021/je1011086.
- ^ Greenwood, N. N.; Earnshaw, A. (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 97. ISBN 978-3-527-26169-7.
- ^ a b "„Lithium”. The Gale Encyclopedia of Science. Gale. 2008. ISBN 978-1578516803.
- ^ Bergmann, Ludwig; Schaefer, Clemens; Kassing, Rainer (2005). Lehrbuch der Experimentalphysik, Band 6: Festkörper (2 izd.). Walter de Gruyter. str. 361. ISBN 978-3-11-017485-4.
- ^ Robert C. Weast, ur. (1990). CRC Handbook of Chemistry and Physics. Boca Raton: CRC (Chemical Rubber Publishing Company). str. E—129 do E—145. ISBN 978-0-8493-0470-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 978-0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Spellman, F. R (2023). The Science of Lithium.. CRC Press.
- ^ a b Numerical data from: Lodders, Katharina (10. 7. 2003). „Solar System Abundances and Condensation Temperatures of the Elements” (PDF). The Astrophysical Journal. The American Astronomical Society. 591 (2): 1220—1247. Bibcode:2003ApJ...591.1220L. S2CID 42498829. doi:10.1086/375492. Arhivirano iz originala (PDF) 7. 11. 2015. g. Pristupljeno 1. 9. 2015. Graphed at File:SolarSystemAbundances.jpg
- ^ Nuclear Weapon Design. Federation of American Scientists (21 October 1998). fas.org
- ^ a b Schubert, K. (1974). „Ein Modell für die Kristallstrukturen der chemischen Elemente”. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 30: 193—204. doi:10.1107/S0567740874002469..
- ^ a b v g d đ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ^ Huang, Chuanfu; Kresin, Vitaly V. (jun 2016). „Note: Contamination-free loading of lithium metal into a nozzle source”. Review of Scientific Instruments (na jeziku: engleski). 87 (6): 066105. Bibcode:2016RScI...87f6105H. ISSN 0034-6748. PMID 27370506. doi:10.1063/1.4953918.
- ^ Addison, C. C. (1984). The chemistry of the liquid alkali metals. Chichester [West Sussex]: Wiley. ISBN 978-0-471-90508-0. OCLC 10751785.
- ^ a b „PubChem Element Summary for AtomicNumber 3, Lithium”. National Center for Biotechnology Information. 2021. Arhivirano iz originala 10. 9. 2021. g. Pristupljeno 10. 9. 2021.
- ^ a b Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (91–100 izd.). Berlin: de Gruyter. str. 928—931. ISBN 978-3-11-007511-3.
- ^ a b v g d Parkes, G. D. & Fil, D. 1973. Melorova moderna neorganska hemija. Naučna knjiga. Beograd.
- ^ „It's Elemental - The Element Lithium”. education.jlab.org. Arhivirano iz originala 5. 10. 2019. g. Pristupljeno 9. 10. 2019.
- ^ „Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties”. Encyclopedia.airliquide.com. Arhivirano iz originala 21. 7. 2011. g. Pristupljeno 29. 9. 2010.
- ^ Rondović, D. 1991. Kvalitativna hemijska analiza. Naučna knjiga: Beograd.
- ^ Litijum na stranici webelements.com, fizičke osobine.
- ^ „Coefficients of Linear Expansion”. Engineering Toolbox. Arhivirano iz originala 30. 11. 2012. g. Pristupljeno 9. 1. 2011.
- ^ Tuoriniemi, Juha; Juntunen-Nurmilaukas, Kirsi; Uusvuori, Johanna; Pentti, Elias; Salmela, Anssi; Sebedash, Alexander (2007). „Superconductivity in lithium below 0.4 millikelvin at ambient pressure”. Nature. 447 (7141): 187—9. Bibcode:2007Natur.447..187T. PMID 17495921. S2CID 4430500. doi:10.1038/nature05820. Arhivirano iz originala 25. 6. 2019. g. Pristupljeno 20. 4. 2018.
- ^ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). „Superconductivity in dense lithium”. Science. 298 (5596): 1213—5. Bibcode:2002Sci...298.1213S. PMID 12386338. S2CID 21030510. doi:10.1126/science.1078535.
- ^ Overhauser, A. W. (1984). „Crystal Structure of Lithium at 4.2 K”. Physical Review Letters. 53 (1): 64—65. Bibcode:1984PhRvL..53...64O. doi:10.1103/PhysRevLett.53.64.
- ^ Schwarz, Ulrich (2004). „Metallic high-pressure modifications of main group elements”. Zeitschrift für Kristallographie. 219 (6–2004): 376—390. Bibcode:2004ZK....219..376S. S2CID 56006683. doi:10.1524/zkri.219.6.376.34637.
- ^ a b v g d đ e Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (81st izd.). CRC press. ISBN 978-0-8493-0481-1.
- ^ SPECIFIC HEAT OF SOLIDS. bradley.edu
- ^ Malissa, H. (1959). „Die Trennung des Lithiums vom Magnesium in Lithium-Magnesium-Legierungen”. Fresenius' Zeitschrift für Analytische Chemie. 171 (4): 281—282. S2CID 94700911. doi:10.1007/BF00555410..
- ^ a b Binnewies, M. (2004). Allgemeine und Anorganische Chemie (1 izd.). Spektrum Verlag. str. 241. ISBN 978-3827402080.
- ^ Winter, Mark J. Bonding (1994). Chemical. Oxford University Press. ISBN 978-0-19-855694-7.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). „The NUBASE2020 evaluation of nuclear properties” (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ The Nubase evaluation of nuclear and decay properties Arhivirano na sajtu Wayback Machine (24. jul 2013) (PDF, engl.).
- ^ File:Binding energy curve - common isotopes.svg shows binding energies of stable nuclides graphically; the source of the data-set is given in the figure background.
- ^ Sonzogni, Alejandro. „Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Arhivirano iz originala 23. 7. 2007. g. Pristupljeno 6. 6. 2008.
- ^ Various (2002). Lide, David R., ur. Handbook of Chemistry & Physics (88th izd.). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. Arhivirano iz originala 24. 7. 2017. g. Pristupljeno 2008-05-23.
- ^ Asplund, M.; et al. (2006). „Lithium Isotopic Abundances in Metal-poor Halo Stars”. The Astrophysical Journal. 644 (1): 229—259. Bibcode:2006ApJ...644..229A. S2CID 394822. arXiv:astro-ph/0510636
 . doi:10.1086/503538.
. doi:10.1086/503538.
- ^ Denissenkov, P. A.; Weiss, A. (2000). „Episodic lithium production by extra-mixing in red giants”. Astronomy and Astrophysics. 358: L49—L52. Bibcode:2000A&A...358L..49D. arXiv:astro-ph/0005356
 .
.
- ^ Chaussidon, M.; Robert, F.; McKeegan, K. D. (2006). „Li and B isotopic variations in an Allende CAI: Evidence for the in situ decay of short-lived 10Be and for the possible presence of the short−lived nuclide 7Be in the early solar system” (PDF). Geochimica et Cosmochimica Acta. 70 (1): 224—245. Bibcode:2006GeCoA..70..224C. doi:10.1016/j.gca.2005.08.016. Arhivirano iz originala (PDF) 18. 7. 2010. g.
- ^ Seitz, H. M.; Brey, G. P.; Lahaye, Y.; Durali, S.; Weyer, S. (2004). „Lithium isotopic signatures of peridotite xenoliths and isotopic fractionation at high temperature between olivine and pyroxenes”. Chemical Geology. 212 (1–2): 163—177. Bibcode:2004ChGeo.212..163S. doi:10.1016/j.chemgeo.2004.08.009.
- ^ Duarte, F. J (2009). Tunable Laser Applications. CRC Press. str. 330. ISBN 978-1-4200-6009-6.
- ^ a b Coplen, T. B.; Bohlke, J. K.; De Bievre, P.; Ding, T.; Holden, N. E.; Hopple, J. A.; Krouse, H. R.; Lamberty, A.; Peiser, H. S.; et al. (2002). „Isotope-abundance variations of selected elements (IUPAC Technical Report)”. Pure and Applied Chemistry. 74 (10): 1987. doi:10.1351/pac200274101987
 .
.
- ^ Truscott, Andrew G.; Strecker, Kevin E.; McAlexander, William I.; Partridge, Guthrie B.; Hulet, Randall G. (2001-03-30). „Observation of Fermi Pressure in a Gas of Trapped Atoms”. Science (na jeziku: engleski). 291 (5513): 2570—2572. Bibcode:2001Sci...291.2570T. ISSN 0036-8075. PMID 11283362. S2CID 31126288. doi:10.1126/science.1059318.
- ^ ABC oružje.
- ^ Bauer, Richard (1985). „Lithium – wie es nicht im Lexikon steht”. Chemie in unserer Zeit. 19 (5): 167—173. doi:10.1002/ciuz.19850190505.
- ^ Volkmer, Martin (2007). Kernenergie Basiswissen (PDF). Inforum. str. 39. ISBN 978-3-926956-44-6. Arhivirano iz originala (PDF) 17. 6. 2012. g. Pristupljeno 1. 4. 2019.
- ^ Bradley, C. C.; Sackett, C. A.; Tollett, J. J.; Hulet, R. G. (1995). „Evidence of Bose-Einstein Condensation in an Atomic Gas with Attractive Interactions”. Physical Review Letters. 75 (9): 1687—1690. PMID 10060366. doi:10.1103/PhysRevLett.75.1687. hdl:1911/79442.
- ^ Fermionic Studies in 6Lithium
- ^ Ling, A. V. (2006). Focus on Boson Research. Nova Publishers. str. 184. ISBN 9781594545207.
- ^ Jochim, S.; Bartenstein, M.; Altmeyer, A.; Hendl, G.; Riedl, S.; Chin, C.; Hecker Denschlag, J.; Grimm, R. (2003). „Bose-Einstein Condensation of Molecules”. Science. 302 (5653): 2101—2103. PMID 14615548. S2CID 13041446. doi:10.1126/science.1093280.
- ^ Dodaci; Po definicijama USGS, bazne rezerve obuhvataju one dijelove resursa koji imaju dovoljan potencijal da postanu ekonomski dostupne u okviru planiranih nivoa a izvan onih koji pretpostavljaju dokazane tehnologije i trenutne ekonomije. Bazna rezerva uključuje one resurse koji su trenutno ekonomični (rezerve), granično ekonomični (granične rezerve) i neke od onih koji su trenutno neekonomični (subekonomski resursi).
- ^ „Element Abundances” (PDF). Arhivirano iz originala (PDF) 1. 9. 2006. g. Pristupljeno 17. 11. 2009.
- ^ Boesgaard, A. M.; Steigman, G. (1985). „Big bang nucleosynthesis – Theories and observations”. Annual Review of Astronomy and Astrophysics. Palo Alto, CA. 23: 319—378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- ^ Woo, Marcus (21. 2. 2017). „The Cosmic Explosions That Made the Universe”. earth. BBC. Arhivirano iz originala 21. 2. 2017. g. Pristupljeno 21. 2. 2017. „A mysterious cosmic factory is producing lithium. Scientists are now getting closer at finding out where it comes from”
- ^ Cain, Fraser (16. 8. 2006). „Why Old Stars Seem to Lack Lithium”. Arhivirano iz originala 4. 6. 2016. g.
- ^ a b v g d đ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 978-0-19-850341-5.
- ^ „First Detection of Lithium from an Exploding Star”. Arhivirano iz originala 1. 8. 2015. g. Pristupljeno 29. 7. 2015.
- ^ Cain, Fraser. „Brown Dwarf”. Universe Today. Arhivirano iz originala 25. 2. 2011. g. Pristupljeno 17. 11. 2009.
- ^ Reid, Neill (10. 3. 2002). „L Dwarf Classification”. Arhivirano iz originala 21. 5. 2013. g. Pristupljeno 6. 3. 2013.
- ^ Arizona State University (1. 6. 2020). „Class of stellar explosions found to be galactic producers of lithium”. EurekAlert!. Arhivirano iz originala 3. 6. 2020. g. Pristupljeno 2. 6. 2020.
- ^ Starrfield, Sumner; et al. (27. 5. 2020). „Carbon–Oxygen Classical Novae Are Galactic 7Li Producers as well as Potential Supernova Ia Progenitors”. The Astrophysical Journal. 895 (1): 70. Bibcode:2020ApJ...895...70S. S2CID 203610207. arXiv:1910.00575
 . doi:10.3847/1538-4357/ab8d23
. doi:10.3847/1538-4357/ab8d23  .
.
- ^ „Lithium Occurrence”. Institute of Ocean Energy, Saga University, Japan. Arhivirano iz originala 2. 5. 2009. g. Pristupljeno 13. 3. 2009.
- ^ a b v g „Some Facts about Lithium”. ENC Labs. Arhivirano iz originala 10. 7. 2011. g. Pristupljeno 15. 10. 2010.
- ^ Schwochau, Klaus (1984). „Extraction of metals from sea water”. Inorganic Chemistry. Topics in Current Chemistry. 124. Springer Berlin Heidelberg. str. 91—133. ISBN 978-3-540-13534-0. S2CID 93866412. doi:10.1007/3-540-13534-0_3.
- ^ a b v g Kamienski, Conrad W.; McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R. (2004). „Lithium and lithium compounds”. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.1209200811011309.a01.pub2.
- ^ „lithium”. Britannica encyclopedia. Arhivirano iz originala 5. 8. 2020. g. Pristupljeno 4. 8. 2020.
- ^ Atkins, Peter (2010). Shriver & Atkins' Inorganic Chemistry (5th izd.). New York: W. H. Freeman and Company. str. 296. ISBN 978-0-19-923617-6.
- ^ „Mindat.org - Mines, Minerals and More”. www.mindat.org. Arhivirano iz originala 22. 4. 2011. g. Pristupljeno 4. 8. 2019.
- ^ Moores, S. (jun 2007). „Between a rock and a salt lake”. Industrial Minerals. 477: 58.
- ^ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985).
- ^ Garrett, Donald (2004). Handbook of Lithium and Natural Calcium., Academic Press, cited in The Trouble with Lithium 2 Arhivirano 14 jul 2011 na sajtu Wayback Machine, Meridian International Research (2008)
- ^ a b v g d „Mineral Commodity Summaries 2024” (PDF). U.S. Geological Survey. 29. 1. 2024. Arhivirano (PDF) iz originala 21. 3. 2024. g. Pristupljeno 21. 3. 2024.
- ^ a b v g d Lithium Statistics and Information, U.S. Geological Survey, 2018, Arhivirano iz originala 3. 3. 2016. g., Pristupljeno 25. 7. 2002
- ^ a b „The Trouble with Lithium 2” (PDF). Meridian International Research. 2008. Arhivirano iz originala (PDF) 14. 7. 2011. g. Pristupljeno 29. 9. 2010.
- ^ Czech Geological Survey (oktobar 2015). Mineral Commodity Summaries of the Czech Republic 2015 (PDF). Prague: Czech Geological Survey. str. 373. ISBN 978-80-7075-904-2. Arhivirano (PDF) iz originala 6. 1. 2017. g.
- ^ „Ore Reserve grows its Finland lithium deposit by 50%”. 2019. Arhivirano iz originala 10. 12. 2019. g. Pristupljeno 10. 12. 2019.
- ^ Risen, James (13. 6. 2010). „U.S. Identifies Vast Riches of Minerals in Afghanistan”. The New York Times. Arhivirano iz originala 17. 6. 2010. g. Pristupljeno 13. 6. 2010.
- ^ Page, Jeremy; Evans, Michael (15. 6. 2010). „Taleban zones mineral riches may rival Saudi Arabia says Pentagon”. The Times. London. Arhivirano iz originala 14. 5. 2011. g.
- ^ Hosp, Gerald (30. 8. 2021). „Afghanistan: die konfliktreichen Bodenschätze”. Neue Zürcher Zeitung (na jeziku: nemački). Arhivirano iz originala 8. 9. 2021. g. Pristupljeno 2021-09-01.
- ^ Bliss, Dominic (28. 5. 2021). „National Geographic”. In Cornwall, ruinous tin and copper mines are yielding battery-grade lithium. Here's what that means. Arhivirano iz originala 13. 6. 2021. g. Pristupljeno 13. 6. 2021.
- ^ „Cornwall lithium deposits 'globally significant'”. BBC. 17. 9. 2020. Arhivirano iz originala 13. 6. 2021. g. Pristupljeno 13. 6. 2021.
- ^ Chassard-Bouchaud, C.; Galle, P.; Escaig, F.; Miyawaki, M. (1984). „Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission”. Comptes Rendus de l'Académie des Sciences, Série III. 299 (18): 719—24. PMID 6440674.
- ^ a b v Emsley, John (25. 8. 2011). Nature's Building Blocks: An A-Z Guide to the Elements. OUP Oxford. str. 290—298. ISBN 978-0-19-960563-7. Arhivirano iz originala 26. 8. 2023. g. Pristupljeno 17. 6. 2016.
- ^ a b v g d đ Bach, Ricardo O.; Gallicchio, Vincent S., ur. (1990). Lithium and Cell Physiology. New York, NY: Springer New York. str. 25—46. ISBN 978-1-4612-7967-9. S2CID 44374126. doi:10.1007/978-1-4612-3324-4.
- ^ a b v g d Jakobsson, Eric; Argüello-Miranda, Orlando; Chiu, See-Wing; Fazal, Zeeshan; Kruczek, James; Nunez-Corrales, Santiago; Pandit, Sagar; Pritchet, Laura (2017-11-10). „Towards a Unified Understanding of Lithium Action in Basic Biology and its Significance for Applied Biology”. The Journal of Membrane Biology. Springer Science and Business Media LLC. 250 (6): 587—604. ISSN 0022-2631. PMC 5696506
 . PMID 29127487. doi:10.1007/s00232-017-9998-2.
. PMID 29127487. doi:10.1007/s00232-017-9998-2.
- ^ a b Alda, M (17. 2. 2015). „Lithium in the treatment of bipolar disorder: pharmacology and pharmacogenetics”. Molecular Psychiatry. Nature Publishing Group. 20 (6): 661—670. ISSN 1359-4184. PMC 5125816
 . PMID 25687772. doi:10.1038/mp.2015.4.
. PMID 25687772. doi:10.1038/mp.2015.4.
- ^ Martinsson, L; Wei, Y; Xu, D; Melas, P A; Mathé, A A; Schalling, M; Lavebratt, C; Backlund, L (2013). „Long-term lithium treatment in bipolar disorder is associated with longer leukocyte telomeres”. Translational Psychiatry. Nature Publishing Group. 3 (5): e261—. ISSN 2158-3188. PMC 3669924
 . PMID 23695236. doi:10.1038/tp.2013.37.
. PMID 23695236. doi:10.1038/tp.2013.37.
- ^ D'Andraba (1800). „Des caractères et des propriétés de plusieurs nouveaux minérauxde Suède et de Norwège, avec quelques observations chimiques faites sur ces substances”. Journal de Physique, de Chimie, d'Histoire Naturelle, et des Arts. 51: 239. Arhivirano iz originala 13. 7. 2015. g.
- ^ „Petalite Mineral Information”. Mindat.org. Arhivirano iz originala 16. 2. 2009. g. Pristupljeno 10. 8. 2009.
- ^ a b v g d đ e „Lithium:Historical information”. Arhivirano iz originala 16. 10. 2009. g. Pristupljeno 10. 8. 2009.
- ^ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. str. 124. ISBN 978-0-7661-3872-8.
- ^ Berzelius (1817). „Ein neues mineralisches Alkali und ein neues Metall” [A new mineral alkali and a new metal]. Journal für Chemie und Physik. 21: 44—48. Arhivirano iz originala 3. 12. 2016. g. From p. 45: "Herr August Arfwedson, ein junger sehr verdienstvoller Chemiker, der seit einem Jahre in meinem Laboratorie arbeitet, fand bei einer Analyse des Petalits von Uto's Eisengrube, einen alkalischen Bestandtheil, … Wir haben es Lithion genannt, um dadurch auf seine erste Entdeckung im Mineralreich anzuspielen, da die beiden anderen erst in der organischen Natur entdeckt wurden. Sein Radical wird dann Lithium genannt werden." (Mr. August Arfwedson, a young, very meritorious chemist, who has worked in my laboratory for a year, found during an analysis of petalite from Uto's iron mine, an alkaline component … We've named it lithion, in order to allude thereby to its first discovery in the mineral realm, since the two others were first discovered in organic nature. Its radical will then be named "lithium".)
- ^ „Johan August Arfwedson”. Periodic Table Live!. Arhivirano iz originala 7. 10. 2010. g. Pristupljeno 10. 8. 2009.
- ^ „Johan Arfwedson”. Arhivirano iz originala 5. 6. 2008. g. Pristupljeno 10. 8. 2009.
- ^ a b v van der Krogt, Peter. „Lithium”. Elementymology & Elements Multidict. Arhivirano iz originala 16. 6. 2011. g. Pristupljeno 5. 10. 2010.
- ^ See:
- Arfwedson, Aug. (1818) „Afhandlingar i fysik, kemi och mineralogi”. 1818. Arhivirano iz originala 25. 11. 2017. g. Pristupljeno 27. 7. 2017., Afhandlingar i Fysik, Kemi och Mineralogi, 6 : 145–172. (in Swedish)
- Arfwedson, Aug. (1818) "Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali" Arhivirano 13 mart 2021 na sajtu Wayback Machine (Investigation of some minerals occurring at the iron mines of Utö and of a new refractory alkali found therein), Journal für Chemie und Physik, 22 (1) : 93–117. (in German)
- ^ Clark, Jim (2005). „Compounds of the Group 1 Elements”. Arhivirano iz originala 11. 3. 2009. g. Pristupljeno 10. 8. 2009.
- ^ Figurowski, N. (1981). Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Köln: Aulis-Verlag Deubner. str. 135. ISBN 978-3-7614-0561-1.
- ^ Gmelin, C. G. (1818). „Von dem Lithon” [On lithium]. Annalen der Physik. 59 (7): 238—241. Bibcode:1818AnP....59..229G. doi:10.1002/andp.18180590702. Arhivirano iz originala 9. 11. 2015. g. „p. 238 Es löste sich in diesem ein Salz auf, das an der Luft zerfloss, und nach Art der Strontiansalze den Alkohol mit einer purpurrothen Flamme brennen machte. (There dissolved in this [solvent; namely, absolute alcohol] a salt that deliquesced in air, and in the manner of strontium salts, caused the alcohol to burn with a purple-red flame.)”
- ^ a b Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. str. 287–300. ISBN 978-3-527-30666-4.
- ^ Brande, William Thomas (1821). A Manual of Chemistry., 2nd ed. London, England: John Murray, vol. 2, Brande, William Thomas (1821). „A manual of chemistry”. Arhivirano iz originala 19. 1. 2023. g. Pristupljeno 13. 8. 2015.
- ^ „The Quarterly journal of science and the arts”. The Quarterly Journal of Science and the Arts. Royal Institution of Great Britain. 5: 338. 1818. Arhivirano iz originala 13. 3. 2021. g. Pristupljeno 5. 10. 2010.
- ^ „Timeline science and engineering”. DiracDelta Science & Engineering Encyclopedia. Arhivirano iz originala 5. 12. 2008. g. Pristupljeno 18. 9. 2008.
- ^ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. str. 191. Pristupljeno 8. 10. 2010.
- ^ Bunsen, R. (1855). „Darstellung des Lithiums” [Preparation of lithium]. Annalen der Chemie und Pharmacie. 94: 107—111. doi:10.1002/jlac.18550940112. Arhivirano iz originala 6. 11. 2018. g. Pristupljeno 13. 8. 2015.
- ^ Green, Thomas (11. 6. 2006). „Analysis of the Element Lithium”. echeat. Arhivirano iz originala 21. 4. 2012. g.
- ^ Garrett, Donald E. (5. 4. 2004). Handbook of Lithium and Natural Calcium Chloride. Elsevier. str. 99. ISBN 978-0-08-047290-4. Arhivirano iz originala 3. 12. 2016. g.
- ^ Elschenbroich, C. (2009). Organometallchemie (6 izd.). Leipzig: Teubner B.G. Gmbh. str. 16. ISBN 9783835192232.
- ^ a b v Kogel, Jessica Elzea (2006). „Lithium”. Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. str. 599. ISBN 978-0-87335-233-8. Arhivirano iz originala 7. 11. 2020. g. Pristupljeno 6. 11. 2020.
- ^ United States Geological Survey: Minerals Yearbook 2007: Lithium. (PDF), 2007.
- ^ Shorter, Edward (jun 2009). „The history of lithium therapy”. Bipolar Disorders. 11 (Suppl 2): 4—9. ISSN 1398-5647. PMC 3712976
 . PMID 19538681. doi:10.1111/j.1399-5618.2009.00706.x.
. PMID 19538681. doi:10.1111/j.1399-5618.2009.00706.x.
- ^ a b Ober, Joyce A. (1994). „Commodity Report 1994: Lithium” (PDF). United States Geological Survey. Arhivirano (PDF) iz originala 9. 6. 2010. g. Pristupljeno 3. 11. 2010.
- ^ Deberitz, Jürgen; Boche, Gernot (2003). „Lithium und seine Verbindungen - Industrielle, medizinische und wissenschaftliche Bedeutung”. Chemie in unserer Zeit. 37 (4): 258—266. doi:10.1002/ciuz.200300264.
- ^ Bauer, Richard (1985). „Lithium - wie es nicht im Lehrbuch steht”. Chemie in unserer Zeit. 19 (5): 167—173. doi:10.1002/ciuz.19850190505.
- ^ Ober, Joyce A. (1994). „Minerals Yearbook 2007: Lithium” (PDF). United States Geological Survey. Arhivirano (PDF) iz originala 17. 7. 2010. g. Pristupljeno 3. 11. 2010.
- ^ McKetta, John J. (18. 7. 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Arhivirano iz originala 28. 5. 2013. g.
- ^ Overland, Indra (2019-03-01). „The geopolitics of renewable energy: Debunking four emerging myths” (PDF). Energy Research & Social Science. 49: 36—40. Bibcode:2019ERSS...49...36O. ISSN 2214-6296. doi:10.1016/j.erss.2018.10.018
 . Arhivirano (PDF) iz originala 13. 3. 2021. g. Pristupljeno 25. 8. 2019.
. Arhivirano (PDF) iz originala 13. 3. 2021. g. Pristupljeno 25. 8. 2019.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. str. 47. ISBN 978-0-313-33438-2. Arhivirano iz originala 4. 8. 2016. g.
- ^ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1. 1. 1994). „Geochemistry international”. Google Books. 31 (1–4): 115. Arhivirano iz originala 4. 6. 2016. g.
- ^ a b v g Greenwood, Norman N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon. str. 97—99. ISBN 0-08-022057-6. doi:10.1002/crat.2170200510.
- ^ Beckford, Floyd. „University of Lyon course online (powerpoint) slideshow”. Arhivirano iz originala 4. 11. 2005. g. Pristupljeno 27. 7. 2008. „definitions:Slides 8–10 (Chapter 14)”
- ^ Sevov, S.C., Zintl Phases in Intermetallic Compounds, Principles and Practice: Progress, Westbrook, J.H.; *Freisher, R.L.: Eds.; John Wiley & Sons. Ltd., Chichester, England, 2002, pp. 113–132 Slavi Chapter
- ^ Zintl, E; Goubeau, J; Dullenkopf, W (1931). „Metals and alloys. I. Salt-like compounds and intermetallic phases of sodium in liquid ammonia.”. Z. Phys. Chem. A (154): 1—46.
- ^ Diehl, Lothar; Khodadadeh, Keyumarss; Kummer, Dieter; Strähle, Joachim (oktobar 1976). „Anorganische Polyederverbindungen, III. Zintl's "Polyanionige Salze"︁: Darstellung und Eigenschaften der kristallinen Verbindungen [Na4·7 en]Sn9, [Na4·5 en]Ge9 und [Na3·4 en]Sb7 und ihrer Lösungen Die Kristallstruktur von [Na4·7 en]Sn9”. Anorganische Chemie. 109 (10): 3404—3418. doi:10.1002/cber.19761091018 — preko Chemistry Europe.
- ^ Sapse, Anne-Marie; von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. str. 3—40. ISBN 978-0-471-54930-7. Arhivirano iz originala 31. 7. 2016. g.
- ^ Nichols, Michael A.; Williard, Paul G. (1993-02-01). „Solid-state structures of n-butyllithium-TMEDA, -THF, and -DME complexes”. Journal of the American Chemical Society. 115 (4): 1568—1572. ISSN 0002-7863. doi:10.1021/ja00057a050.
- ^ C., Mehrotra, R. (2009). Organometallic chemistry: a unified approach. [Place of publication not identified]: New Age International Pvt. ISBN 978-81-224-1258-1. OCLC 946063142.
- ^ a b v g d đ e ž z Stey, Thomas; Stalke, Dietmar (2009). „Lead structures in lithium organic chemistry”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0298.
- ^ a b v g d đ e ž z i Reich, Hans J. (2013). „Role of Organolithium Aggregates and Mixed Aggregates in Organolithium Mechanisms”. Chemical Reviews. 113 (9): 7130—7178. PMID 23941648. doi:10.1021/cr400187u.
- ^ a b v g d đ e ž z i Strohmann, C; et al. (2009). „Structure Formation Principles and Reactivity of Organolithium Compounds.” (PDF). Chem. Eur. J. 15 (14): 3320—3334. PMID 19260001. doi:10.1002/chem.200900041.
- ^ Zabicky, Jacob (2009). „Analytical aspects of organolithium compounds”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0304.
- ^ a b Jemmis, E.D.; Gopakumar, G. (2009). „Theoretical studies in organolithium chemistry”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0297.
- ^ a b Streiwieser, A. (2009). „Perspectives on Computational Organic Chemistry”. J. Org. Chem. 74 (12): 4433—4446. PMC 2728082
 . PMID 19518150. doi:10.1021/jo900497s.
. PMID 19518150. doi:10.1021/jo900497s.
- ^ a b Bickelhaupt, F. M.; et al. (2006). „Covalency in Highly Polar Bonds. Structure and Bonding of Methylalkalimetal Oligomers (CH3M)n (M = Li−Rb; n = 1, 4)”. J. Chem. Theory Comput. 2 (4): 965—980. PMID 26633056. doi:10.1021/ct050333s.
- ^ Weiss, Erwin (novembar 1993). „Structures of Organo Alkali Metal Complexes and Related Compounds”. Angewandte Chemie International Edition in English (na jeziku: engleski). 32 (11): 1501—1523. ISSN 0570-0833. doi:10.1002/anie.199315013.
- ^ Fraenkel, G.; Qiu, Fayang (1996). „Observation of a Partially Delocalized Allylic Lithium and the Dynamics of Its 1,3 Lithium Sigmatropic Shift”. J. Am. Chem. Soc. 118 (24): 5828—5829. doi:10.1021/ja960440j.
- ^ Fraenkel. G; et al. (1995). „The carbon-lithium bond in monomeric arllithium: Dynamics of exchange, relaxation and rotation”. J. Am. Chem. Soc. 117 (23): 6300—6307. doi:10.1021/ja00128a020.
- ^ Power, P.P; Hope H. (1983). „Isolation and crystal structures of the halide-free and halide-rich phenyllithium etherate complexes [(PhLi.Et2O)4] and [(PhLi.Et2O)3.LiBr].”. Journal of the American Chemical Society. 105 (16): 5320—5324. doi:10.1021/ja00354a022.
- ^ a b Williard, P. G.; Salvino, J. M. (1993). „Synthesis, isolation, and structure of an LDA-THF complex”. Journal of Organic Chemistry. 58 (1): 1—3. doi:10.1021/jo00053a001.
- ^ Hilmersson, Goran; Granander, Johan (2009). „Structure and dynamics of chiral lithium amides”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0342.
- ^ a b Collum, D.B.; et al. (2007). „Lithium Diisopropylamide: Solution Kinetics and Implications for Organic Synthesis”. Angew. Chem. Int. Ed. 49 (17): 3002—3017. PMID 17387670. doi:10.1002/anie.200603038.
- ^ Sekiguchi, Akira.; et al. (2000). „Lithiosilanes and their application to the synthesis of polysilane dendrimers”. Coord. Chem. Rev. 210: 11—45. doi:10.1016/S0010-8545(00)00315-5.
- ^ Collum, D. B.; et al. (2008). „Solution Structures of Lithium Enolates, Phenolates, Carboxylates, and Alkoxides in the Presence of N,N,N′,N′-Tetramethylethylenediamine: A Prevalence of Cyclic Dimers”. J. Org. Chem. 73 (19): 7743—7747. PMC 2636848
 . PMID 18781812. doi:10.1021/jo801532d.
. PMID 18781812. doi:10.1021/jo801532d.
- ^ Reich, H. J.; et al. (1998). „Aggregation and reactivity of phenyllithium solutions”. J. Am. Chem. Soc. 120 (29): 7201—7210. doi:10.1021/ja980684z.
- ^ McGarrity, J. F.; Ogle, C.A. (1985). „High-field proton NMR study of the aggregation and complexation of n-butyllithium in tetrahydrofuran”. J. Am. Chem. Soc. 107 (7): 1805—1810. doi:10.1021/ja00293a001.
- ^ a b Reich, H. J. (2012). „What's going on with these lithium reagents”. J. Org. Chem. 77 (13): 5471—5491. PMID 22594379. doi:10.1021/jo3005155.
- ^ Wardell, J.L. (1982). „Chapter 2”. Ur.: Wilinson, G.; Stone, F. G. A.; Abel, E. W. Comprehensive Organometallic Chemistry, Vol. 1 (1st izd.). New York: Pergamon. ISBN 978-0080406084.
- ^ Strohmann, C.; Gessner, V.H. (2008). „Crystal Structures of n-BuLi Adducts with (R,R)-TMCDA and the Consequences for the Deprotonation of Benzene”. J. Am. Chem. Soc. 130 (35): 11719—11725. PMID 18686951. doi:10.1021/ja8017187.
- ^ Collum, D. B.; et al. (2007). „Lithium Diisopropylamide: Solution Kinetics and Implications for Organic Synthesis”. Angew. Chem. Int. Ed. 46 (17): 3002—3017. PMID 17387670. doi:10.1002/anie.200603038.
- ^ a b Chalk, A.J; Hoogeboom, T.J (1968). „Ring metalation of toluene by butyllithium in the presence of N,N,N′,N′-tetramethylethylenediamine”. J. Organomet. Chem. 11: 615—618. doi:10.1016/0022-328x(68)80091-9.
- ^ a b Reich, H.J; Green, D.P (1989). „Spectroscopic and Reactivity Studies of Lithium Reagent - HMPA Complexes”. Journal of the American Chemical Society. 111 (23): 8729—8731. doi:10.1021/ja00205a030.
- ^ Williard, P.G; Nichols, M.A (1993). „Solid-state structures of n-butyllithium-TMEDA, -THF, and -DME complexes”. Journal of the American Chemical Society. 115 (4): 1568—1572. doi:10.1021/ja00057a050.
- ^ Collum, D.B. (1992). „Is N,N,N,N-Tetramethylethylenediamine a Good Ligand for Lithium?”. Acc. Chem. Res. 25 (10): 448—454. doi:10.1021/ar00022a003.
- ^ Bernstein, M.P.; Collum, D.B. (1993). „Solvent- and substrate-dependent rates of imine metalations by lithium diisopropylamide: understanding the mechanisms underlying krel”. J. Am. Chem. Soc. 115 (18): 8008—8010. doi:10.1021/ja00071a011.
- ^ Seebach, D (1988). „Structure and Reactivity of Lithium Enolates. From Pinacolone to Selective C-Alkylations of Peptides. Difficulties and Opportunities Afforded by Complex Structures.” (PDF). Angew. Chem. Int. Ed. 27 (12): 1624—1654. doi:10.1002/anie.198816241.
- ^ a b v Fananas, Francisco; Sanz, Roberto (2009). „Intramolecular carbolithiation reactions”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0341.
- ^ Heinz-Dieter Brandt, Wolfgang Nentwig1, Nicola Rooney, Ronald T. LaFlair, Ute U. Wolf, John Duffy, Judit E. Puskas, Gabor Kaszas, Mark Drewitt, Stephan Glander "Rubber, 5. Solution Rubbers" in Ullmann's Encyclopedia of Industrial Chemistry, 2011, Wiley-VCH, Weinheim. doi:10.1002/14356007.o23_o02
- ^ Baskaran, D.; Müller, A.H. (2010). „Anionic Vinyl Polymerization”. Controlled and living polymerizations: From mechanisms to applications. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 9783527629091. doi:10.1002/9783527629091.ch1.
- ^ Bailey, W.F.; et al. (1989). „Preparation and facile cyclization of 5-alkyn-1-yllithiums”. Tetrahedron Lett. 30 (30): 3901—3904. doi:10.1016/S0040-4039(00)99279-7.
- ^ a b v g d đ e Carey, Francis A. (2007). „Organometallic compounds of Group I and II metals”. Advanced Organic Chemistry: Reaction and Synthesis Pt. B (Kindle izd.). Springer. ISBN 978-0-387-44899-2.
- ^ Ashby, E.C.; Noding, S.R. (1979). „The effects of added salts on the stereoselectivity and rate of organometallic compound addition to ketones”. J. Org. Chem. 44 (24): 4371—4377. doi:10.1021/jo01338a026.
- ^ Yamataka, Hiroshi (2009). „Addition of organolithium reagents to double bonds”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0310.
- ^ Landa, S.; et al. (1967). „Über adamantan und dessen derivate IX. In 2-stellung substituierte derivate”. Collection of Czechoslovak Chemical Communications. 72 (2): 570—575. doi:10.1135/cccc19670570.
- ^ Rubottom, G.M.; Kim, C (1983). „Preparation of methyl ketones by the sequential treatment of carboxylic acids with methyllithium and chlorotrimethylsilane”. J. Org. Chem. 48 (9): 1550—1552. doi:10.1021/jo00157a038.
- ^ Zadel, G.; Breitmaier, E. (1992). „A One-Pot Synthesis of Ketones and Aldehydes from Carbon Dioxide and Organolithium Compounds”. Angew. Chem. Int. Ed. 31 (8): 1035—1036. doi:10.1002/anie.199210351.
- ^ Ronald, R.C. (1975). „Methoxymethyl ethers. An activating group for rapid and regioselective metalation”. Tetrahedron Lett. 16 (46): 3973—3974. doi:10.1016/S0040-4039(00)91212-7.
- ^ Hunt, D.A. (1989). „Michael addition of organolithium compounds. A Review”. Org. Prep. Proc. Int. 21 (6): 705—749. doi:10.1080/00304948909356219.
- ^ Reich, H. J.; Sikorski, W. H. (1999). „Regioselectivity of Addition of Organolithium Reagents to Enones: The Role of HMPA”. J. Org. Chem. 64 (1): 14—15. PMID 11674078. doi:10.1021/jo981765g.
- ^ Collum, D.B.; et al. (2001). „NMR Spectroscopic Investigations of Mixed Aggregates Underlying Highly Enantioselective 1,2-Additions of Lithium Cyclopropylacetylide to Quinazolinones”. J. Am. Chem. Soc. 123 (37): 9135—9143. PMID 11552822. doi:10.1021/ja0105616.
- ^ Sommmer, L.H.; Korte, W. D. (1970). „Stereospecific coupling reactions between organolithium reagents and secondary halides”. J. Org. Chem. 35: 22—25. doi:10.1021/jo00826a006.
- ^ a b v g Organolithium Reagents Reich, H.J. 2002 https://organicchemistrydata.org/hansreich/resources/organolithium/organolithium_data/orgli-primer.pdf
- ^ а б The Preparation of Organolithium Reagents and Intermediates Leroux.F., Schlosser. M., Zohar. E., Marek. I., Wiley, New York. 2004. ISBN 978-0-470-84339-0
- ^ a b Hoppe, Dieter; Christoph, Guido (2009). „Asymmetric deprotonation with alkyllithium– (−)-sparteine”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0313.
- ^ Clayden, Jonathan (2009). „Directed metallization of aromatic compounds”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0306.
- ^ Schlosser, M (1988). „Superbases for organic synthesis”. Pure Appl. Chem. 60 (11): 1627—1634. doi:10.1351/pac198860111627
 .
.
- ^ Roush, W.R.; et al. (1988). „Enantioselective synthesis using diisopropyl tartrate modified (E)- and (Z)-crotylboronates: Reactions with achiral aldehydes”. Tetrahedron Lett. 29 (44): 5579—5582. doi:10.1016/S0040-4039(00)80816-3.
- ^ Park, Y.S.; et al. (1996). „(−)-Sparteine-Mediated α-Lithiation of N-Boc-N-(p-methoxyphenyl)benzylamine: Enantioselective Syntheses of (S) and (R) Mono- and Disubstituted N-Boc-benzylamines”. J. Am. Chem. Soc. 118 (15): 3757—3758. doi:10.1021/ja9538804.
- ^ a b v g Valnot, Jean-Yves; Maddaluno, Jacques (2009). „Aspects of the synthesis, structure and reactivity of lithium enolates”. PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. ISBN 9780470682531. doi:10.1002/9780470682531.pat0345.
- ^ Ireland. R. E.; et al. (1976). „The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation”. J. Am. Chem. Soc. 98 (10): 2868—2877. doi:10.1021/ja00426a033.
- ^ Parham, W.P.; Bradsher, C.K. (1982). „Aromatic organolithium reagents bearing electrophilic groups. Preparation by halogen-lithium exchange”. Acc. Chem. Res. 15 (10): 300—305. doi:10.1021/ar00082a001.
- ^ Corey, E.J.; Wollenberg, R.H. (1975). „Useful new organometallic reagents for the synthesis of allylic alcohols by nucleophilic vinylation”. J. Org. Chem. 40 (15): 2265—2266. doi:10.1021/jo00903a037.
- ^ Reeder, M.R.; et al. (2003). „An Improved Method for the Palladium Cross-Coupling Reaction of Oxazol-2-ylzinc Derivatives with Aryl Bromides”. Org. Process Res. Dev. 7 (5): 696—699. doi:10.1021/op034059c.
- ^ Nakamura, E.; et al. (1997). „Reaction Pathway of the Conjugate Addition of Lithium Organocuprate Clusters to Acrolein”. J. Am. Chem. Soc. 119 (21): 4900—4910. doi:10.1021/ja964209h.
- ^ "Organometallics in Organic Synthesis", Schlosser, M., Ed, Wiley: New York, 1994. ISBN 0-471-93637-5
- ^ Si-Fodil, M.; et al. (1998). „Obtention of 2,2-(diethoxy) vinyl lithium and 2-methyl-4-ethoxy butadienyl lithium by arene-catalysed lithiation of the corresponding chloro derivatives. Synthetic applications”. Tetrahedron Lett. 39 (49): 8975—8978. doi:10.1016/S0040-4039(98)02031-0.
- ^ Cohen, T; Bhupathy. M (1989). „Organoalkali compounds by radical anion induced reductive metalation of phenyl thioethers”. Acc. Chem. Res. 22 (4): 152—161. doi:10.1021/ar00160a006.
- ^ a b Snieckus, V (1990). „Directed ortho metalation. Tertiary amide and O-carbamate directors in synthetic strategies for polysubstituted aromatics”. Chem. Rev. 90 (6): 879—933. doi:10.1021/cr00104a001.
- ^ a b Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (2002). „Safe handling of organolithium compounds in the laboratory”. Chemical Health and Safety. 9 (3): 6—11. ISSN 1074-9098. doi:10.1016/S1074-9098(02)00295-2.
- ^ Gellert, H; Ziegler, K. (1950). „Organoalkali compounds. XVI. The thermal stability of lithium alkyls.”. Liebigs Ann. Chem. 567: 179—185. doi:10.1002/jlac.19505670110.
- ^ Juaristi, E.; Martínez-Richa, A.; García-Rivera, A.; Cruz-Sánchez, J. S. (1983). „Use of 4-Biphenylmethanol, 4-Biphenylacetic Acid and 4-Biphenylcarboxylic Acid/Triphenylmethane as Indicators in the Titration of Lithium Alkyls. Study of the Dianion of 4-Biphenylmethanol”. The Journal of Organic Chemistry. 48 (15): 2603—2606. doi:10.1021/jo00163a038.
- ^ „Titrating Soluble RM, R2NM and ROM Reagents” (PDF). Pristupljeno 2014-06-04.
- ^ „Methods for Standardizing Alkyllithium Reagents (literature through 2006)” (PDF). Pristupljeno 2014-06-04.
- ^ Stanetty, P.; Koller, H.; Mihovilovic, M. (1992). „Directed Ortho-Lithiation of Phenylcarbamic Acid 1,l-Dimethylethyl Ester (N-Boc-aniline). Revision and Improvements”. J. Org. Chem. 57 (25): 6833—6837. doi:10.1021/jo00051a030.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II izd.). Oxford: Butterworth-Heinemann. str. 73. ISBN 0080379419.
- ^ „India finds 5.9 million tonnes lithium deposits in Jammu and Kashmir”. Hindustan Times. 10. 2. 2023. Arhivirano iz originala 10. 2. 2023. g. Pristupljeno 11. 2. 2023.
- ^ „5.9 million tonnes Lithium deposits found in J&K: Why it's important”. The Times of India. 10. 2. 2023. Arhivirano iz originala 10. 2. 2023. g. Pristupljeno 11. 2. 2023.
- ^ Lithium na USGS Mineral Resources, 2009 (PDF).
- ^ SGU. Mineralmarknaden, Tema: Litium [in Swedish]. Publication by the Swedish Geological Survey; 2009. ISSN 0283-2038
- ^ Tarascon, J. M. (2010). „Is lithium the new gold?”. Nature Chemistry. 2 (6): 510. Bibcode:2010NatCh...2..510T. PMID 20489722. doi:10.1038/nchem.680
 .
.
- ^ Woody, Todd (19. 10. 2011). „Lithium: The New California Gold Rush”. Forbes. Arhivirano iz originala 19. 12. 2014. g.
- ^ Houston, J.; Butcher, A.; Ehren, P.; Evans, K.; Godfrey, L. (2011). „The Evaluation of Brine Prospects and the Requirement for Modifications to Filing Standards” (PDF). Economic Geology. 106 (7): 1225—1239. Bibcode:2011EcGeo.106.1225H. doi:10.2113/econgeo.106.7.1225. Arhivirano (PDF) iz originala 20. 7. 2018. g. Pristupljeno 28. 6. 2019.
- ^ Warr, L.N. (2021). „IMA–CNMNC approved mineral symbols”. Mineralogical Magazine. 85 (3): 291—320. Bibcode:2021MinM...85..291W. S2CID 235729616. doi:10.1180/mgm.2021.43
 .
.
- ^ Schwartz, G. (1928). „The Black Hills Mineral Region”. American Mineralogist. 13: 56—63.
- ^ Robert Louis Bonewitz, 2005, Rock and Gem, London, Dorling Kindersley
- ^ „Greenbushes Lithium Mine”. Golden Dragon Capital (na jeziku: engleski). Arhivirano iz originala 19. 1. 2019. g. Pristupljeno 18. 1. 2019.
- ^ Anlauf, Axel (2016). „Greening the imperial mode of living? Socio- ecological (in)justice, electromobility, and lithium mining in Argentina”. Ur.: Pichler, Melanie; Staritz, Cornelia; Küblböck, Karin; Plank, Christina; Raza, Werner; Ruiz Peyré, Fernando. Fairness and Justice in Natural Resource Politics.
- ^ López Steinmetz, Romina Lucrecia; Salvi, Stefano (2021). „Brine grades in Andean salars: When basin size matters A review of the Lithium Triangle”. Earth-Science Reviews. 217. Bibcode:2021ESRv..21703615L. S2CID 233846211. doi:10.1016/j.earscirev.2021.103615.
- ^ Halpern, Abel (30. 1. 2014). „The Lithium Triangle”. Latin Trade. Arhivirano iz originala
 10. 6. 2018. g.
10. 6. 2018. g.
- ^ a b Romero Simon (2. 2. 2009). „In Bolivia, a Tight Grip on the Next Big Resource”. The New York Times. Arhivirano iz originala 1. 7. 2017. g.
- ^ „USGS Mineral Commodities Summaries 2009” (PDF). USGS. Arhivirano (PDF) iz originala 14. 6. 2010. g.
- ^ Dube, Ryan (11. 8. 2022). „The Place With the Most Lithium Is Blowing the Electric-Car Revolution”. The Wall Street Journal (na jeziku: engleski). CCLXXX (35). str. A1, A8. ISSN 1042-9840. Arhivirano iz originala 10. 8. 2022. g. Pristupljeno 11. 8. 2022.
- ^ a b v g d đ Cabello, J (2022). „Reserves, resources and lithium exploration in the salt flats of northern Chile”. Andean Geology. 49 (2): 297—306. doi:10.5027/andgeoV49n2-3444]. Arhivirano iz originala 12. 12. 2022. g. Pristupljeno 3. 7. 2022.
- ^ Bernick, Michael (12. 12. 2023). „The Jobs Perplex Of The Lithium Valley”. Forbes (na jeziku: engleski). Arhivirano iz originala 5. 2. 2024. g. Pristupljeno 2024-02-05.
- ^ „This Congo project could supply the world with lithium”. MiningDotCom. 10. 12. 2018. Arhivirano iz originala 14. 4. 2021. g. Pristupljeno 26. 3. 2021.
- ^ „Plateau Energy Metals Peru unit finds large lithium resources”. Reuters. 16. 7. 2018. Arhivirano iz originala 26. 7. 2018. g.
- ^ Matthis, Simon (17. 3. 2021). „Australia grants MPS for Core Lithium's Finniss lithium project”. MiningMetalNews. Arhivirano iz originala 13. 10. 2022. g. Pristupljeno 13. 10. 2022.
- ^ CORE Lithium : Finnis Lithium Arhivirano 13 oktobar 2022 na sajtu Wayback Machine, retrieved 13 October 2022
- ^ „Finniss Lithium Project, Northern Territory, Australia”. Mining Technology. 13. 1. 2022. Arhivirano iz originala 13. 10. 2022. g. Pristupljeno 13. 10. 2022.
- ^ Daly, John C.K. (26. 4. 2013). „Researchers Have Stumbled On A Massive Lithium Mine That Could Meet All US Demand”. Business Insider. New York City, U.S.: OilPrice.com. Arhivirano iz originala 3. 5. 2013. g.
- ^ Benson, Tom (16. 8. 2016). „Lithium enrichment in intracontinental rhyolite magmas leads to Li deposits in caldera basins”. Nature Communications. 8 (1): 270. PMC 5559592
 . PMID 28814716. doi:10.1038/s41467-017-00234-y.
. PMID 28814716. doi:10.1038/s41467-017-00234-y.
- ^ Galliski, Miguel Ángel; Márquez-Zavalía, María Florencia; Roda-Robles, Encarnación; von Quadt, Albrecht (2022). „The Li-Bearing Pegmatites from the Pampean Pegmatite Province, Argentina: Metallogenesis and Resources”. Minerals. MDPI. 12 (7): 841. Bibcode:2022Mine...12..841G. doi:10.3390/min12070841
 .
.
- ^ „Polar Lithium awarded right to develop Russia's largest lithium deposit”. 9. 2. 2023. Arhivirano iz originala 22. 7. 2023. g. Pristupljeno 22. 7. 2023.
- ^ Parker, Ann. Mining Geothermal Resources Arhivirano 17 septembar 2012 na sajtu Wayback Machine. Lawrence Livermore National Laboratory
- ^ Patel, P. (16 November 2011) Startup to Capture Lithium from Geothermal Plants Arhivirano 21 jul 2022 na sajtu Wayback Machine. technologyreview.com
- ^ Ober, Joyce A. „Lithium” (PDF). United States Geological Survey. str. 77—78. Arhivirano (PDF) iz originala 11. 7. 2007. g. Pristupljeno 19. 8. 2007.
- ^ „SQM Announces New Lithium Prices – SANTIAGO, Chile”. PR Newswire. 30. 9. 2009. Arhivirano iz originala 30. 5. 2013. g.
- ^ a b Riseborough, Jesse. „IPad Boom Strains Lithium Supplies After Prices Triple”. Bloomberg BusinessWeek. Arhivirano iz originala 22. 6. 2012. g. Pristupljeno 1. 5. 2013.
- ^ „ISE Metal-quotes”. Arhivirano iz originala 9. 7. 2023. g. Pristupljeno 29. 9. 2022.
- ^ Thacker Pass Lithium Mine Project Final Environmental Impact Statement (PDF) (Tehnički izveštaj). Bureau of Land Management and the U.S. Fish and Wildlife Service. 4. 12. 2020. DOI-BLM-NV-W010-2020-0012-EIS. Pristupljeno 16. 3. 2021.
- ^ a b Patterson, Scott; Ramkumar, Amrith (9. 3. 2021). „America's Battery-Powered Car Hopes Ride on Lithium. One Producer Paves the Way”. The Wall Street Journal. Arhivirano iz originala 12. 3. 2021. g. Pristupljeno 13. 3. 2021.
- ^ Cafariello, Joseph (10. 3. 2014). „Lithium: A Long-Term Investment Buy Lithium!”. wealthdaily.com. Arhivirano iz originala 12. 6. 2018. g. Pristupljeno 2015-04-24.
- ^ Kaskey, Jack (16. 7. 2014). „Largest Lithium Deal Triggered by Smartphones and Teslas”. Bloomberg. Arhivirano iz originala 12. 6. 2018. g. Pristupljeno 2015-04-24.
- ^ Marcelo Azevedo; Nicolò Campagnol; Toralf Hagenbruch; Ken Hoffman; Ajay Lala; Oliver Ramsbottom (jun 2018). „Lithium and cobalt – a tale of two commodities”. McKinsey. str. 9. Arhivirano iz originala 11. 12. 2019. g. Pristupljeno 29. 1. 2020.
- ^ Sun, Sen; Yu, Xiaoping; Li, Mingli; Duo, Ji; Guo, Yafei; Deng, Tianlong (2020-02-20). „Green recovery of lithium from geothermal water based on a novel lithium iron phosphate electrochemical technique”. Journal of Cleaner Production (na jeziku: engleski). 247: 119178. Bibcode:2020JCPro.24719178S. ISSN 0959-6526. S2CID 211445414. doi:10.1016/j.jclepro.2019.119178.
- ^ Chong Liu; Yanbin Li; Dingchang Lin; Po-Chun Hsu; Bofei Liu; Gangbin Yan; Tong Wu Yi Cui; Steven Chu (2020). „Lithium Extraction from Seawater through Pulsed Electrochemical Intercalation”. Joule. 4 (7): 1459—1469. Bibcode:2020Joule...4.1459L. S2CID 225527170. doi:10.1016/j.joule.2020.05.017.
- ^ Tsuyoshi Hoshino (2015). „Innovative lithium recovery technique from seawater by using world-first dialysis with a lithium ionic superconductor”. Desalination. 359: 59—63. Bibcode:2015Desal.359...59H. doi:10.1016/j.desal.2014.12.018
 .
.
- ^ Robert F. Service (13. 7. 2020). „Seawater could provide nearly unlimited amounts of critical battery material”. Science. Arhivirano iz originala 13. 1. 2021. g. Pristupljeno 26. 12. 2020.
- ^ a b Yang, Sixie; Zhang, Fan; Ding, Huaiping; He, Ping; Zhou, Haoshen (2018-09-19). „Lithium Metal Extraction from Seawater”. Joule (na jeziku: engleski). 2 (9): 1648—1651. Bibcode:2018Joule...2.1648Y. ISSN 2542-4351. S2CID 189702476. doi:10.1016/j.joule.2018.07.006. Arhivirano iz originala 19. 1. 2021. g. Pristupljeno 21. 10. 2020.
- ^ a b v Amui, Rachid (februar 2020). „Commodities At a Glance: Special issue on strategic battery raw materials” (PDF). United Nations Conference on Trade and Development. 13 (UNCTAD/DITC/COM/2019/5). Arhivirano (PDF) iz originala 3. 2. 2021. g. Pristupljeno 10. 2. 2021.
- ^ Application of Life-Cycle Assessment to Nanoscale Technology: Lithium-ion Batteries for Electric Vehicles (Izveštaj). Washington, DC: U.S. Environmental Protection Agency (EPA). 2013. EPA 744-R-12-001. Arhivirano iz originala 11. 7. 2017. g. Pristupljeno 24. 3. 2021.
- ^ „Can Nanotech Improve Li-ion Battery Performance”. Environmental Leader. 30. 5. 2013. Arhivirano iz originala 21. 8. 2016. g. Pristupljeno 3. 6. 2013.
- ^ Katwala, Amit. „The spiralling environmental cost of our lithium battery addiction”. Wired. Condé Nast Publications. Arhivirano iz originala 9. 2. 2021. g. Pristupljeno 10. 2. 2021.
- ^ Draper, Robert. „This metal is powering today's technology—at what price?”. National Geographic (February 2019). National Geographic Partners. Arhivirano iz originala
 18. 1. 2019. g. Pristupljeno 10. 2. 2021.
18. 1. 2019. g. Pristupljeno 10. 2. 2021.
- ^ a b „The Lithium Gold Rush: Inside the Race to Power Electric Vehicles”. The New York Times. 6. 5. 2021. Arhivirano iz originala 6. 5. 2021. g. Pristupljeno 6. 5. 2021.
- ^ Marchegiani Morgera Parks (21. 11. 2019). „Indigenous peoples'rights to natural resources in Argentina: the challenges of impact assessment, consent and fair andequitable benefit-sharing in cases of lithium mining”. The International Journal of Human Rights.
- ^ Price, Austin (leto 2021). „The Rush for White Gold”. Earth Island Journal. Arhivirano iz originala 29. 10. 2021. g. Pristupljeno 29. 10. 2021.
- ^ Chadwell, Jeri (21. 7. 2021). „Judge to decide on injunction request to halt work on Thacker Pass lithium mine”. This is Reno. Arhivirano iz originala 29. 10. 2021. g. Pristupljeno 12. 10. 2021.
- ^ „Thacker Pass Lithium mine approval draws around-the-clock protest”. Sierra Nevada Ally. 19. 1. 2021. Arhivirano iz originala 29. 10. 2021. g. Pristupljeno 16. 3. 2021.
- ^ O litijskim baterijama Arhivirano na sajtu Wayback Machine (24. januar 2009) na stranici TU Graz (PDF).
- ^ The Theory and Practice of Mold Fluxes Used in Continuous Casting: A Compilation of Papers on Continuous Casting Fluxes Given at the 61st and 62nd Steelmaking Conference, Iron and Steel Society
- ^ Lu, Y. Q.; Zhang, G. D.; Jiang, M. F.; Liu, H. X.; Li, T. (2011). „Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting”. Materials Science Forum. 675–677: 877—880. S2CID 136666669. doi:10.4028/www.scientific.net/MSF.675-677.877.
- ^ „Testing 1-2-3: Eliminating Veining Defects”, Modern Casting, jul 2014, Arhivirano iz originala 2. 4. 2015. g., Pristupljeno 15. 3. 2015
- ^ Haupin, W. (1987), Mamantov, Gleb; Marassi, Roberto, ur., „Chemical and Physical Properties of the Hall-Héroult Electrolyte”, Molten Salt Chemistry: An Introduction and Selected Applications, Springer, str. 449
- ^ Garrett, Donald E. (2004-04-05). Handbook of Lithium and Natural Calcium Chloride (na jeziku: engleski). Academic Press. str. 200. ISBN 978-0-08-047290-4. Arhivirano iz originala 3. 12. 2016. g.
- ^ Prasad, N. Eswara; Gokhale, Amol; Wanhill, R. J. H. (2013-09-20). Aluminum-Lithium Alloys: Processing, Properties, and Applications (na jeziku: engleski). Butterworth-Heinemann. ISBN 978-0-12-401679-8. Arhivirano iz originala 1. 1. 2021. g. Pristupljeno 6. 11. 2020.
- ^ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. str. 121—. ISBN 978-0-87170-496-2. Arhivirano iz originala 28. 5. 2013. g. Pristupljeno 16. 5. 2011.
- ^ Karki, Khim; Epstein, Eric; Cho, Jeong-Hyun; Jia, Zheng; Li, Teng; Picraux, S. Tom; Wang, Chunsheng; Cumings, John (2012). „Lithium-Assisted Electrochemical Welding in Silicon Nanowire Battery Electrodes” (PDF). Nano Letters. 12 (3): 1392—7. Bibcode:2012NanoL..12.1392K. PMID 22339576. doi:10.1021/nl204063u. Arhivirano (PDF) iz originala 10. 8. 2017. g.
- ^ „Lithium” (PDF). USGS. Arhivirano (PDF) iz originala 1. 11. 2020. g. Pristupljeno 15. 11. 2020.
- ^ „Lithium” (PDF). 2016. Arhivirano (PDF) iz originala 30. 11. 2016. g. Pristupljeno 29. 11. 2016 — preko US Geological Survey (USGS).
- ^ „Fmclithium.com” (PDF). www.fmclithium.com. Arhivirano iz originala (PDF) 7. 9. 2014. g.
- ^ Clark, Jim (2005). „Some Compounds of the Group 1 Elements”. chemguide.co.uk. Arhivirano iz originala 27. 6. 2013. g. Pristupljeno 8. 8. 2013.
- ^ „Disposable Batteries - Choosing between Alkaline and Lithium Disposable Batteries”. Batteryreview.org. Arhivirano iz originala 6. 1. 2014. g. Pristupljeno 10. 10. 2013.
- ^ „Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell”. Emc2.cornell.edu. Arhivirano iz originala 22. 12. 2013. g. Pristupljeno 10. 10. 2013.
- ^ Totten, George E.; Westbrook, Steven R.; Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing. 1. ASTM International. str. 559. ISBN 978-0-8031-2096-9. Arhivirano iz originala 23. 7. 2016. g.
- ^ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. str. 150—152. ISBN 978-0-8031-2097-6. Arhivirano iz originala 31. 7. 2016. g.
- ^ Koch, Ernst-Christian (2004). „Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems”. Propellants, Explosives, Pyrotechnics. 29 (2): 67—80. doi:10.1002/prep.200400032.
- ^ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick (2001) Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9. Arhivirano iz originala 19. 1. 2023. g. Pristupljeno 22. 2. 2016., Academic Press. ISBN 0-12-352651-5, p. 1089
- ^ Mulloth, L.M.; Finn, J.E. (2005). „Air Quality Systems for Related Enclosed Spaces: Spacecraft Air”. The Handbook of Environmental Chemistry. 4H. str. 383—404. ISBN 978-3-540-25019-7. doi:10.1007/b107253.
- ^ „Application of lithium chemicals for air regeneration of manned spacecraft” (PDF). Lithium Corporation of America & Aerospace Medical Research Laboratories. 1965. Arhivirano iz originala (PDF) 7. 10. 2012. g.
- ^ Markowitz, M. M.; Boryta, D. A.; Stewart, Harvey (1964). „Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen”. Industrial & Engineering Chemistry Product Research and Development. 3 (4): 321—30. doi:10.1021/i360012a016.
- ^ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. str. 149. ISBN 978-0-470-40229-0. Arhivirano iz originala 23. 6. 2016. g.
- ^ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy. 2001. World Scientific. 2002. str. 819. ISBN 978-981-238-180-4. Arhivirano iz originala 6. 6. 2016. g.
- ^ Sinton, William M. (1962). „Infrared Spectroscopy of Planets and Stars”. Applied Optics. 1 (2): 105. Bibcode:1962ApOpt...1..105S. doi:10.1364/AO.1.000105.
- ^ „You've got the power: the evolution of batteries and the future of fuel cells” (PDF). Toshiba. Arhivirano (PDF) iz originala 17. 7. 2011. g. Pristupljeno 17. 5. 2009.
- ^ „Organometallics”. IHS Chemicals. februar 2012. Arhivirano iz originala 7. 7. 2012. g. Pristupljeno 2. 1. 2012.
- ^ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). „Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators”. Russian Chemical Bulletin. 37 (9): 1782—1784. S2CID 94017312. doi:10.1007/BF00962487.
- ^ Quirk, Roderic P.; Cheng, Pao Luo (1986). „Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium”. Macromolecules. 19 (5): 1291—1294. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ^ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. str. 55. ISBN 978-0-12-031118-7. Arhivirano iz originala 13. 3. 2021. g. Pristupljeno 6. 11. 2020.
- ^ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. Jones & Bartlett Learning. str. 192. ISBN 978-0-7637-0665-4. Arhivirano iz originala 18. 6. 2016. g.
- ^ „An Experimental Investigation of a Lithium Aluminum Hydride–Hydrogen Peroxide Hybrid Rocket” (PDF). 28. 6. 2003. Arhivirano iz originala (PDF) 28. 6. 2003. g.
- ^ Hughes, T.G.; Smith, R.B.; Kiely, D.H. (1983). „Stored Chemical Energy Propulsion System for Underwater Applications”. Journal of Energy. 7 (2): 128—133. Bibcode:1983JEner...7..128H. doi:10.2514/3.62644.
- ^ Emsley, John (2011). Nature's Building Blocks.
- ^ Makhijani, Arjun; Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. str. 59—60. ISBN 978-0-262-63204-1. Arhivirano iz originala 13. 6. 2016. g.
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. str. 278. ISBN 978-0-309-05226-9. Arhivirano iz originala 13. 6. 2016. g.
- ^ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. str. 39. ISBN 978-0-415-07674-6. Arhivirano iz originala 9. 6. 2016. g.
- ^ Baesjr, C. (1974). „The chemistry and thermodynamics of molten salt reactor fuels”. Journal of Nuclear Materials. 51 (1): 149—162. Bibcode:1974JNuM...51..149B. OSTI 4470742. doi:10.1016/0022-3115(74)90124-X. Arhivirano iz originala 13. 3. 2021. g. Pristupljeno 28. 6. 2019.
- ^ Agarwal, Arun (2008). Nobel Prize Winners in Physics. APH Publishing. str. 139. ISBN 978-81-7648-743-6. Arhivirano iz originala 29. 6. 2016. g.
- ^ "'Splitting the Atom': Cockcroft and Walton, 1932: 9. Rays or Particles?" Arhivirano 2 septembar 2012 na sajtu Wayback Machine Department of Physics, University of Cambridge
- ^ „With lithium, more is definitely better”. phys.org.
- ^ „Integrating hot cores and cool edges in fusion reactors”. phys.org. Arhivirano iz originala 29. 4. 2023. g. Pristupljeno 23. 4. 2023.
- ^ Elements, American. „Lithium-7 Metal Isotope”. American Elements. Arhivirano iz originala 18. 8. 2019. g.
- ^ a b Wald, Matthew L. (8. 10. 2013). „Report Says a Shortage of Nuclear Ingredient Looms”. The New York Times. Arhivirano iz originala 1. 7. 2017. g.
- ^ a b Kean, Sam (2011). The Disappearing Spoon
 .
.
- ^ Yacobi S; Ornoy A (2008). „Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review”. Isr J Psychiatry Relat Sci. 45 (2): 95—106. PMID 18982835.
- ^ Cade, J. (1949). „Lithium salts in the treatment of psychotic excitement”. Med. J. Australia. 36 (10): 349—352. PMC 2560740
 . PMID 18142718. doi:10.1080/j.1440-1614.1999.06241.x.
. PMID 18142718. doi:10.1080/j.1440-1614.1999.06241.x.
- ^ Schou, M. (2001). Lithiumbehandlung der manisch-depressiven Krankheit. Thieme. ISBN 978-3-13-593304-7.
- ^ „Lithium 265969”. Sigma-Aldrich. Arhivirano iz originala 13. 3. 2021. g. Pristupljeno 1. 10. 2018.
- ^ Technical data for Lithium Arhivirano 23 mart 2015 na sajtu Wayback Machine. periodictable.com
- ^ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. str. 244—246. ISBN 978-0-8493-2523-6. Arhivirano iz originala 13. 3. 2021. g. Pristupljeno 6. 11. 2020.
Literatura
[uredi | uredi izvor]- Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements. Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- Nörtershäuser, W.; Tiedemann, D.; Žáková, M.; Andjelkovic, Z.; Blaum, K.; Bissell, M. L.; Cazan, R.; Drake, G. W. F.; Geppert, Ch.; Kowalska, M.; Krämer, J.; Krieger, A.; Neugart, R.; Sánchez, R.; Schmidt-Kaler, F.; Yan, Z.-C.; Yordanov, D. T.; Zimmermann, C. (2009). „Nuclear Charge Radii of Be7,9,10 and the One-Neutron Halo Nucleus Be11”. Physical Review Letters. 102 (6): 062503. Bibcode:2009PhRvL.102f2503N. PMID 19257582. S2CID 24357745. arXiv:0809.2607
 . doi:10.1103/PhysRevLett.102.062503.
. doi:10.1103/PhysRevLett.102.062503. - „Atomic Nucleus with Halo: For the First Time, Scientists Measure the Size of a One-Neutron Halo with Lasers”. 2009. Arhivirano iz originala 09. 11. 2020. g. Pristupljeno 16. 07. 2024. „The measurements revealed that the average distance between the halo neutrons and the dense core of the [Be-11] nucleus is 7 femtometers. Thus, the halo neutron is about three times as far from the dense core as is the outermost proton, since the core itself has a radius of only 2.5 femtometers.”
- Marqués, F. M.; Labiche, M.; Orr, N. A.; Angélique, J. C.; Axelsson, L.; Benoit, B.; Bergmann, U. C.; Borge, M. J. G.; Catford, W. N.; Chappell, S. P. G.; Clarke, N. M.; Costa, G.; Curtis, N.; d'Arrigo, A.; De Góes Brennand, E.; De Oliveira Santos, F.; Dorvaux, O.; Fazio, G.; Freer, M.; Fulton, B. R.; Giardina, G.; Grévy, S.; Guillemaud-Mueller, D.; Hanappe, F.; Heusch, B.; Jonson, B.; Le Brun, C.; Leenhardt, S.; Lewitowicz, M.; et al. (2002). „Detection of neutron clusters”. Physical Review C. 65 (4): 044006. Bibcode:2002PhRvC..65d4006M. S2CID 37431352. arXiv:nucl-ex/0111001
 . doi:10.1103/PhysRevC.65.044006.
. doi:10.1103/PhysRevC.65.044006. - Le Roy, Robert J.; N. S. Dattani; J. A. Coxon; A. J. Ross; Patrick Crozet; C. Linton (25. 11. 2009). „Accurate analytic potentials for Li2(X) and Li2(A) from 2 to 90 Angstroms, and the radiative lifetime of Li(2p)”. Journal of Chemical Physics. 131 (20): 204309. Bibcode:2009JChPh.131t4309L. PMID 19947682. doi:10.1063/1.3264688.
- Dattani, N. S.; R. J. Le Roy (8. 5. 2013). „A DPF data analysis yields accurate analytic potentials for Li2(a)and Li2(c) that incorporate 3-state mixing near the c-state asymptote”. Journal of Molecular Spectroscopy. 268 (1–2): 199—210. Bibcode:2011JMoSp.268..199.. S2CID 119266866. arXiv:1101.1361
 . doi:10.1016/j.jms.2011.03.030.
. doi:10.1016/j.jms.2011.03.030. - Semczuk, M.; Li, X.; Gunton, W.; Haw, M.; Dattani, N. S.; Witz, J.; Mills, A. K.; Jones, D. J.; Madison, K. W. (2013). „High-resolution photoassociation spectroscopy of the 6Li2 c-state”. Phys. Rev. A. 87 (5): 052505. Bibcode:2013PhRvA..87e2505S. S2CID 119263860. arXiv:1309.6662
 . doi:10.1103/PhysRevA.87.052505.
. doi:10.1103/PhysRevA.87.052505. - Huang, Yiye; R. J. Le Roy (8. 10. 2003). „Potential energy Lambda double and Born-Oppenheimer breakdown functions for the B1Piu "barrier" state of Li2”. Journal of Chemical Physics. 119 (14): 7398—7416. Bibcode:2003JChPh.119.7398H. doi:10.1063/1.1607313.
- Li, Dan; F. Xie; L. Li; A. Lazoudis; A. M. Lyyra (29. 9. 2007). „New observation of the, 13Δg, and 23Πg states and molecular constants with all 6Li2, 7Li2, and 6Li7Li data”. Journal of Molecular Spectroscopy. 246 (2): 180—186. Bibcode:2007JMoSp.246..180L. doi:10.1016/j.jms.2007.09.008.
- Jastrzebski, W; A. Pashov; P. Kowalczyk (22. 6. 2001). „The E-state of lithium dimer revised”. Journal of Chemical Physics. 114 (24): 10725—10727. Bibcode:2001JChPh.11410725J. doi:10.1063/1.1374927.
- Pashov, A; W. Jastzebski; P. Kowalczyk (22. 10. 2000). „The Li2 F "shelf" state: Accurate potential energy curve based on the inverted perturbation approach”. Journal of Chemical Physics. 113 (16): 6624—6628. Bibcode:2000JChPh.113.6624P. doi:10.1063/1.1311297.
- Tang, Li-Yan; Yan, Zong-Chao; Shi, Ting-Yun; Mitroy, J. (2011). „Third-order perturbation theory for van der Waals interaction coefficients” (PDF). Physical Review A. 84 (5): 052502. Bibcode:2011PhRvA..84e2502T. ISSN 1050-2947. S2CID 122544942. doi:10.1103/PhysRevA.84.052502. Arhivirano iz originala (PDF) 2020-06-25. g.
- Hou, S. Q.; He, J.J.; Parikh, A.; Kahl, D.; Bertulani, C.A.; Kajino, T.; Mathews, G.J.; Zhao, G. (2017). „Non-extensive statistics to the cosmological lithium problem”. The Astrophysical Journal. 834 (2): 165. Bibcode:2017ApJ...834..165H. S2CID 568182. arXiv:1701.04149
 . doi:10.3847/1538-4357/834/2/165
. doi:10.3847/1538-4357/834/2/165  .
. - Tanabashi, M.; Hagiwara, K.; Hikasa, K.; Nakamura, K.; Sumino, Y.; et al. (Particle Data Group) (2018-08-17). „Review of Particle Physics”. Physical Review D. American Physical Society (APS). 98 (3): 030001. Bibcode:2018PhRvD..98c0001T. ISSN 2470-0010. doi:10.1103/physrevd.98.030001
 . hdl:10044/1/68623
. hdl:10044/1/68623  .
. - Boesgaard, A. M.; Steigman, G. (1985). „Big bang nucleosynthesis – Theories and observations”. Annual Review of Astronomy and Astrophysics. Palo Alto, CA. 23: 319—378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535. A86-14507 04–90.
- Tanabashi, M.; et al. (2018). „Big-bang nucleosynthesis”. Ur.: Fields, B. D.; Molaro, P.; Sarkar, S. The Review (PDF). Physical Review D. 98. str. 377—382. Bibcode:2018PhRvD..98c0001T. doi:10.1103/PhysRevD.98.030001.
- Langmuir, C. H.; Broecker, W. S. (2012). How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press. ISBN 978-0691140063.
- Fields, B. D. (2011). „The primordial lithium problem”. Annual Review of Nuclear and Particle Science. 61 (1): 47—68. Bibcode:2011ARNPS..61...47F. arXiv:1203.3551
 . doi:10.1146/annurev-nucl-102010-130445
. doi:10.1146/annurev-nucl-102010-130445  .
. - Stiavelli, M. (2009). From First Light to Reionization the End of the Dark Ages. Weinheim, Germany: Wiley-VCH. str. 8. Bibcode:2009fflr.book.....S. ISBN 9783527627370.
- Woo, M. (21. 2. 2017). „The Cosmic Explosions That Made the Universe”. earth. BBC. Arhivirano iz originala 21. 2. 2017. g. Pristupljeno 21. 2. 2017. „A mysterious cosmic factory is producing lithium. Scientists are now getting closer at finding out where it comes from”
- Richard, O.; Michaud, G.; Richer, J. (2005-01-20). „Implications of WMAP Observations on Li Abundance and Stellar Evolution Models”. The Astrophysical Journal (na jeziku: engleski). 619 (1): 538—548. Bibcode:2005ApJ...619..538R. ISSN 0004-637X. S2CID 14299934. arXiv:astro-ph/0409672
 . doi:10.1086/426470.
. doi:10.1086/426470. - Korn, A. J.; Grundahl, F.; Richard, O.; Barklem, P. S.; Mashonkina, L.; Collet, R.; Piskunov, N.; Gustafsson, B. (avgust 2006). „A probable stellar solution to the cosmological lithium discrepancy”. Nature (na jeziku: engleski). 442 (7103): 657—659. Bibcode:2006Natur.442..657K. ISSN 1476-4687. PMID 16900193. S2CID 3943644. arXiv:astro-ph/0608201
 . doi:10.1038/nature05011.
. doi:10.1038/nature05011. - Cain, Fraser. „Brown Dwarf”. Universe Today. Arhivirano iz originala 25. 2. 2011. g. Pristupljeno 17. 11. 2009.
- „First Detection of Lithium from an Exploding Star”. Arhivirano iz originala 1. 8. 2015. g. Pristupljeno 29. 7. 2015.
- Reid, N. (10. 3. 2002). „L Dwarf Classification”. Arhivirano iz originala 21. 5. 2013. g. Pristupljeno 6. 3. 2013.
- Plait, P. (11. 11. 2009). „Want a planet? You might want to avoid lithium”. Discover.
- Israelian, G.; et al. (2009). „Enhanced lithium depletion in Sun-like stars with orbiting planets”. Nature. 462 (7270): 189—191. Bibcode:2009Natur.462..189I. PMID 19907489. S2CID 388656. arXiv:0911.4198
 . doi:10.1038/nature08483.
. doi:10.1038/nature08483. - Baumann, P.; Ramírez, I.; et al. (2010). „Lithium depletion in solar-like stars: no planet connection”. Astronomy and Astrophysics. 519: A87. Bibcode:2010A&A...519A..87B. ISSN 0004-6361. arXiv:1008.0575
 . doi:10.1051/0004-6361/201015137
. doi:10.1051/0004-6361/201015137  .
. - Ramírez, I.; Fish, J. R.; et al. (2012). „Lithium abundances in nearby FGK dwarf and subgiant stars: internal destruction, galactic chemical evolution, and exoplanets”. The Astrophysical Journal. 756 (1): 46. Bibcode:2012ApJ...756...46R. ISSN 0004-637X. S2CID 119199829. arXiv:1207.0499
 . doi:10.1088/0004-637X/756/1/46. hdl:2152/34872
. doi:10.1088/0004-637X/756/1/46. hdl:2152/34872  .
. - Figueira, P.; Faria, J. P.; et al. (2014). „Exoplanet hosts reveal lithium depletion”. Astronomy & Astrophysics. 570: A21. ISSN 0004-6361. arXiv:1409.0890
 . doi:10.1051/0004-6361/201424218
. doi:10.1051/0004-6361/201424218  .
. - Delgado Mena, E.; Israelian, G.; et al. (2014). „Li depletion in solar analogues with exoplanets”. Astronomy & Astrophysics. 562: A92. ISSN 0004-6361. arXiv:1311.6414
 . doi:10.1051/0004-6361/201321493
. doi:10.1051/0004-6361/201321493  .
. - Li, H.; Aoki, W.; Matsuno, T.; Kumar, Y. Bharat; Shi, J.; Suda, T.; Zhao, G.; Zhao, G. (2018). „Enormous Li Enhancement Preceding Red Giant Phases in Low-mass Stars in the Milky Way Halo”. The Astrophysical Journal. 852 (2): L31. Bibcode:2018ApJ...852L..31L. S2CID 54205417. arXiv:1801.00090
 . doi:10.3847/2041-8213/aaa438
. doi:10.3847/2041-8213/aaa438  .
. - Emsley, J. (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 978-0-19-850341-5.
- Hou, S. Q.; He, J. J.; Parikh, A.; Kahl, D.; Bertulani, C. A.; Kajino, T.; Mathews, G. J.; Zhao, G. (2017-01-11). „Non-Extensive Statistics to the Cosmological Lithium Problem”. The Astrophysical Journal. 834 (2): 165. Bibcode:2017ApJ...834..165H. ISSN 1538-4357. S2CID 568182. arXiv:1701.04149
 . doi:10.3847/1538-4357/834/2/165
. doi:10.3847/1538-4357/834/2/165  .
. - Angulo, C.; Casarejos, E.; Couder, M.; Demaret, P.; Leleux, P.; Vanderbist, F.; Coc, A.; Kiener, J.; Tatischeff, V.; Davinson, T.; Murphy, A. S. (septembar 2005). „The 7Be(d,p)2α Cross Section at Big Bang Energies and the Primordial 7Li Abundance”. Astrophysical Journal Letters (na jeziku: engleski). 630 (2): L105—L108. Bibcode:2005ApJ...630L.105A. ISSN 0004-637X. arXiv:astro-ph/0508454
 . doi:10.1086/491732
. doi:10.1086/491732  .
. - Boyd, Richard N.; Brune, Carl R.; Fuller, George M.; Smith, Christel J. (novembar 2010). „New nuclear physics for big bang nucleosynthesis”. Physical Review D (na jeziku: engleski). 82 (10): 105005. Bibcode:2010PhRvD..82j5005B. ISSN 1550-7998. S2CID 119265813. arXiv:1008.0848
 . doi:10.1103/PhysRevD.82.105005.
. doi:10.1103/PhysRevD.82.105005. - Hammache, F.; Coc, A.; de Séréville, N.; Stefan, I.; Roussel, P.; Ancelin, S.; Assié, M.; Audouin, L.; Beaumel, D.; Franchoo, S.; Fernandez-Dominguez, B. (decembar 2013). „Search for new resonant states in 10C and 11C and their impact on the cosmological lithium problem”. Physical Review C (na jeziku: engleski). 88 (6): 062802. Bibcode:2013PhRvC..88f2802H. ISSN 0556-2813. S2CID 119110688. arXiv:1312.0894
 . doi:10.1103/PhysRevC.88.062802.
. doi:10.1103/PhysRevC.88.062802. - O'Malley, P. D.; Bardayan, D. W.; Adekola, A. S.; Ahn, S.; Chae, K. Y.; Cizewski, J. A.; Graves, S.; Howard, M. E.; Jones, K. L.; Kozub, R. L.; Lindhardt, L. (oktobar 2011). „Search for a resonant enhancement of the 7Be + d reaction and primordial 7Li abundances”. Physical Review C (na jeziku: engleski). 84 (4): 042801. Bibcode:2011PhRvC..84d2801O. ISSN 0556-2813. doi:10.1103/PhysRevC.84.042801.
- Collaboration, Atlas (2021). „Search for squarks and gluinos in final states with jets and missing transverse momentum using 139 fb$^{-1}$ of $\sqrt{s}$ =13 TeV $pp$ collision data with the ATLAS detector”. Jhep (na jeziku: engleski). 02: 143. S2CID 256039464. arXiv:2010.14293
 . doi:10.1007/JHEP02(2021)143.
. doi:10.1007/JHEP02(2021)143. - Sutter, Paul (2021-01-07). „From squarks to gluinos: It's not looking good for supersymmetry”. Space.com (na jeziku: engleski). Pristupljeno 2021-10-29.
- Holder, Gilbert P.; Nollett, Kenneth M.; van Engelen, Alexander (jun 2010). „On Possible Variation in the Cosmological Baryon Fraction”. Astrophysical Journal (na jeziku: engleski). 716 (2): 907—913. Bibcode:2010ApJ...716..907H. ISSN 0004-637X. arXiv:0907.3919
 . doi:10.1088/0004-637X/716/2/907
. doi:10.1088/0004-637X/716/2/907  .
. - Wu, G.; Huang, M. (2006). „Organolithium Reagents in Pharmaceutical Asymmetric Processes”. Chem. Rev. 106 (7): 2596—2616. PMID 16836294. doi:10.1021/cr040694k.
- Eisch, John J. (2002). „Henry Gilman: American Pioneer in the Rise of Organometallic Chemistry in Modern Science and Technology†”. Organometallics. 21 (25): 5439—5463. ISSN 0276-7333. doi:10.1021/om0109408.
- Rappoport, Z.; Marek, I., ur. (2004). The Chemistry of Organolithium Compounds (2 parts). John Wiley & Sons, Ltd. ISBN 978-0-470-84339-0.
- Reich, H. J.; Borst, J. P; Dykstra, R. R.; Green, P. D. (1993). „A nuclear magnetic resonance spectroscopic technique for the characterization of lithium ion pair structures in THF and THF/HMPA solution”. J. Am. Chem. Soc. 115 (19): 8728—8741. doi:10.1021/ja00072a028.
Spoljašnje veze
[uredi | uredi izvor]- International Lithium Alliance
- McKinsey review of 2018 Arhivirano 16 novembar 2020 na sajtu Wayback Machine (PDF)
- Lithium Arhivirano 16 jul 2016 na sajtu Wayback Machine at The Periodic Table of Videos (University of Nottingham)
- USGS: Lithium Statistics and Information Arhivirano 29 jul 2018 na sajtu Wayback Machine
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth Arhivirano 4 jun 2016 na sajtu Wayback Machine
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5. (PDF) (archived February 26 February 2008)
- Lithium preserves by Country Arhivirano 20 oktobar 2022 na sajtu Wayback Machine at investingnews.com
- Alastair Gunn (16. 6. 2023). „The lithium problem: Why the element keeps disappearing”. BBC Science Focus Magazine. Pristupljeno 17. 6. 2023.














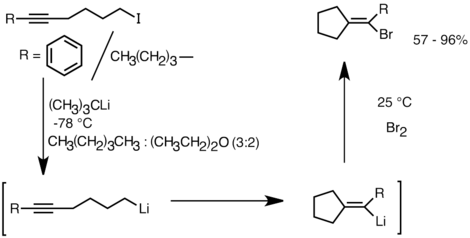
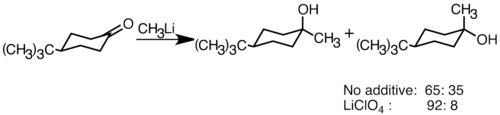














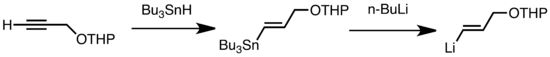







![{\displaystyle \mathrm {Li^{+}+\mathrm {e} ^{-}\ {\xrightarrow[{elektroliza}]{352\,^{\circ }C}}\ Li} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c4f392667eae5fea5bd062050b0b8883488c53c)
![{\displaystyle \mathrm {KCl+LiCl\ {\xrightarrow[{elektroliza}]{352\,^{\circ }C}}\ K+Li+Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cacbb963ddc07c91454983764f2376c1e594a01e)
